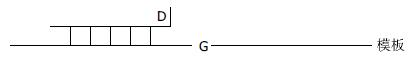修回日期: 2005-01-15
接受日期: 2005-01-20
在线出版日期: 2005-03-01
实时荧光PCR技术自问世以来, 以其高特异性, 高灵敏性, 可定量, 无污染, 而得到了广泛的应用. 该技术是根据荧光共振能量转移(fluorescence resonance energy transfer, FRET)原理, 设计相应的荧光标记核酸探针, 通过PCR反应对相应靶DNA进行均相定性定量测定的技术. 根据检测中所使用的荧光探针分类, 目前已经开发出TaqMan, Molecular Beacon, Scorpion, LightCycler, Single-labeled probe, ResonSense, Angler以及双链探针等相关技术. 本文对该技术的研究进展作一综述.
引文著录: 施林祥, 李东辉. 实时荧光PCR研究新进展. 世界华人消化杂志 2005; 13(5): 596-599
Revised: January 15, 2005
Accepted: January 20, 2005
Published online: March 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(5): 596-599
- URL: https://www.wjgnet.com/1009-3079/full/v13/i5/596.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i5.596
1983年美国PE-Cetus公司的Mullis博士发明了PCR技术, 并于1985年公开报道.1987年该技术获得了美国的专利权, 并于1993年获得了诺贝尔奖.1992年Higuchi提出了实时PCR的设想.1996年美国Applied Biosystems 公司研究出实时荧光定量PCR技术. 该技术不仅实现了PCR从定性到定量的飞跃, 而且采用了完全闭管检测, 不需PCR后处理, 避免了交叉污染. 配以相应的荧光PCR仪, 整个PCR过程可实现自动化, 且耗时短, 操作方便, 较之传统的定量方法劳动强度小, 易于标准化和推广应用. 因而迅速在医学, 检验检疫, 军事, 农业, 科研等领域得到了推广应用.
实时荧光PCR技术的关键在于荧光探针的设计. 荧光探针的种类很多, 实现检测的途径也不完全相同, 但其基本原理都是根据荧光共振能量转移原理(fluorescence resonance energy transfer, FRET)设计的. 当一个荧光分子(供体分子)的荧光光谱与另一个荧光分子(受体分子)的激发光谱相重叠时, 供体荧光分子自身的荧光强度衰减, 受体荧光分子的荧光强度增强, 这种现象即是FRET. FRET现象的发生与供、受体分子的空间距离紧密相关, 一般为7-10 nm时即可发生. 随着距离的延长, FRET现象显著减弱. 当PCR反应开始后, 根据荧光共振能量转移的原理, 荧光探针的发光基团所发出的荧光强度与PCR产物的数量呈对应关系, 因此对荧光信号进行检测就可以实现对PCR产物的准确定量.
实时荧光PCR中有一个很重要的概念, 即Ct值. C代表循环(Cycle), T代表阈值(Threshold). Ct值是指每个反应管内的荧光信号到达设定的阈值时所经历的循环数. 一般取PCR反应的前15个循环的荧光信号作为荧光本底信号, 荧光阈值的缺省设置是3-15个循环的荧光信号的标准偏差的10倍. 研究表明, 每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系, 起始拷贝数越多, Ct值越小. 利用已知起始拷贝数的标准品可做出标准曲线. 因此, 只要获得未知样品的Ct值, 即可从标准曲线上计算出该样品的起始拷贝数.
均相荧光PCR检测需要在普通PCR的基础上加入荧光化合物, 这些荧光化合物广义上可分为嵌入荧光染料和特异性荧光探针两大类型[1]. 利用嵌入荧光染料检测只是简单的反映PCR反应体系中总的核酸量, 是一种非特异性的检测方法. 这些可与双链DNA结合的嵌入型荧光染料包括溴化乙锭、YO-PRO、YOYO、SYBR Green I及SYBR Gold[2]. 他们和双链结合后发出的荧光比和单链结合后发出的荧光强得多. 这种方法存在的问题是他们不能分辩特异性的PCR产物和其他双链DNA, 如引物二聚体. 因此, 需要在PCR后进行熔链曲线分析. 而且利用嵌入荧光染料也不适合进行多重PCR分析[3]. 为了克服这些缺陷, 人们发展了特异性的荧光探针技术. 特异性荧光探针是把荧光化合物标记到特异性的寡核苷酸上形成荧光标记的DNA探针. 通过探针与PCR产物特异性的结合, 在PCR过程中可对产物实现均相、实时、定量检测. 同时也适用于多通道检测. 已报道的实时荧光PCR检测系统(如TaqMan、分子信标), 其杂交探针的设计是建立在两种染料-荧光供体和受体之间的能量共振转移的基础上的. 根据荧光基团标记和实现能量共振转移方式的不同, 荧光PCR所用的探针可以分为五大类.
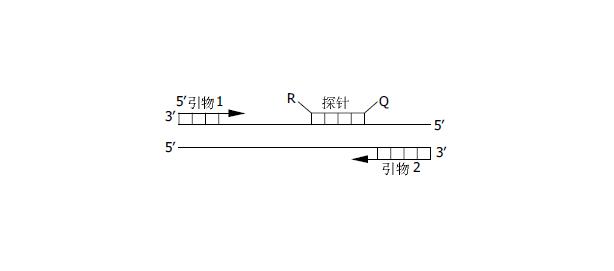
TaqMan探针是一段5'端标记报告荧光基团β, 3'端标记淬灭荧光基团(Q)的寡核苷酸, 其序列与模板DNA中的一段完全互补(图1). 报告荧光基团β如FAM、TET、VIC、JOE、HEX. 淬灭荧光基团为TAMRA(Q). 当探针单独存在时, 由于荧光共振能量转移的发生, R的荧光受到Q的猝灭. 在PCR过程中, 由于Taq DNA酶的5'-3'外切酶活性的作用, 使探针的5'端的R被切断, 加大了与Q的距离而使荧光恢复[4]. 另一种荧光探针Single Labeled Probe Technology, 与TaqMan技术类似. 不同之处在于其寡核苷酸探针只有一个荧光发射基团, 该基团是由带有荧光素的铋螯合物构成, 并标记在寡核苷酸探针的5'端, 而3'末端具有2个碱基不与模板配对, 以保证探针的稳定性. 在游离的状态下铋螯合物发出的荧光比连接单链寡核苷酸时强, 当探针退火与模板互补配对时, 在DNA聚合酶的5'-3'外切酶的作用下, 探针被切断铋螯合物发出较强的荧光信号, 从而实现对目的基因的分析.
分子信标技术由Tyagi和Krammer提出. 分子信标长约25个核苷酸, 在空间结构上呈发夹型, 由环茎杆组成(图2). 环序列与靶DNA序列互补, 长约18-20个核苷酸. 茎杆部分长约5-7个核苷酸, 由GC含量较高的与靶序列无关的互补序列构成. 分子信标的5'端标记报告基团, 3'端标记淬灭基团. 当分子信标处于自由状态时, 发夹结构的两个末端靠近使F与Q靠近. F被淬灭. 当有靶序列存在时, 分子信标与靶序列结合, 使分子信标的茎杆区被拉开. 此时R荧光不能被淬灭, 可检测到荧光[5]. 常用的荧光-淬灭分子对有Coumarin-DABCYL、EADNS-DABCYL、FAM-DABCYL、TET-DABCYL、TAMRA-DABCYL、TexasRed-DABYCL等. 建立在分子信标技术基础上的探针技术有Amplifluor、Sunrise、Amplisensor、Scorpion[6-8]等. 其中Scorpion技术应用广泛. 其设计为在分子信标的3'端通过连接臂连接一段引物(图3). 扩增出包含发夹结构的PCR产物. 包含发夹结构的PCR产物在退火时形成分子内杂交, 发夹结构被破坏, 两个基团之间发生荧光共振能量转移, 从而发出荧光.
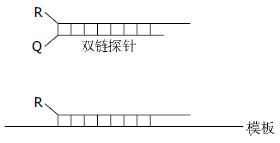
双链探针又称为复合探针, 由互补的两条链构成[9-10]. 长链的5'端标记报告基团, 3'端磷酸化, 短链的3'标记淬灭基团(图4). 没有靶核苷酸存在时, 两条链形成复合体, 荧光被淬灭. 当有靶序列存在时, 带有报告荧光基团的长链探针先和靶结合, 发出荧光.
与其他种类的探针相比, 杂交探针比较容易设计, 每段探针是单标记的. 目前有三种设计形式[11-15].
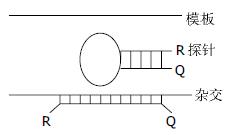
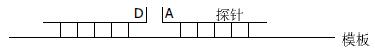
3.4.1 探针/探针形式: 这种方式由两条相邻的探针构成, 荧光供体标记在一条探针上, 另一条相邻的探针标记一长波长的荧光受体分子(图5). 两条探针均与靶序列特异性结合, 且结合后的两条探针只相隔1-5个碱基. 当PCR退火阶段时, 两条探针均与模板相结合, 供受体荧光之间发生了FRET能量转移, 可以检测到供体荧光强度的减弱, 受体荧光强度的增强. 供受体荧光基团之间的间距为1碱基时最为合理. 在间距为5-10碱基时荧光信号强度降低50%, 但在间距15-25碱基时仍能检测出信号.
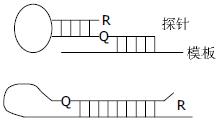
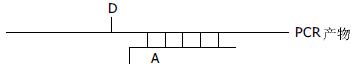
3.4.2 引物/探针形式: 由一条单标记引物和一条单标记探针构成(图6). 标记引物可用于PCR扩增. 距引物3'端3-6个碱基的T碱基经过修饰可用于荧光染料的标记. 另一条探针的3'端标记相应的荧光可于荧光引物扩增出的链相杂交. 在杂交时供体荧光基团和受体荧光基团在相反的链上相距4-6个碱基.
3.4.3 G淬灭探针形式(图7): 只用一条单标记的探针. 在杂交时可以观察到荧光的增强或减弱. 例如, 在探针杂交时FAM或BODIPY-FL在接近G核苷酸时可发生荧光淬灭[16]. 这种探针可以在3'或5'端标记. 探针设计成标记的荧光化合物与靶DNA上的G重合. 靶DNA上邻近的G会增强淬灭的效果. 但第一个位置重叠的G是最重要的.
以上的杂交探针, 5'端标记者其3'端必须磷酸化以阻止在PCR中链的延伸. 在杂交探针中供体荧光基团可采用FAM、FITC, 受体可采用LC-RED640、CY5、LC-RED705.
DNA嵌入剂可以用作荧光供体或受体. 供体可以用SYBR-GREEN I、SYBR-GOLD, 受体可用CY5或CY5.5. 在退火阶段, SYBR-GOLD DNA嵌入剂结合到产生的探针-模板DNA双螺旋里作为荧光供体, 和探针上的受体基团产生FRET作用受体产生荧光. 目前已研发出两种相关技术ResonSense、Angler[17-18]. ResonSense和Angler相类似不同在于探针部分的设计. ResonSense探针部分为单标记探针. Angler为一段探针序列通过一段化学连接头和引物相连, 扩增出包含Angler结构的PCR产物. 退火时形成分子内杂交, 探针上的受体染料基团就会和嵌入DNA双螺旋的荧光供体基团(染料嵌入剂)SYBR-GOLD相作用而产生荧光.
除以上各种荧光探针外, 一些探针如Light-UP、Cyclicons、LUX[19-21]见之报道. 从目前国内外的科研及临床应用情况来看, 以TaqMan, 分子信标, Scorpion以及杂交探针应用较为广泛. 在国内外已开发成功并投放市场的PCR检测试剂盒中, 所运用的主要是TaqMan、分子信标以及杂交探针这三种技术. Scorpion是一种改进型的分子信标[22]. 由于其工作原理是扩增后的单个分子内的杂交, 因此有着更好的动力学和热力学特性. 相比上述三种需分子间杂交的探针, Scorpion杂交速度极快, 更适合快速热循环PCR. 但是由于其合成的难度比较高, 价格比较昂贵, 限制了其广泛的应用. 目前对TaqMan技术的改进也在进行中, Dmitri Proudinkov将淬灭剂从链3'端移至链的中间, 可以将灵敏度提高30倍以上. 同时一种可代替FAM的新的荧光染料Alexa Fluor 488及非荧光和金属淬灭剂也已应用于TaqMan技术, 可使其灵敏度进一步提高.
荧光PCR定量范围极宽, 可以准确定量出103至108个拷贝数的病原体, 具有重要的临床诊断价值[23-24]. 以乙肝为例, 表面抗原强阳性的患者血清中可测得高达每毫升105-108的病毒颗粒, 随着治疗的进程, 病毒拷贝数逐步降低, 部分患者完全治愈后, 血清中病毒数量便测不出. 多数患者在抗原转阴后, 血清PCR反应仍呈阳性, 常规PCR无法得出治愈与否的判定, 而采用荧光定量PCR则可以测到每微升血清含10-1 000个病毒颗粒. 据此, 可建立乙肝治愈的分子诊断标准. 目前已广泛用于丙肝病毒、人类乳头瘤病毒、结核杆菌和食品中大肠杆菌等许多病原体的检测.
人的部分疾病是由基因的点突变引起的如人的地中海贫血病, 因此对相关基因的检测具有重要意义. 基因点突变的检测基于两条探针, 一条探针横跨突变位点, 另一条为锚定探针, 与无突变位点的靶序列杂交. 两条探针用两种不同的发光基团标记. 如靶序列中无突变, 探针杂交便完全配对, 如有突变, 则探针与靶序列不完全配对, 会降低杂交体的稳定性, 从而降低其熔解温度. 这样便可对基因的突变和多态性进行分析.
肿瘤基因的病理性扩增可产生过量的表达蛋白如乳腺癌组织C-erbB-2表达阳性率可达50%左右, p53阳性也在50%左右, 还可表现为基因拷贝数的增加和转录产物mRNA的增加, 这两种变化都可通过荧光PCR的方法进行检测. 肿瘤基因的检测中主要检测以下几种常见癌基因C-erbB2、c-myc、N-myc、K-ras、int2、N-ras、Mdm2、C-fas、K-sam、Met.
人的肌红蛋白小卫星基因, β-珠蛋白基因、apob等基因具有多态性而且在不同的个体中其重复次数也是有差异的. 这种基因的多态性和重复次数的差异性已被应用于个体识别、亲子关系鉴定及法医物证. 其灵敏度已达到可以从一根头发、一个细胞、一个精子取得具有个体特征的DNA指纹图谱, 目前其应用领域已发展到骨髓、器官移植配型及动物遗传种系的研究中.
随着现代生物技术的发展, 转基因食品已逐步进入普通百姓的生活. 由于转基因食品所具有的潜在非安全性, 食品的检测越来越引起各国政府和有关食品监督机构的重视, 基于转基因食品所含特异DNA片段的荧光PCR检测方法已广泛应用于食品的检测. 目前主要检测转基因作物中特有的启动子35S、终止子NOS、耐除草剂基因EPSPS和抗虫基因CryIA(b)等转基因成分, 以确定是否为转基因产品.
荧光PCR技术自建立以来, 发展迅速、应用广泛, 表明其具有强大的生命力. 近些年来, 许多科研工作者基于荧光PCR的基本原理对荧光PCR技术进行不断深入的研究和改进, 使荧光PCR技术得到了进一步地完善, 并在此基础上开发出了许多新的荧光PCR技术. 随着荧光PCR技术的不断发展该技术将在生物学和医学基础研究、农业、疾病诊断、新药开发、食品、环保等广泛的领域中得到更加广泛的推广应用.
编辑: 张海宁
| 2. | Hernandez M, Esteve T, Prat S, Pla M. Development of real-time PCR systems based on SYBR Green I, AmplifluorTM and TaqMan technologies for specific quantitative detection of the transgenic maize event GA21. J Cereal Sci. 2004;39:99-107. |
| 3. | Wittwer CT, Herrmann MG, Gundry CN, Elenitoba-Johnson KSJ. Real-Time Mutiplex PCR Assays. METHODS. 2001;25:430-442. |
| 4. | Proudnikov D, Yuferov V, Zhou Y, LaForge KS, Ho A, Kreek MJ. Optimizing primer-probe design for fluorescent PCR. J Neuroscience Methods. 2003;123:31-45. [PubMed] |
| 5. | Broude NE. Stem-loop oligonucleotides: a robust tool for molecular biology and biotechnology. TRANDS Biotechnol. 2002;20:249. [PubMed] |
| 6. | Schweitzer B, Kingsmore S. Combining nucleic acid amplification and detection. Curr Opinion Biotechnol. 2001;12:21-27. [PubMed] |
| 7. | Saha BK, Tian B, Bucy RP. Quantitation of HIV-1 by real-time PCR with a unique fluorogenic probe. J Virol Met. 2001;93:33-42. [PubMed] |
| 8. | Rickert AM, Borodina TA, Kuhn EJ, Lehrach H, Sperling S. Refinement of single-nucleotide polymorphism genotyping methods on human genomic DNA: amplifluor allele-specific polymerase chain reaction versus ligation detection reaction-TaqMan. Analytical Biochemistry. 2004;330:288-297. [PubMed] |
| 9. | Wang SQ, Wang XH, Chen SH, Guan W. A New fluorescent quantitative polymerase chain reaction technique. Analytical Biochemistry. 2002;309:206-211. [PubMed] |
| 10. | Kong DM, Huang YP, Zhang XB, Yang WH, Shen HX, Mi HF. Duplex probes: a new approach for the detection of specific nucleic acids in homogenous assays. Analytic Chimica Acta. 2003;491:135-143. |
| 11. | Pals G, Young C, Mao HS, Worsham MJ. Detection of a single base substitution in a single cell using the LigheCycler. J Biochem Biophys Methods. 2001;47:121-129. [PubMed] |
| 12. | Hnatyszyn HJ, Podack ER, Young AK, Seivright R, Spruill G, Kraus G. The use of real-time PCR and fluorogenic probes for rapid and accurate genotyping of newborn mice. Mol Cell Probes. 2001;15:169-175. [PubMed] |
| 13. | Kraus G, Cleary T, Miller N, Seivright R, Young AK, Spruill G, Hnatyszyn HJ. Rapid and specific detection of the Mycobaterium tuberculosis complex using fluorogenic probes and real-time PCR. Mol Cell Pro. 2001;15:375-383. |
| 14. | Steffensen R, Hoffmann K, Varming K. Rapid genotyping of MBL2 gene mutations using real-time PCR with fluorescent hybridization probes. J Immunol Met. 2003;278:191-199. |
| 15. | Bernard PS, Pritham GH, Wittwer CT. Color multiplexing Hybridization probes using the apolipoprotein E locus as a model system for genotyping. Anal Biochem. 1999;273:221-228. [PubMed] |
| 16. | Crockett AO, Wittwer CT. Fluorescein-Labeled oligonucleotides for Real-Time PCR: Using the inherent quenching of deoxyguanosine nucleotides. Anal Biochemi. 2001;290:89-97. [PubMed] |
| 17. | Lee AL, Siddle RH, Page RH. ResonSense: simple linear fluorescent probes for quantitative homogeneous rapid polymerase chain reaction. Analytic Chimica Acta. 2002;457:61-70. |
| 18. | Punia P, Cane P, Teo CG, Saunders N. Quantitation of hepatitis B lamivudine resistant mutants by real-time amplification refractory mutation system PCR. J Hepatol. 2004;40:986-992. [PubMed] |
| 19. | Isacsson J, Cao H, Ohlsson L, Nordgren S, Svanvik N, Westman G, Kubista M, Sjoback R, Sehlsted U. Rapid and specific detection of PCR products using light-up probes. Mol Cell Pro. 2000;14:321-328. [PubMed] |
| 20. | Svanvik N, Stahlberg A, Sehlstedt U, Sjoback R, Kubista M. Detection of PCR products in real time using Light-up probes. Anal Biochem. 2000;287:179-182. [PubMed] |
| 21. | Kandimalla ER, Agrawal S. 'yclicons'as hybridization-based fluorescent primer-probes: synthesis, properties and application in real-time PCR. Bioorg Med Chem. 2000;8:1911-1916. [PubMed] |
| 22. | Taveau M, Stockholm D, Spencer M, Richard I. Quantitication of splice variants using molecular beacon or scorpion primers. Anal Biochemi. 2002;305:227-235. [PubMed] |
| 23. | Aliyu SH, Aliyu MH, Salihu HM, Parmar S, Jalal H, Curran MD. Rapid detection and quantitation of hepatitis B virus DNA by real-time PCR using a new fluorescent(FRET)detection system. J Clinical Virol. 2004;30:191-195. [PubMed] |
| 24. | Saukkoriipi A, Palmu A, Kilpi T, Leinonen M. Real-time quantitative PCR for the detection of Streptococcus pneumoniae in the middle ear fluid of children with acute otitis media. Mol Cell Probes. 2002;16:385-390. [PubMed] |