修回日期: 2004-11-21
接受日期: 2004-11-25
在线出版日期: 2005-02-15
目的: 探讨HSP90a在我国结肠癌中的表达特点, 为应用HSP90a抑制剂治疗结肠癌提供依据.
方法: 应用免疫组化SP方法对88例人结肠癌组织中HSP90a的表达进行检测.
结果: HSP90a在结肠癌细胞质表达, 胞质被染成深浅不一的棕黄色. HSP90a表达在不同Dukes分期阳性率差异显著(P<0.01). 其在Dukes B期及C期的阳性率分别为47.17%、80.0%.HSP90a表达分别与患者性别、年龄、癌发部位、癌细胞分化程度及浸润深度等无显著相关性(P>0.05).
结论: HSP90a的表达与结肠癌的浸润进展密切相关, HSP90a抑制剂可用于结肠癌的辅助治疗.
引文著录: 李海军, 戴洁, 张林西, 金春亭, 李玉珍. HSP90a蛋白在人结肠癌中的表达. 世界华人消化杂志 2005; 13(4): 567-569
Revised: November 21, 2004
Accepted: November 25, 2004
Published online: February 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 567-569
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/567.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.567
结肠癌是消化系统最常见的恶性肿瘤之一, 其发生机制目前仍不清楚. 随着对结肠癌研究的深入, 目前已发现多种基因表达异常与其形成有密切关系, 可能是多种基因突变的结果. 近年来, 热休克蛋白(heat shock protein, HSP)与肿瘤的关系是研究的热点之一. 已有研究表明, HSP90a表达异常与消化道系统恶性肿瘤[1-4]、肺癌[5-6]及乳腺癌[7-9]等有关. 而较少有对结肠癌中HSP90a表达状况的研究. 我们应用免疫组化SP方法对88例结肠癌组织中HSP90a的表达进行检测, 探讨其与临床病理特征的关系, 为结肠癌的临床治疗及深入研究提供重要资料.
收集河北北方学院附属第一医院1999-06/2003-07间结肠癌手术切除标本88例. 其中男性54例, 女性34例, 平均年龄54.8岁. ≥60岁51例, <60岁37例. 左半结肠癌63例, 右半结肠癌25例. 高分化腺癌41例, 中分化腺癌36例, 低分化腺癌11例. 浅肌层8例, 深肌层34例, 浆膜层46例. Dukes A期0例, B期53例, C期35例. 所有病例均无同时患其他恶性肿瘤. 患者手术前均未经放疗或化疗. HSP90a抗体为兔抗人多克隆抗体, 美国Santa Cruz公司产品. SP免疫组织化学染色试剂盒及DAB显色剂购自北京中山生物技术有限公司.
手术切除结肠癌标本及时取材, 常规切取癌组织, 同时对区域淋巴结进行取材. 标本经40 g/L中性甲醛溶液固定, 梯度酒精脱水、石蜡包埋, 每个检测蜡块进行连续切片6-8张, 厚度为5 mm. 每例取一张做HE染色常规病理组织检查, 进行病理学诊断及分类, 剩余行免疫组化染色. 切片用医用微波炉进行抗原修复, 按说明书进行免疫组化染色, DAB显色, 苏木素复染, 常规脱水、透明及中性树胶封片. 每批实验均设有已知阳性切片对照及PBS替代Ⅰ抗的阴性对照. 阳性对照片充分显色后终止显色. 光镜下观察, 细胞质被染成大小不等、深浅不一的棕黄色颗粒的为阳性细胞. 癌组织间质不着色. 每张切片随机观察6-8个高倍视野, 阳性细胞数超过5%时即确定为染色阳性病例. 染色结果判定参照1996年全国免疫组织化学技术与诊断标准化专题研讨会意见, 将染色结果分为: 阴性(-), <5%的细胞着色; 弱阳性(+), 细胞质或膜内有5-24%的细胞着色, 为浅黄色颗粒; 阳性(++), 25-50%的细胞着色, 为黄色颗粒; 强阳性(+++), >50%的细胞着色, 为棕黄色颗粒.
统计学处理 实验资料应用SPSS10.0统计软件进行统计分析, HSP90a阳性率的比较采用χ2检验, P<0.05认为差异具有显著性.
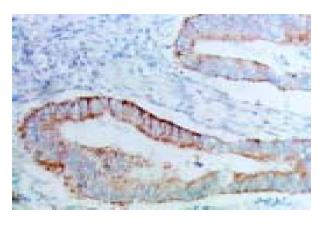
HSP90a蛋白在结肠癌中的表达主要表现为癌细胞胞质呈棕黄色颗粒状(图1), 其表达的阳性率为60.23%(53/88). HSP90a阳性表达分别与患者性别、年龄、癌发部位、分化程度及浸润深度无显著相关性(P>0.05). 但是其表达随浸润深度的增加有逐渐增高趋势. HSP90a的表达与Dukes分期有关(表1).HSP90a在Dukes B期阳性率为47.17%; Dukes C期的阳性率为80%, 组间差异具有显著性(P<0.01).
| 临床病理特征 | n | HSP90a表达 | ||
| 阳性例数(%) | P | |||
| 性别 | 男 | 54 | 32(59.26) | 0.815 |
| 女 | 34 | 21(61.76) | ||
| 年龄 | ≥60 | 51 | 33(64.71) | 0.314 |
| <60 | 37 | 20(54.05) | ||
| 部位 | 左半结肠 | 63 | 39(61.90) | 0.610 |
| 右半结肠 | 25 | 14(56.00) | ||
| 分化程度 | 高分化 | 41 | 25(60.98) | 0.590 |
| 中分化 | 36 | 20(55.56) | ||
| 低分化 | 11 | 8(72.73) | ||
| 浸润深度 | 浅肌层 | 8 | 3(37.50) | 0.328 |
| 深肌层 | 34 | 20(58.82) | ||
| 浆膜层 | 46 | 30(65.22) | ||
| Dukes分期 | A | 0 | 0 | 0.002 |
| B | 53 | 25(47.17) | ||
| C | 35 | 28(80.00) | ||
热休克蛋白(heat shock protein, HSP)是指细胞在应激原特别是环境高温诱导下所生成的一组高度保守性蛋白质, 这一现象被称为热休克应答(heat shock response, HSR).HSP的生成是普遍存在于从细菌直至人类的整个生物界的一种现象. 一般根据其同源程度以及分子量的大小可分为HSP110、HSP90、HSP70、HSP60、小分子HSP及泛素等几个家族. HSP在进化过程中具有高度保守性, 说明他们具有普遍存在的重要生理功能. 其主要是通过在应激状态下生成保护细胞生命活动必需的蛋白质以维持细胞的生存. HSP通常与具有不同功能的多种蛋白质在细胞中形成复合体, 并通过复合体的形成或者解离而参与有关蛋白的折叠、亚基的组成、细胞内运输以及蛋白质降解等过程, 以调节靶蛋白的活性和功能, 但又不参与靶蛋白的组成. 因此, HSP又被认为是一种"分子伴侣(molecular chaperone)"或"伴侣蛋白"[10].
近年研究发现, HSP与肿瘤的发生、发展以及肿瘤患者的预后等都有密切关系. 但不同家族的HSP及同一家族内HSP的不同成员在肿瘤发生中各自所起的作用尚有待进一步研究. 目前, 在众多HSP中对HSP70研究较多. 一些学者报道[11-12], HSP70在一些肿瘤组织中表达增加. 但关于HSP90与肿瘤的关系特别是与结肠癌的关系的研究报道较少. HSP90以是否含有丰富的谷氨酰胺片段而分为HSP90a和HSP90b两类. HSP90多以a-a和b-b同源二聚体形式存在. 在胰腺癌中, HSP90a呈选择性高表达[3]. 在本研究中, 我们应用免疫组化方法, 对HSP90a在结肠癌细胞中的表达进行了研究. HSP90a在结肠癌组织中表达的阳性率为60.23%(53/88), 提示其可能与结肠癌的形成及发展有关.
HSP90a可通过调节细胞周期而促进细胞增生[12-13]. 本研究中, HSP90a在结肠癌组织中的表达分别与患者性别、年龄、癌的发生部位、分化程度及浸润深度无显著相关性(P>0.05). 但HSP90a的表达随癌细胞浸润深度的增加阳性率有增高趋势. 我们还发现, HSP90a表达与Dukes分期密切相关. 随Dukes分期的增高, HSP90a表达阳性率明显增高. Dukes B期为47.17%, Dukes C期为80%.说明结肠癌的浸润进展及转移与HSP90a表达显著相关. HSP90a表达阳性率愈高, 患者病期可能愈晚, 可能已经发生了淋巴结转移, 提示患者预后较差. 有研究认为[11,13-14], HSP可能是判断患者预后的标志物. HSP90在乳腺癌中高表达往往预示着预后较差[12].
研究发现, HSP90a可能是新的抗癌药物治疗恶性肿瘤的新的分子靶点[15-17]. 目前, HSP90抑制剂如17AAG已经进入Ⅰ期临床试验[17-18], 针对HSP90分子靶点的对不同肿瘤的研究正在进行中[19-22]. 不久的将来HSP90抑制剂用来治疗结肠癌等恶性肿瘤将成为现实. 因此, 对恶性肿瘤中HSP90表达水平的检测就显得尤为重要.
总之, 机体在应答各种环境压力刺激时所产生的HSP对机体具有保护作用. HSP90a与肿瘤的关系尤其是在结肠癌的发生、预后评估和抗肿瘤治疗等方面的具体作用及机制有待更深入的研究.
编辑: 张海宁
| 1. | Liu XL, Xiao B, Yu ZC, Guo JC, Zhao QC, Xu L, Shi YQ, Fan DM. Down-regulation of Hsp90 could change cell cycledistribution and increase drug sensitivity of tumor cells. World J Gastroenterol. 1999;5:199-208. [PubMed] [DOI] |
| 2. | Zuo DS, Dai J, Bo AH, Fan J, Xiao XY. Significance of expression of heat shock protein90alpha in human gastriccancer. World J Gastroenterol. 2003;9:2616-2618. [PubMed] |
| 3. | Ogata M, Naito Z, Tanaka S, Moriyama Y, Asano G. Overexpression and localization of heat shock proteins mRNAin pancreatic carcinoma. J Nippon Med Sch. 2000;67:177-185. [PubMed] [DOI] |
| 4. | Schueller G, Paolini P, Friedl J, Stift A, Dubsky P, Bachleitner-Hofmann T, Jakesz R, Gnant M. Heat treatment ofhepatocellular carcinoma cells: increased levels of heat shock proteins 70 and 90 correlate with cellular necrosis. Anticancer Res. 2001;21:295-300. [PubMed] |
| 5. | Zhong L, Peng X, Hidalgo GE, Doherty DE, Stromberg AJ, Hirschowitz EA. Antibodies to HSP70 and HSP90 in serumin non-small cell lung cancer patients. Cancer Detect Prev. 2003;27:285-290. [PubMed] [DOI] |
| 6. | Luo LY, Herrera I, Soosaipillai A, Diamandis EP. Identification of heat shock protein 90 and other proteins astumour antigens by serological screening of an ovarian carcinoma expression library. Br J Cancer. 2002;87:339-343. [PubMed] [DOI] |
| 7. | Beliakoff J, Whitesell L. Hsp90: an emerging target for breast cancer therapy. Anticancer Drugs. 2004;15:651-662. [PubMed] [DOI] |
| 8. | Beliakoff J, Bagatell R, Paine-Murrieta G, Taylor CW, Lykkesfeldt AE, Whitesell L. Hormone-refractory breast cancerremains sensitive to the antitumor activity of heat shock protein 90 inhibitors. Clin Cancer Res. 2003;9:4961-4971. [PubMed] |
| 9. | Solit DB, Basso AD, Olshen AB, Scher HI, Rosen N. Inhibition of heat shock protein 90 function down-regulates Aktkinase and sensitizes tumors to Taxol. Cancer Res. 2003;63:2139-2144. [PubMed] |
| 11. | Lazaris AC, Theodoropoulos GE, Davaris PS, Panoussopoulos D, Nakopoulou L, Kittas C, Golematis BC. Heat shockprotein 70 and HLA-DR molecules tissue expression. Prognostic implications in colorectal cancer. Dis Colon Rectum. 1995;38:739-745. [PubMed] [DOI] |
| 12. | Yano M, Naito Z, Tanaka S, Asano G. Expression and roles of heat shock proteins in human breast cancer. Jpn J Cancer Res. 1996;87:908-915. [PubMed] [DOI] |
| 13. | Ciocca DR, Clark GM, Tandon AK, Fuqua SA, Welch WJ, McGuire WL. Heat shock protein hsp70 in patients withaxillary lymph node-negative breast cancer: prognostic implications. J Natl Cancer Inst. 1993;85:570-574. [PubMed] [DOI] |
| 14. | Hettinga JV, Lemstra W, Meijer C, Los G, de Vries EG, Konings AW, Kampinga HH. Heat-shock protein expressionin cisplatin-sensitive and -resistant human tumor cells. Int J Cancer. 1996;67:800-807. [PubMed] [DOI] |
| 15. | Solit DB, Scher HI, Rosen N. Hsp90 as a therapeutic target in prostate cancer. Semin Oncol. 2003;30:709-716. [PubMed] [DOI] |
| 16. | Banerji U, Judson I, Workman P. The clinical applications of heat shock protein inhibitors in cancer - present andfuture. Curr Cancer Drug Targets. 2003;3:385-390. [PubMed] [DOI] |
| 17. | Kamal A, Thao L, Sensintaffar J, Zhang L, Boehm MF, Fritz LC, Burrows FJ. A high-affinity conformation of Hsp90confers tumour selectivity on Hsp90 inhibitors. Nature. 2003;425:407-410. [PubMed] [DOI] |
| 18. | Burger AM, Fiebig HH, Stinson SF, Sausville EA. 17-(Allylamino)-17-demethoxygeldanamycin activity in humanmelanoma models. Anticancer Drugs. 2004;15:377-387. [PubMed] [DOI] |
| 19. | Vasilevskaya IA, Rakitina TV, O'Dwyer PJ. Quantitative effects on c-Jun N-terminal protein kinase signalingdetermine synergistic interaction of cisplatin and 17-allylamino-17-demethoxygeldanamycin in colon cancer cell lines. Mol Pharmacol. 2004;65:235-243. [PubMed] [DOI] |
| 20. | Braga-Basaria M, Hardy E, Gottfried R, Burman KD, Saji M, Ringel MD. 17-Allylamino-17-demethoxygeldanamycinactivity against thyroid cancer cell lines correlates with heat shock protein 90 levels. J Clin Endocrinol Metab. 2004;89:2982-2988. [PubMed] [DOI] |
| 21. | Bisht KS, Bradbury CM, Mattson D, Kaushal A, Sowers A, Markovina S, Ortiz KL, Sieck LK, Isaacs JS, Brechbiel MW. Geldanamycin and 17-allylamino-17-demethoxygeldanamycin potentiate the in vitroand in vivo radiation response of cervical tumor cells via the heat shock protein 90-mediated intracellular signalingand cytotoxicity. Cancer Res. 2003;63:8984-8995. [PubMed] |
| 22. | Enmon R, Yang WH, Ballangrud AM, Solit DB, Heller G, Rosen N, Scher HI, Sgouros G. Combination treatment with17-N-allylamino-17-demethoxy geldanamycin and acute irradiation produces supra-additive growth suppression inhuman prostate carcinoma spheroids. Cancer Res. 2003;63:8393-8399. [PubMed] |