修回日期: 2004-11-18
接受日期: 2004-11-22
在线出版日期: 2005-02-15
目的: 探讨胃腺癌细胞株SGC7901中Fas及FasL基因转录与表达情况, 为胃癌与Fas及FasL基因的相关研究提供帮助.
方法: 利用反转录聚合酶链反应(RT-PCR)检测胃腺癌细胞株SGC7901中Fas及FasL基因mRNA转录情况. 采用免疫细胞化学染色鉴定胃腺癌细胞株SGC7901中Fas及FasL基因有无蛋白表达及其表达程度.
结果: 从提取的胃癌细胞总RNA中分别扩增出Fas及FasL的DNA片段, 免疫细胞化学染色亦显示胃腺癌细胞株SGC7901中存在Fas及FasL蛋白表达产物.
结论: 中国人胃腺癌细胞株SGC7901中存在Fas及FasL基因的mRNA转录及蛋白的表达.
引文著录: 齐明, 周世庆, 汪素文, 真岩波, 张淑红. 胃腺癌细胞株SGC7901中Fas及FasL的基因转录与表达. 世界华人消化杂志 2005; 13(4): 565-566
Revised: November 18, 2004
Accepted: November 22, 2004
Published online: February 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 565-566
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/565.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.565
Fas又称Apol或CD95, FasL(Fas Ligand, Fas配体)又称CD95L. 目前的研究认为, FasL是死亡因子, Fas则是他的受体, 当一个细胞的FasL与另一细胞的Fas结合时, 可以导致表达Fas的细胞凋亡. 国外已有研究表明[1,7], 胃癌组织中存在Fas和FasL的表达. 已知胃腺癌细胞株SGC7901为国内研究胃癌常用的细胞株, 为此, 我们利用此株作为研究对象, 对其内Fas和FasL的基因转录和蛋白表达进行了检测.
人胃癌细胞株SGC7901细胞由山东省医科院提供, 在50 mL/L CO2, 温度37 ℃条件下, 生长在含100 mL/L小牛血清的RPMI-1640培养液中. 待细胞贴壁长满后, 收集细胞悬液以满足不同需要.
1.2.1 逆转录-聚合酶链反应(RT-PCR)检测Fas、FasL mRNA的表达: 取生长良好的SGC7901细胞5×106, 以Trizol试剂(美国GIBCO公司)提取总RNA, 以紫外分光光度计检验纯度并定量, 在4 g/L甲醛变性凝胶上电泳验证RNA完整. RT-PCR采用一步法试剂盒(日本KaTaRa公司), 按厂家推荐步骤进行. 实验中以β-actin为内参照, 对样品模板用量标准化. 引物设计: β-actin上游: 5'ATCATGTTTGAGACCTTCAACA 3', 下游: 5'CATCTCTTGCTCGAAGTCCA 3'; Fas上游: 5'CATGGCTTAGAAGTGGAAAT 3', 下游: 5'ATTTATTGCCACTGTTTCAGG 3'; FasL 上游: 5'ATGTTTCAGCTCTTCCACCTACAGA 3; 下游: 5'AGAGAGAGCTCAGATACGTTGAC 3'.RT-PCR循环条件: 94 ℃变性1 min, 58 ℃退火1 min, 72 ℃延伸1 min, 共35个循环, 最后72 ℃充分延伸7 min. 基因扩增产物在15 g/L琼脂糖凝胶上电泳, 以Fluor-S多功能成像系统(美国BIO-RAD公司)扫描拍照.
1.2.2 免疫细胞化学染色: 取生长良好的SGC7901细胞进行免疫细胞化学染色, 采用爬片的方法制备细胞标本, 方法简介如下: 标本用PBS洗去培养基, 细胞经冷丙酮固定10 min(室温)后, 按免疫细胞化学染色试剂盒(购自武汉博士德生物工程有限公司)说明步骤完成免疫细胞化学染色. 一抗为兔抗人纯化抗体(1:500), 37 ℃ 孵育1 h, 滴加二抗生物素化山羊抗兔IgG(1:100)37 ℃ 20 min, 以PBS替代一抗作为阴性对照. 空白对照和替代对照均显示阴性的前提下, 以在细胞膜、胞质内出现棕黄色物且染色强度高于空白对照背景者为阳性. 数3个以上高倍镜视野, 细胞数大于500个, 计算阳性率.
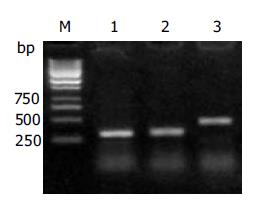
2.1 RT-PCR扩增产物琼脂糖凝胶电泳条带分析显示, 胃癌细胞株SGC-7901细胞总RNA中分别扩出339 bp和499 bp大小的产物, 与引物设计的预期扩增片段大小一致, 提示胃癌细胞株SGC7901细胞中有Fas、FasL基因mRNA的表达(图1).
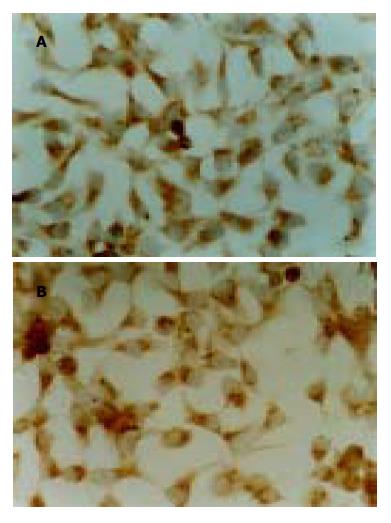
2.2 免疫组织化学染色显示胃癌细胞株SGC7901细胞中有Fas、FasL蛋白的表达, 两种蛋白主要分布在细胞质中, 呈棕黄色(图2), 其阳性表达率分别为 42.8%和 74.3%.
Fas为I型跨膜蛋白, 属肿瘤坏死因子受体(TNFR)及神经生长因子受体(NGFR)家族成员, Fas广泛存在于多种类型的细胞膜上; FasL为Ⅱ型跨膜糖蛋白, 属TNF家族成员, FasL主要表达于活性T淋巴细胞[2]、NK细胞及LAK细胞等免疫细胞的细胞膜上, 此外在免疫豁免组织(脑、睾丸、眼)的细胞膜上也有FasL的天然表达[3].FasL是一种细胞凋亡因子, 为Fas的配体, 当其与细胞表面的Fas结合后可激活细胞内凋亡信号, 引起Fas阳性细胞的凋亡[4].
活性T细胞及NK 细胞通过利用Fas/FasL系统介导的细胞凋亡作用, 清除体内的病毒感染细胞、异体移植物、衰老的单核细胞、中性粒细胞以及部分激活的T、B细胞来发挥细胞免疫、维持免疫平衡及调节免疫反应等重要作用. 在免疫豁免组织中, 由于这些组织的细胞膜上FasL表达, 可导致邻近的活性T淋巴细胞凋亡, 使这些部位免受炎症侵害, 从而起到免疫豁免作用. 由此可见, 通过Fas/FasL系统介导Fas阳性的细胞凋亡不仅可由活性T细胞引起, 而且表达FasL的细胞同样可以引起Fas阳性的活性T细胞凋亡, 以达到免疫下调作用. 研究发现, 许多恶性肿瘤细胞膜上Fas表达明显下调, 而FasL表达增高[5], 这与免疫豁免组织中表现一致, 认为这些恶性肿瘤在机体内类似于免疫豁免组织, 使机体对肿瘤的免疫作用下调, 从而逃避了机体对肿瘤细胞的免疫清除. 亦有学者认为在肿瘤的免疫逃避过程中起关键性作用的是FasL表达增高而不是Fas表达下调[2,5].
胃癌细胞株SGC7901是国内学者利用国人胃癌组织自行建株的细胞系, 也是国内研究胃癌病因及治疗中最常用的人胃腺癌细胞株[6], 确定其有无Fas和FasL的基因转录和蛋白的表达, 将对利用Fas和FasL基因进行胃癌的治疗等相关研究提供极大帮助. Liet al[7]研究发现, Fas蛋白在胃癌组织中的表达为19.0%, 在正常胃黏膜中为64.2%; FasL蛋白在胃癌组织中的表达为63.8%, 在正常胃黏膜中为45.3%.我们通过RT-PCR和免疫细胞化学染色对SGC7901细胞株中Fas和FasL基因表达情况进行了检测, 发现此种细胞株均存在Fas和FasL基因的mRNA转录及较强的蛋白表达, 结果与Li et al的结果相符. 本研究不仅为以后科研人员利用这种胃癌细胞株进行Fas和FasL基因的相关研究提供了极大的方便, 同时也提示中国人胃腺癌细胞也存在Fas和FasL基因的表达, 且FasL的表达明显高于Fas的表达. 提示在胃癌的发生、发展过程中存在免疫逃逸机制, 上调Fas的表达或阻断FasL的表达, 将有助于对胃癌的治疗.
编辑: 张海宁
| 1. | Martin JH, Potthoff A, Ledig S, Cornberg M, Jandl O, Manns MP, Kubicka S, Flemming P, Athmann C, Beil W. Effect of H. pylori on the expression of TRAIL, FasL and their receptor subtypes in human gastric epithelial cells andtheir role in apoptosis. Helicobacter. 2004;9:371-386. [PubMed] [DOI] |
| 2. | Hahne M, Rimoldi D, Schroter M, Romero P, Schreier M, French LE, Schneider P, Bornand T, Fontana A, Lienard D. Melanoma cell expression of Fas(Apo-1/CD95)ligand: implications for tumor immune escape. Science. 1996;274:1363-1366. [PubMed] [DOI] |
| 3. | Medvedev AE, Johnsen AC, Haux J, Steinkjer B, Egeberg K, Lynch DH, Sundan A, Espevik T. Regulation of Fas and Fasligand expression in NK cell by cytokine and the involvement of Fas-ligand in NK/LAK cell-mediated cytotoxicity. Cytokine. 1997;9:394-404. [PubMed] [DOI] |
| 4. | Dechant MJ, Fellenberg J, Scheuerpflug CG, Ewerbeck V, Debatin KM. Mutation analysis of the apoptotic "death-receptors"and the adaptors TRADD and FADD/MORT-1 in osteosarcoma tumor samples and osteosarcoma cell lines. Int J Cancer. 2004;109:661-667. [PubMed] [DOI] |
| 5. | Cui H, Sherr DH, el-Khatib M, Matsui K, Panka DJ, Marshak-Rothstein A, Ju ST. Regulation of T-cell death genes:selective inhibition of FasL but not Fas mediated function. Cell Immunol. 1996;167:276-284. [PubMed] [DOI] |
| 7. | Li Z, Wang Z, Zhao Z, Zhang Y, Ke Y. Expression of Fas, FasL and IFN-γamma in gastric cancer. Beijing Daxue Xuebao. 2003;35:386-389. |