修回日期: 2005-01-13
接受日期: 2005-01-20
在线出版日期: 2005-02-15
目的: 观察特异性COX-2抑制剂塞来昔布对体外培养的SGC7901胃腺癌细胞生长及环氧化酶活性的作用.
方法: 采用MTT比色法观察不同浓度的塞来昔布对COX-2高表达的人胃癌细胞SGC7901生长的影响, 免疫细胞化学方法检测COX-2蛋白的表达; 同时用相差显微镜动态观察细胞形态及生长方式的改变.
结果: 塞来昔布25 mmol/L对SGC7901细胞生长无抑制作用, 作用72 h后细胞存活率为80.0%; 50-100 mmol/L的塞来昔布与SGC7901细胞相互作用24 h细胞存活率分别为88.5%, 80.7%, 42.3%, 48 h细胞存活率分别为79.8%, 60.2%, 40.1%, 72 h细胞存活率分别为58.6%, 37.8%、21.2%.塞来昔布同时减少COX-2蛋白表达; 当浓度为50 mmol/L的塞来昔布与胃癌SGC7901细胞作用后, COX-2表达明显下降, 并呈剂量依赖关系.
结论: 塞来昔布能抑制SGC7901胃癌细胞株的生长及COX-2蛋白表达.
引文著录: 夏敏, 郭继中, 严洁, 唐建英. 塞来昔布对胃癌细胞生长的抑制作用. 世界华人消化杂志 2005; 13(4): 555-556
Revised: January 13, 2005
Accepted: January 20, 2005
Published online: February 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 555-556
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/555.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.555
COX-2表达增加可见于人类多种肿瘤, COX-2受抑可抑制几种动物肿瘤模型肿瘤的生长[1], COX-2表达增加提示患者的预后较差[2], 因此COX-2成为肿瘤化学预防的靶目标. 胃癌是我国常见的消化道恶性肿瘤, 进展期胃癌的疗效不尽人意, 对胃癌的防治是目前研究的热点, 研究发现胃癌及不典型增生患者COX-2 mRNA及蛋白的表达增加[3-4], 而塞来昔布对胃癌的防治作用国内报道较少, 我们探讨塞来昔布抗人胃癌细胞株SGC7901细胞增生作用机制如下.
RPMI1640培养基, 小牛血清购自Gibco公司; MTT, DMSO购自Sigma公司; 塞来昔布由普强苏州制药有限公司提供; 山羊抗人COX-2多克隆抗体购自Santa Cruz公司; 人胃癌细胞系SGC7901购自中科院上海细胞所.
取对数生长期的细胞以每孔5×103个细胞接种于96孔培养基中, 37 ℃, 50 mL/L CO2条件下培养24 h, 分别加入以DMSO溶解的不同浓度的塞来昔布(25, 50, 75, 100 mmol/L), 并设含相同浓度DMSO的空白对照, 继续培养24 h和48 h, 每孔加MTT(5 g/L)20 mL, 作用4 h后加DMSO150 mL, 震荡10 min, 使结晶物充分溶解, 酶联免疫检测仪测其吸光度, 计算细胞存活率(%) = 实验组平均A值/对照组平均A值×100%.另将细胞悬液接种在24孔板内预先处理的玻片上, 继续培养24 h后加入不同浓度的塞来昔布, 设溶剂DMSO为对照组, 培养72 h后取出玻片, PBS清洗后乙醇固定, 采用常规SP法测COX-2蛋白. 另相差显微镜下动态观察SGC7901细胞经不同浓度塞来昔布处理后细胞在大小、形态及生长方式上的改变.
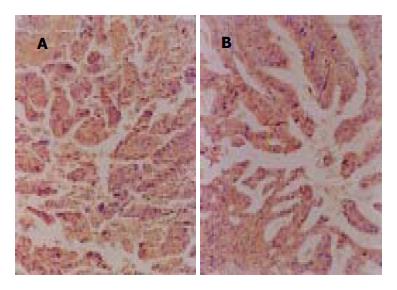
塞来昔布处理组SGC7901细胞形态体积略大, 呈圆形或多边形, 核浆比例少, 异型性降低, 细胞呈单层生长, 在长至100%汇合后恢复接触抑制和密度抑制, 在用药后3 d 100 mmol/L处理组大部分细胞老化、死亡; 而对照组SGC7901细胞大小形态不一, 能叠加成堆生长, 丧失接触抑制和密度抑制的特性. 塞来昔布25 mmol/L对SGC7901细胞生长无抑制作用, 作用72 h后细胞存活率为80.0%, 50-100 mmol/L的塞来昔布与SGC7901细胞相互作用后, 24 h细胞存活率分别为88.5%, 80.7%, 42.3%; 48 h细胞存活率分别为79.8%, 60.2%, 40.1%; 72 h细胞存活率分别为58.6%, 37.8%, 21.2%.随着药物浓度的增加及作用时间的延长, 细胞存活率逐渐下降, 呈时间剂量依赖性关系. 免疫细胞化学染色显示, 胃癌SGC7901细胞有COX-2蛋白的表达(图1A). 当浓度为50 mmol/L的塞来昔布与胃癌SGC7901细胞作用后, COX-2表达明显下降, 塞来昔布浓度越高, 其抑制COX-2表达的作用越明显(图1B).
胃癌组织中COX-2表达增加, 而正常胃黏膜组织未有COX-2蛋白表达, Lim et al[5]发现COX-2过度表达尚见于肠腺化生和腺瘤等癌前状态, 认为COX-2可能在胃癌形成的早期事件中起作用, 与肿瘤的血管生成[6]及淋巴结转移有关. 塞来昔布是第一个COX-2特异性抑制剂, 在由化学性诱导剂所致的多发肠肿瘤的鼠模型中, 塞来昔布可抑制71%肠肿瘤的发生; 在偶氮甲烷所致的鼠大肠癌模型中, 塞来昔布可使大肠癌的发生率和数量分别减少93%和97%, 并抑制结肠异常腺管灶的形成[7]. 塞来昔布通过激活NF-κB或抑制蛋白激酶B(PKB)/AKT的激活促进体外培育的结肠癌株凋亡而抑制细胞增生[8], 而他的抗肿瘤增生效应尚未在胃癌中证实, Saukkonen et al[9]研究发现在三叶肽生长因子-1缺乏鼠腺瘤模型中, COX-2表达增加, 使用塞来昔布可减小腺瘤的大小, 其作用机制可能通过炎症和促溃疡形成作用扰乱腺瘤的完整性[10]. 我们用MTT方法证实塞来昔布呈时间、剂量依赖性方式抑制人胃癌细胞SGC7901增生, 相差显微镜发现塞来昔布处理组SGC7901细胞异型性降低, 细胞呈单层生长, 在长至100%汇合后恢复接触抑制和密度抑制, 在用药第3 d后100 mmol/L处理组大部分细胞老化、死亡; 而对照组SGC7901细胞大小形态不一, 能叠加成堆生长, 丧失接触抑制和密度抑制的特性, 因此塞来昔布可抑制人胃癌细胞的增生. 塞来昔布可通过多种途径抑制肿瘤的生长, 免疫细胞化学发现SGC-7901胃癌细胞株有较高水平的COX-2表达, 经塞来昔布作用后癌细胞株COX-2的表达水平明显降低, 故塞来昔布抑制胃癌细胞生长可能是通过抑制COX-2的表达, 进而抑制前列腺素的合成而实现. 前列腺素可诱导免疫抑制[1], 抑制COX-2可加重食物抗原诱导的大鼠炎症性肠病模型的肠黏膜损害, 故前列腺素可防止免疫介导的胃肠道损伤, 其机制是通过改变淋巴细胞和巨噬细胞IL-10, IL-12的释放[11]及抑制T细胞和自然杀伤细胞的活性导致免疫抑制. 因此, 应用环氧化酶抑制剂塞来昔布可减低肿瘤引起的免疫抑制作用. 另外, Uefuji et al[6]证实了微血管密度与COX-2表达强度的关系, COX-2通过诱导血管内皮生长因子和转化生长因子b、刺激内皮细胞移行和管腔形成促进血管生成. 在一项对大鼠血管增生模型的研究中, 观察到塞来昔布可抑制体内成纤维细胞生长因子诱导的促角膜新生血管的形成[12], 因此塞来昔布也可抑制肿瘤血管的增生.
编辑: 潘伯荣 审读:张海宁
| 1. | Gupta RA, DuBois RN. Colorectal cancer prevention and treatment by inhibition of cyclooxygenase-2. Nat Rev Cancer. 2001;1:11-21. [PubMed] [DOI] |
| 2. | Buskens CJ, VanRees BP, Sivula A, Reitsma JB, Haglund C, Bosma PJ, Offerhaus GJ, Van Lanschot JJ, Ristimaki A. Prognostic significance of elevated cyclooxygenase-2 expression in patients with adenocarcinoma of the esophagus. Gastroenterology. 2002;122:1800-1807. [PubMed] [DOI] |
| 3. | Saukkonen K, Nieminen O, van Rees B, Vilkki S, Harkonen M, Mecklin JP, Sipponen P, Ristimaki A. Expression ofcyclooxygenase-2 in dysplasia of the stomach and in intestinal-type gastric adenocarcinoma. Clin Cancer Res. 2001;7:1923-1931. [PubMed] |
| 4. | van Rees BP, Saukkonen K, Ristimaki A, Polkowski W, Tytgat GN, Drillenburg P, Offerhaus GJ. Cyclooxygenase-2expression during carcinogenesis in the human stomach. J Pathol. 2002;196:171-179. [PubMed] [DOI] |
| 5. | Lim HY, Joo HJ, Choi JH, Yi JW, Yang MS, Cho DY, Kim HS, Nam DK, Lee KB, Kim HC. Increased expression ofcyclooxygenase-2 protein in human gastric caicinoma. Clin Cancer Res. 2000;6:519-525. [PubMed] |
| 6. | Uefuji K, Ichikura T, Mochizuki H. Cyclooxygenase-2 expression is related to prostaglandin biosynthesis and inangiogenesis in human gastric cancer. Clin Cancer Res. 2000;6:135-138. [PubMed] |
| 7. | Jacoby RF, Cole CE, Tutsch K, Newton MA, Kelloff G, Hawk ET, Lubet RA. Chemopreventive efficacy of combinedpiroxicam and difluoromethylornithine treatment of APC mutant Min mouse adenomas, and selective toxicity againstAPC mutant embryos. Cancer Res. 2000;60:1864-1870. [PubMed] |
| 8. | Grosch S, Tegeder I, Niderberger E, Brautigam L, Geisslinger G. COX-2 independent induction of cell cycle arrestand apoptosis in colon cancer cells by the selective COX-2 inhibitor celecoxib. FASEA J. 2001;15:2742-2744. [PubMed] |
| 9. | Saukkonen K, Rintahaka J, Sivula A, Buskens CJ, Van Rees BP, Rio MC, Haglund C, Van Lanschot JJ, Offerhaus GJ, Ristimaki A. Cyclooxygenase-2 and gastric carcinogenesis. APMIS. 2003;111:915-925. [PubMed] [DOI] |
| 10. | Saukkonen K, Tomasetto C, Narko K, Rio MC, Ristimaki A. Cyclooxygenase-2 expression and effect of celecoxib ingastric adenomas of trefoil factor 1-deficient mice. Cancer Res. 2003;63:3032-3036. [PubMed] |
| 11. | Stolina M, Sharma S, Lin Y, Dohadwala M, Gardner B, Luo J, Zhu L, Kronenberg M, Miller PW, Portanova J. Specific inhibition of cyclooxygenase-2 restores antitumor reactivity by altering the balance of IL-10and IL-12 synthesis. J Immunol. 2000;164:361-370. [PubMed] [DOI] |
| 12. | Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM, Edwarda DA, Flickinger AG, Moore RJ, Seibert K. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitions. Cancer Res. 2000;60:1306-1311. [PubMed] |