修回日期: 2004-12-21
接受日期: 2005-01-08
在线出版日期: 2005-02-15
目的: 探讨抑癌基因p27Kip1对肝癌细胞的抑制作用.
方法: 利用脂质体介导法将真核表达载体pcDNA3.1/Myc-His(+)C-p27Kip1基因导入肝癌细胞株HHCC细胞中, 经G418筛选获得稳定表达的细胞克隆, 用MTT、3H-TdR掺入法和克隆形成实验观察抑癌基因p27Kip1对肝癌细胞增生及DNA合成的影响, 电子显微镜技术探讨过表达的p27Kip1抑制肝癌细胞生长的可能机制.
结果: 抑癌基因p27Kip1对肝癌细胞增生及DNA合成均有明显抑制作用, 抑制率达56%(P<0.01 vs 转染空载体组), 电镜结果显示肝癌细胞发生凋亡.
结论: 抑癌基因p27Kip1可能通过诱导肝癌细胞凋亡抑制肝癌细胞生长.
引文著录: 安家泽, 董宏林, 窦科峰. 抑癌基因p27Kip1对肝癌细胞增生及DNA合成的影响. 世界华人消化杂志 2005; 13(4): 548-550
Revised: December 21, 2004
Accepted: January 8, 2005
Published online: February 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 548-550
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/548.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.548
p27kipI是在转化生长因子(TGF-β)处理的生长抑制细胞及接触生长抑制的细胞株中, 发现的一种相对分子质量(Mr)为27 000的耐热细胞周期抑制蛋白[1].p27kipI作为一种调控细胞周期的枢纽蛋白, 可以多种方式调节肿瘤细胞的增生或凋亡. 近年研究发现, p27Kip1基因及其产物对于细胞的生长有着极其重要的调控作用, 是一种潜在的抑癌基因, 因此他的抗癌机制成为生物医学领域重要的研究课题. 我们研究采用体外细胞培养法, 结合细胞转染、MTT、3H-TdR掺入法和克隆形成实验、电子显微镜等研究p27kipI对肝癌细胞株HHCC细胞增生的抑制作用及其可能的机制.
人肝癌细胞HHCC为第四军医大学病理教研室张传山博士惠赠. 插有正向p27Kip1 cDNA的pcDNA3.1/Myc-His(+)C-p27Kip1真核表达载体、pcDNA3.1/Myc-His(+)C空载体、大肠杆菌DH5a由本教研室保存. LipofectAM INE-2000转染试剂盒和G418, 为美国Gibco公司产品. 带myc标签抗体、辣根过氧化物酶标记的二抗为北京中山公司产品. 3H-TdR购于中国原子能研究院.
1.2.1 基因转染和细胞克隆筛选: 用脂质体将pcDNA3.1/Myc-His(+)C-p27Kip1转染HHCC细胞, 并设转染空载体和不转染的HHCC细胞做对照. 48 h后换用含G418(600 mg/L)的RPMI1640培养液继续培养. 约14 d左右未转染的细胞对照全部死亡, 待转染的细胞大多数死亡时, 收集G418抗性的细胞克隆, 扩大培养.
1.2.2 Western blot检测p27kip1蛋白: 配制6%的浓缩胶和12%的分离胶, 按Bio-Rad公司蛋白电泳系统的说明书进行SDS-PAGE. 电泳后再电转印于硝酸纤维素膜上, 加一抗于37 ℃孵育30 min, 缓冲液冲洗; 再加辣根过氧化物酶标记的二抗于37 ℃孵育30 min, 以化学发光法显色拍照.
1.2.3 转染细胞的克隆化: 将G418抗性的克隆消化并用培养液吹散, 准确计数后, 系列稀释至每mL含有10个细胞, 加入到96孔培养板中(100 mL/孔), 6 d后, 观察并计数单克隆细胞孔, 取单克隆孔细胞用Western blot检测p27kip1蛋白表达. 连续多次克隆化, 直至所有的单克隆孔都出现p27kip1蛋白染色阳性.
1.2.4 MTT试验: 取生长状态良好的对数生长期细胞, 常规消化、计数及测定细胞活力, 用含100 mL/L胎牛血清的RPMI1640调整细胞浓度为3×107/L, 按200 mL/孔接种于96孔板, 于 37 ℃、50 mL/L CO2孵箱中培养, 每3 d换液体1次, 分别设置组Ⅰ: 空白对照; 组Ⅱ: 转pcDNA3.1/Myc-His(+)C空载体; 组Ⅲ: 转pcDNA3.1/Myc-His(+)C-p27Kip1真核表达载体; 每组设置24个复孔, 每天检测1次, 每次3个复孔, 连续测量8 d, 每孔测量前4 h加MTT 20 mL/孔(5 g/L), 继续培养后弃去培养基, 加二甲基亚砜100 mL/孔, 微型震荡器震荡15 min, 在 490 nm波长下用酶联免疫仪测定 A490nm值.
1.2.5 3H-TdR掺入实验: 取对数生长期的肝癌细胞, 用含100 mL/L胎牛血清的RPMI1640调整细胞浓度为2.5×107/L, 按200 mL/孔接种于96孔板, 于 37 ℃、50 mL/L CO2孵箱中培养60 h,每孔加入18.5 kBq(20 mL)3H-TdR, 分别设置组Ⅰ: 空白对照; 组Ⅱ: 转pcDNA3.1/Myc-His(+)C空载体; 组Ⅲ: 转pcDNA3.1/Myc-His(+)C-p27Kip1真核表达载体; 每组设置3个复孔, 继续培养12 h吸去培养基, 胰酶消化细胞, 用ZT-Ⅲ型多孔细胞样品收集器收集细胞于999型纤维膜上, 红外线烤干加闪烁液, 于Beckman LS-6500液闪计数仪上计数.
1.2.6 软琼脂克隆形成实验: 将p27Kip1转染组、空载体转染组和未转染组细胞以每组600个细胞接种于60 mm含底层5 g/L琼脂糖和顶层3 g/L琼脂糖的软琼脂中; 37 ℃培养箱中培养14 d; 倒置显微镜下观察克隆形成情况. 计算克隆形成率.
软琼脂克隆形成率 = 克隆数/接种细胞数×100%
抑制率 = (对照组克隆数-实验组克隆数)/对照组克隆数×100%
1.2.7 电子显微镜方法检测凋亡: 常规方法将p27Kip1转染组、空载体转染组和未转染组细胞制成电镜标本, 用透射电镜观察.
统计学处理 采用第四军医大学统计学教研室开发的SPLM医用统计软件包进行方差分析.
未转染的HHCC细胞在含G-418的培养液中8 d内全部离壁死亡, 转染pcDNA3.1/Myc-His(+)C-p27Kip1组14 d时细胞绝大部分死亡, 但可见散在生长的G-418抗性细胞克隆. Western blot结果显示转染pcDNA3.1/Myc-His(+)C-p27Kip1的HHCC细胞在分子量质为27.0ku附近有1条明显的阳性带, 而转染pcDNA3.1/Myc-His(+)C空载体和未转染的HHCC细胞未见阳性条带(图1).
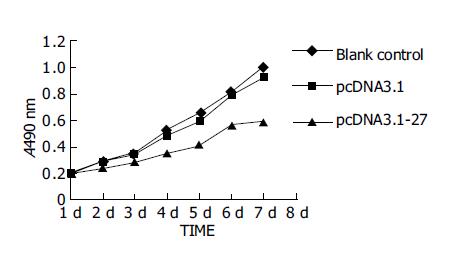
pcDNA3.1-p27明显抑制HHCC增生(P<0.01vs pcDNA3.1), 而pcDNA3.1与空白对照组(blank control)相比无差异(P>0.05)(图2).
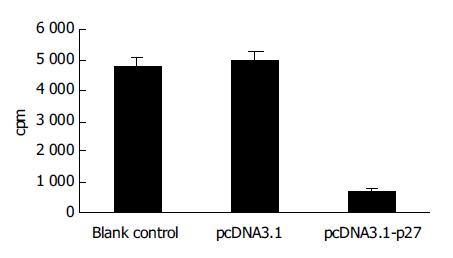
PcDNA3.1-P27对DNA合成(P<0.01vs pcDNA3.1)有明显抑制作用, Blank control与pcDNA3.1相比无差异(P>0.01)(图3).
软琼脂克隆形成试验显示,过表达的p27Kip1能够抑制HHCC细胞的生长. 各实验组与对照组之间相比有显著性差异(P<0.01, 表1).
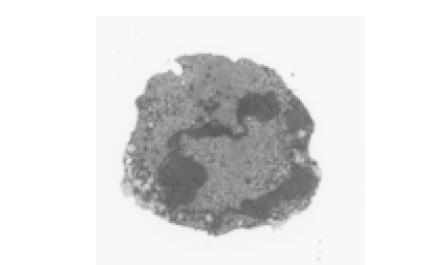
正常的肝癌细胞(HHCC)表面可见许多小的绒毛突起, 胞核为椭圆形, 位于细胞中部, 核膜双层结构清晰可见, 胞质内可见到的细胞器为线粒体、内质网和溶酶体等. 转染p27Kip1基因组的HHCC细胞可见部分肝癌细胞体积明显缩小, 胞核固缩, 染色质致密, 并边集于细胞核周边. 细胞膜表面微绒毛消失, 胞质中有空泡形成, 是细胞凋亡的形态学改变(图4).
肿瘤的恶性增生是肿瘤细胞的永生化和细胞分裂的失控, 而细胞周期调节蛋白在正常细胞的生长和肿瘤的发生发展中起着重要的调控作用. p27Kip1作为细胞周期抑制蛋白的成员之一, 对肿瘤细胞的增生有一定的影响[2]. 为研究过表达的p27Kip1对肝癌的抑制作用, 我们采用基因转染的方法建立了过表达p27Kip1的肝癌细胞模型. 经Western Blot检测表明, 最终克隆出来的转染细胞可100%表达p27Kip1蛋白, 成功地建立了过表达p27Kip1蛋白的肝癌细胞株.
细胞周期素依赖性激酶(CDKs)是细胞周期进展的主要调节因子, 因此也是肿瘤抑制性治疗的重要候选者. CDKs能够使Rb基因及其相关蛋白磷酸化, 反过来又受到细胞周期素(cyclin)的水平、磷酸化和细胞周期素依赖性激酶抑制剂(CKIs)的控制[3]. 目前已经发现两大类CKIs, 一类是INK4(CDK4的抑制剂)家族, 成员有P16, P15, P18和P19, 他们是cyclinD1与CDK4或CDK6形成的复合物的抑制剂; 另一类是P21家族, 包括P21, P27和P57, 他们是控制G1/S转换的CDK的抑制剂[4-5].
P27通过与各种cyclin-CDK复合物相互作用, 从而抑制他们的活性, 获得对细胞周期的调控. 生理状态下, P27主要是通过与cyclinE-CDK2复合物的相互作用, 从而调节细胞从G1后期到S期. 目前认为P27是TGF-β、cAMP及其他细胞外因子诱导细胞生长停滞的主要递质[7]. 在正常情况下, p27Kip1在G0/G1期时表达增高, 当细胞进入S期时则表达下降. 虽然p27Kip1能广泛抑制各种周期蛋白和周期抑制蛋白(CDK)的活性, 但主要抑制细胞周期蛋白E-CDK2和细胞周期蛋白D-CDK4等G1期激酶复合物, 使细胞不能通过G1期[6]. 细胞凋亡多数发生于细胞周期的G1期、G1晚期或S期[8-9], 因此在G1晚期表达的蛋白如p27Kip1和p21Cip1无疑会参与凋亡的进程. 我们以体外培养的人肝癌细胞系为靶细胞, 以抑癌基因p27Kip1为目的基因, 将构建的pcDNA3.1/Myc-His(+)C-p27Kip1真核表达质粒体外转染HHCC,用MTT、3H-TdR和克隆形成实验观察到抑癌基因p27Kip1对HHCC增生及其DNA合成均有明显抑制作用, 抑制率约为56%.通过电子显微镜发现过表达的p27Kip1能够诱导HHCC细胞凋亡, 即对细胞凋亡有促进作用, 从而抑制肿瘤细胞的生长. 关于p27kip1抑制肝癌细胞生长的机制还有待于进一步的探讨.
编辑: 张海宁
| 1. | Polyak K, Lee MH, Erdjument-Bromage H, Koff A, Roberts JM, Tempst P, Massague J. Cloning of p27kip1, acyclin-dependent kinase inhibitor and a potential mediator of extracellular antimitogenic signals. Cell. 1994;78:59-66. [PubMed] [DOI] |
| 2. | Favrot M, Coll JL, Louis N, Negoescu A. Cell death and cancer: Replacement of apoptotic genes and inactivation ofdeath suppressor genes in therapy. Gene Ther. 1998;5:728-739. [PubMed] [DOI] |
| 3. | Blagosklonny MV, Pardee AB. The restriction point of the cell cycle. Cell Cycle. 2002;1:103-110. [PubMed] [DOI] |
| 4. | Nath N, Wang S, Betts V, Knudsen E, Chellappan S. Apoptotic and mitogenic stimuli inactivate Rb by differentialutilization of p38 and cyclin-dependent kinases. Oncogene. 2003;22:5986-5994. [PubMed] [DOI] |
| 5. | Bryja V, Pachernik J, Faldikova L, Krejci P, Pogue R, Nevriva I, Dvorak P, Hampl A. The role of p27(Kip1) in maintainingthe levels of D-type cyclins in vivo. Biochim Biophys Acta. 2004;1691:105-116. [PubMed] |
| 6. | Shimizu T, Takahashi N, Tachibana K, Takeda K. Complex regulation of CDK2 and G1 arrest during neuronaldifferentiation of human prostatic cancer TSU-Prl cells by staurosporine. Anticancer Res. 2001;21:893-898. [PubMed] |
| 7. | Kim TY, Kim WI, Smith RE, Kay ED. Role of p27(Kip1) in cAMP- and TGF-βeta2-mediated antiproliferation in rabbitcorneal endothelial cells. Invest Ophthalmol Vis Sci. 2001;42:3142-3149. [PubMed] |
| 8. | de Koning JP, Soede-Bobok AA, Ward AC, Schelen AM, Antonissen C, van Leeuwen D, Lowenberg B, Touw IP. STAT3- mediated differentiation and survival and of myeloid cells in response to granulocyte colony-stimulating factor:role for the cyclin-dependent kinase inhibitor p27(Kip1). Oncogene. 2000;19:3290-3298. [PubMed] [DOI] |