修回日期: 2004-11-26
接受日期: 2004-11-29
在线出版日期: 2005-02-15
目的: 建立一种简便、快速、实用的乙型肝炎病毒(HBV)阿德福韦(ADV)耐药变异-rtN236T变异的快速检测方法.
方法: 根据GenBank收录的HBV基因全序设计巢式PCR引物, 使野生株(rt236N)PCR产物中含有DraI酶切位点(5'TTTAAA3'), 而变异株(rt236T)无此限制性酶切位点. 同时PCR扩增2份已行HBV RT区基因测序证实未出现rtN236T变异的慢性乙型肝炎患者血清及自行构建的对照质粒, 扩增产物经DraI酶切, 30 g/L琼脂糖凝胶电泳后, 进行限制性片段长度多态性(RFLP)分析.
结果: 所建立的ntPCR-RFLP方法灵敏度高, 可以检测到106copies/L的HBV DNA; 特异性强, 其RFLP分析结果与DNA
测序结果一致.
结论: ntPCR-RFLP方法灵敏、特异、简便、实用, 适用于ADV耐药变异的临床监测工作.
引文著录: 闫杰, 冯鑫, 王磊, 宋淑静, 谢雯, 欧蔚妮, 李蕴铷. ntPCR-RFLP检测HBV阿德福韦耐药变异-rtN236T变异. 世界华人消化杂志 2005; 13(4): 543-545
Revised: November 26, 2004
Accepted: November 29, 2004
Published online: February 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 543-545
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/543.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.543
阿德福韦酯(adefovir dipivoxil, ADV)是由美国Gilead Science公司开发的新型核苷类抗乙型肝炎病毒(hepatitis B, virus HBV)药物, 已在国外进行了II、III期临床试验[1-2], 并已获美国FDA批准上市[3]. 我国药品监督管理局于2000-12批准该药在中国进行临床试验, 目前, I期临床试验已结束, II期临床试验也已在2002-12正式启动. 临床研究表明ADV能有效地抑制HBV DNA复制, 使HBV DNA滴度迅速降低, 而且在出现拉米夫定(lamivudine)耐药的患者中ADV能继续有效地抑制变异株[1-2,4]. 但随之出现ADV耐药变异株为HBV rtN236T变异[5-6]. 为此, 我们建立了基于巢式聚合酶链反应-限制性片段长度多态技术(ntPCR-RFLP assay)的快速检测方法, 以便对该耐药变异进行监测, 指导临床合理用药.
两份慢性乙型肝炎患者血清取自北京地坛医院就诊患者, 为拉米夫定治疗前保留血清(标本号216, 393). 其HBV RT区基因序列已采用PCR产物直接测序方法进行检测, 结果表明未出现rtN236T变异(测序结果已提交至GenBank, accession number: AY762898、AY762900). 采用异硫氰酸胍一步法提取血清中的DNA. 待检血清50 mL加入含4 mol/L异硫氰酸胍的裂解液60mL, 37 ℃温育10 min; 加入酚/氯仿/异戊醇(25:24:1)50 mL, 震荡混匀后13 000 g离心10 min; 取上清, 加入等量异丙醇, -20 ℃沉淀2 h, 13 000 g离心10 min, 弃上清; 加入600 mL/L乙醇50 mL, 13 000 g离心10 min, 弃上清, 室温干燥后加入双蒸水20 mL溶解, -20 ℃保存.
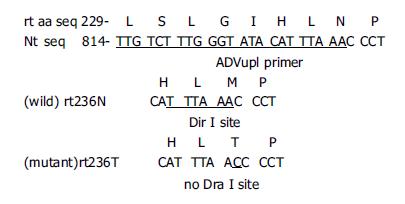
rtN236T变异是由于HBV基因组第836碱基由腺嘌呤(A)突变为胞嘧啶(C), 从而导致HBV聚合酶D区rt236氨基酸由天冬酰胺(asparagine, N)变异为苏氨酸(threonine, T)(图1). 故而以此为基础, 检索GenBank收录的HBV基因全序, 采用Primer Premier 5.0及Oligo 6.67软件辅助分析, 设计巢式PCR引物(外引物: P1、P2, 内引物: ADVup1, ADVlow); 旨在使野生株(rt236N)PCR产物中含有DraI酶切位点(5'TTTAAA3'), 而变异株(rt236T)无此限制性酶切位点(图1, 表1). 以血清提取物为模板进行PCR扩增, 野生型对照质粒以ADVup1和ADVlow为引物, 变异型以ADVup2和ADVlow为引物, 从而将碱基突变引入变异型对照质粒(表1). 将PCR产物纯化后与T-载体(美国Promega公司)连接, 构建重组质粒, 转化JM109菌. PCR鉴定阳性克隆后, LB培养液中培养并提取质粒, 应用双脱氧末端终止法进行序列测定(由北京三博远志生物技术公司完成). 巢式PCR反应 30 mL PCR反应体系含Taq酶1U, 10×扩增缓冲液3 mL, 25 mol/L dNTP 0.12 mL、50 mmol/L引物0.12 mL; 第一轮PCR模板为血清提取物6 mL, 引物为P1, P2; 第二轮PCR模板为第一轮PCR产物3 mL, 引物为ADVup1, ADVlow. 两轮PCR循环温度条件均为94 ℃ 3 min, 94 ℃ 10 s, 53 ℃ 30 s, 72 ℃ 30 s, 共30循环, 72 ℃ 7 min. 对照质粒1:50稀释后按上述步骤进行第二轮PCR. 取第二轮PCR产物8 mL, 以30 g/L琼脂糖凝胶电泳, EB染色后于紫外灯下观察结果, 于304 bp处出现荧光条带者为阳性. 限制性内切酶酶切 10 mL酶切反应体系内含第二轮PCR产物8.5mL, DraI10U, 酶切缓冲液1.5 mL, 于37 ℃酶切4 h. 将全部酶切产物以30 g/L琼脂糖凝胶电泳, EB染色后于紫外灯下观察结果. PCR产物经酶切后野生株较变异株缺失19 bp, 故电泳速度稍快, 将标本同对照质粒相比较即可判定是否变异.
| 引物 | nt | 序列 |
| P1 | 105-122 | 5'CCTCACCCATATCGTCAA3' |
| P2 | 1255-1238 | 5'CCTCACCCATATCGTCAA3' |
| ADVup1 | 815-835 | 5'TGTCTTTGGGTATACATTTAA3' |
| ADVlow | 1103-1118 | 5'AAGGCCTTGTAAGTTG3' |
| ADVup2 | 815-838 | 5'TGTCTTTGGGTATACATTTAACCC3' |
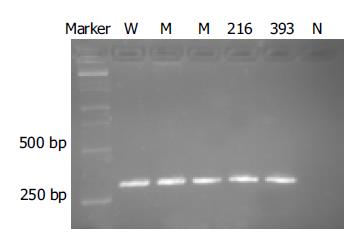
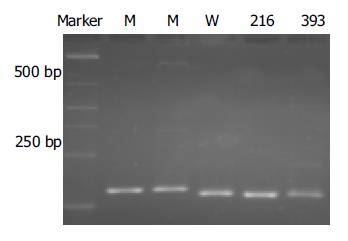
对照质粒序列测定结果与预期结果一致, 表明对照质粒构建成功(图2). 以不同HBV DNA浓度的血清提取物为模板进行PCR检测, 终检浓度为106copies/L(HBV DNA荧光定量试剂盒购自深圳匹基生物技术公司), 表明该巢式PCR反应具有良好的灵敏度. 阳性标本PCR产物大小与预期值相符, 为304 bp(图3), 且PCR产物克隆(即野生型对照质粒)测序结果与此前所测得的HBV RT区基因序列之间的核苷酸同源性为97.5%, 表明该巢式PCR反应具有高度特异性. RFLP分析DraI酶切后电泳结果显示, 两血清标本与野生型对照质粒的巢式PCR产物均被完全酶切, 而变异型对照质粒未被酶切(图4); 该结果与DNA序列测定结果一致.
时至今日慢性HBV感染仍是一个全球性的难题, 全世界约有3.5亿人感染, 与之相关的年死亡人数约为1 200 000[7]. 因此针对HBV的抗病毒治疗受到广泛重视. 随着对HBV聚合酶的结构和功能的深入认识, 一些有效抑制HBV DNA复制的核苷类药物(如: 拉米夫定、ADV)逐步成为抗HBV治疗的新选择[8-9]. 由于HBV聚合酶如同其他逆转录病毒的逆转录酶一样具有较高的错配倾向且缺乏校对能力, 因此随着感染的持续病毒准种逐年增多[10-11]. 在核苷类药物的选择压力下, 耐药变异株将逐渐增多, 最终替代野生株成为优势株, 从而导致临床耐药现象的出现. 多个研究中心相继报道rtN236T变异与ADV耐药有关, 并在体外实验中证实该变异可显著降低HBV对ADV的敏感性[5-6,12-13].
我国HBV慢性感染患者众多, 在ADV广泛应用之前应建立完善的耐药监测体系以指导临床合理用药, 为此亟待建立一种简便、快速的rtN236T变异检测方法[14].
基于ntPCR-RFLP技术的拉米夫定耐药变异检测方法已为国内众多实验室广泛应用, 具有灵敏、特异、简便、实用之优点[15-18]; 因此我们再次选择该技术用以构建rtN236T变异检测方法. 为提高PCR扩增效率, 在引物设计时选择我国常见基因型-B型和C型[19-22]为模板. 为降低成本和方便操作, 在RFLP分析过程中选用30 g/L琼脂糖凝胶电泳, 而未使用分辨率高但价格较贵、操作繁琐的聚丙烯酰胺凝胶电泳. 该方法更符合我国现状且经济、简便、实用, 以便在国内推广, 建立全国性的完善的ADV耐药监测体系.
编辑: 潘伯荣 审读:张海宁
| 1. | Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, Chang TT, Kitis G, Rizzetto M, Marcellin P, Lim SG, Goodman Z, Wulfsohn MS. Adefovir dipivoxil for the treatmentof hepatitis B e antigen-negative chronic hepatitis B. N Engl J Med. 2003;348:800-807. [PubMed] [DOI] |
| 2. | Marcellin P, Chang TT, Lim SG, Tong MJ, Sievert W, Shiffman ML, Jeffers L, Goodman Z, Wulfsohn MS, Xiong S. Adefovir dipivoxil for the treatment of hepatitis B eantigen-positive chronic hepatitis B. N Engl J Med. 2003;348:808-816. [PubMed] [DOI] |
| 4. | Schiff ER, Lai CL, Hadziyannis S, Neuhaus P, Terrault N, Colombo M, Tillmann HL, Samuel D, Zeuzem S, Lilly L. Adefovir dipivoxiltherapy for lamivudine-resistant hepatitis B in pre- and post-liver transplantation patients. Hepatology. 2003;38:1419-1427. [PubMed] |
| 5. | Angus P, Vaughan R, Xiong S, Yang H, Delaney W, Gibbs C, Brosgart C, Colledge D, Edwards R, Ayres A. Resistance to adefovir dipivoxil therapy associated with the selection of a novel mutationin the HBV polymerase. Gastroenterology. 2003;125:292-297. [PubMed] [DOI] |
| 6. | Villeneuve JP, Durantel D, Durantel S, Westland C, Xiong S, Brosgart CL, Gibbs CS, Parvaz P, Werle B, Trepo C. Selection of a hepatitis B virus strain resistant to adefovir in a liver transplantation patient. J Hepatol. 2003;39:1085-1089. [PubMed] [DOI] |
| 7. | Lok AS. Chronic hepatitis B. N Engl J Med. 2002;346:1682-1683. [PubMed] [DOI] |
| 8. | De Clercq E. Antiviral drugs in current clinical use. J Clin Virol. 2004;30:115-133. [PubMed] [DOI] |
| 9. | Humphries JC, Dixon JS. Antivirals for the treatment of chronic hepatitis B: current and future options. Intervirology. 2003;46:413-420. [PubMed] [DOI] |
| 10. | Stuyver LJ, Locarnini SA, Lok A, Richman DD, Carman WF, Dienstag JL, Schinazi RF. Nomenclature forantiviral-resistant human hepatitis B virus mutations in the polymerase region. Hepatology. 2001;33:751-757. [PubMed] [DOI] |
| 11. | Stuyver L, Van Geyt C, De Gendt S, Van Reybroeck G, Zoulim F, Leroux-Roels G, Rossau R. Line probe assayfor monitoring drug resistance in hepatitis B virus-infected patients during antiviral therapy. J Clin Microbiol. 2000;38:702-707. [PubMed] |
| 12. | Bartholomeusz A, Tehan BG, Chalmers DK. Comparisons of the HBV and HIV polymerase, and antiviral resistancemutations. Antivir Ther. 2004;9:149-160. [PubMed] |
| 13. | Yadav V, Chu CK. Molecular mechanisms of adefovir sensitivity and resistance in HBV polymerase mutants: amolecular dynamics study. Bioorg Med Chem Lett. 2004;14:4313-4317. [PubMed] [DOI] |
| 16. | 丁 静娟, 张 伟三, 张 莉莎. 乙型肝炎病毒耐拉米夫定多聚酶基因变异检测方法研究. 中华实验和临床病毒学杂志. 2004;18:24-27. |
| 17. | 赵 平, 李 捍卫, 楼 敏, 程 勇前, 兰 云, 福 军亮. 拉米夫定耐药的慢性乙肝患者联合干扰素或苦参素治 疗疗效观察. 中华实验和临床病毒学杂志. 2004;18:80-82. |
| 19. | 许 军, 王 齐欣, 范 春蕾, 蒋 栋, 李 若冰, 丛 旭, 费 然, 陈 红松, 魏 来, 王 宇. 中国南北两城市乙型肝炎病毒 基因型与血清型的构成差异. 中华实验和临床病毒学杂志. 2003;17:327-329. |
| 21. | 葛 宪民, 李 丹亚, 方 钟燎, 黄 果勇, 江 世强, 潘 海东, 杜 岩, 王 超英, 丁 欣, 沟 上雅史. 广西乙型肝炎病毒基因 分型及其临床意义的研究. 中华实验和临床病毒学杂志. 2003;17:174-179. |