修回日期: 2004-12-21
接受日期: 2005-01-05
在线出版日期: 2005-02-15
目的: 探讨睡眠剥夺(SD)对大鼠胃黏膜血流量及胃黏膜损伤的影响.
方法: 采用小站台水环境法建立大鼠SD模型, 以正常单独笼养组(CC)和大平台实验对照组(TC)作为对照组, 应用激光多普勒微循环血流计检测胃黏膜血流量, 观察胃黏膜损伤. 用放射免疫法(RIA)测定动脉血中内皮素(ET)和降钙素基因相关肽(CGRP)的水平.
结果: 在SD3 d、5 d、7 d大鼠胃黏膜血流量与CC组、TC组和SD1d组比较明显下降, 血流量分别为(54.2±2.5)、(53.7±3.0)、(48.3±2.5)mv; 大鼠胃黏膜损伤与CC组、TC组和SD 1 d组比较明显加重, 溃疡指数分别为(29.8±3.2)、(33.7±3.6)、(34.8±3.5). 同时SD3 d、5 d、7 d大鼠血浆中ET和CGRP 的水平发生明显改变, 血浆中ET含量分别为(123±28)ng/L、(139±36)ng/L、(149±38)ng/L; SD 5 d、7 d , CGRP含量分别为(193±32)ng/L、(221±40)ng/L.
结论: SD可导致胃黏膜血流量下降及胃黏膜损伤并且伴随着血浆ET和CGRP含量的变化.
引文著录: 易军, 宫卫东, 王岭, 凌瑞, 马中. 睡眠剥夺对胃黏膜血流量及胃黏膜损伤的影响. 世界华人消化杂志 2005; 13(4): 499-503
Revised: December 21, 2004
Accepted: January 5, 2005
Published online: February 15, 2005
AIM: To observe the changes of gastric mucosal blood flow and gastric mucosal lesions in rats after sleep deprivation.
METHODS: Sleep deprivation was induced in male Sprague-Dawley rats housed on small platform over water. Control mice were housed either in normal cages or on large platform over water. Laser Doppler blood flow meter was used to measure the gastric mucosal blood flow, and index of gastric mucosal lesions was quantified. The arterial plasma levels of endotoxin (ET) and calcitonin gene related peptide (CGRP) were measured by radioimmunoassay.
RESULTS: Compared with control mice in normal cage, on big platform, or the mice on the 1st day of sleep deprivation, the gastric mucosal blood flow of mice on the 3rd, 5th and 7th day of sleep deprivation (54.2±2.5, 53.7±3.0, 48.3±2.5 mv, respectively) were significantly lower. The gastric mucosal injury became more and more serious: the injury indices were 29.8±3.2, 3.7±3.6 and 34.8±3.5 on the 3rd, 5th and 7th day of sleep deprivation, respectively. The serum levels of ET were 123±28, 139±36 and 149±38 ng/L in mice on the 3rd, 5th and 7th day of sleep deprivation, and the levels of CGRP were 193±32 and 221±40 ng/L in the mice on the 5th and 7th day of sleep deprivation. All were significantly higher than those in control mice.
CONCLUSION: Sleep deprivation can cause the decrease of gastric mucosal blood flow and the gastric mucosal injury, which are accompanied by the elevation of serum ET and CGRP.
- Citation: Yi J, Gong WD, Wang L, Ling R, Ma Z. Effects of sleep deprivation on gastric mucosal blood flow and gastric mucosal lesions in rats. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 499-503
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/499.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.499
睡眠剥夺(Sleep Deprivation, SD)作为一种强烈的应激源, 对机体可产生生理和心理应激反应, 以致造成多方面负面影响[1-2]. 睡眠不仅具有维持个体生存的功能, 还有促进生长发育、易化学习、形成记忆的功能. SD是指由于各种原因引起的睡眠丢失状态, 并引起情绪、学习记忆、免疫功能等一系列改变. 在生活节奏日益加快的今天, 睡眠剥夺发生率明显升高. 近20年来, 在国外是心理学家, 生理学家以及特殊职业研究者和军事机构的研究热点; 国内目前也注意到其重要性, 在有关其中枢作用机制的研究有报道. 在现代社会生活中, 人们面临着紧张的工作环境. 睡眠障碍越来越多地受到学者们的关注, 目前有关应激(生理性应激、心理性应激)对消化系统功能的影响研究较多, 但从事以SD作为应激源对消化系统功能的影响研究不多, 尤其是对胃黏膜血流量、胃黏膜损伤及内皮素和降钙素基因相关肽水平的影响研究甚少[3-4]. 我们通过本实验探讨SD对消化道的作用, 为治疗和预防SD对消化功能产生的影响提供理论依据.
成年, 雄性, 健康上海产Sprague-Dawley 大鼠48只(第四军医大学实验动物中心提供), 体质量(200±20)g. 将大鼠随机分为6组, 每组8只: 正常单独笼养组(normal cage control, CC); SD 1 d组; SD 3 d组; SD 5 d组; SD 7 d组; 大平台实验对照组(tank control, TC). 采用小站台水环境法[6](flower pot technique)建立大鼠SD模型. SD实验箱为30 cm30 cm40 cm 玻璃水箱, 正中立一直径6.3 cm, 高8.0 cm的平台. 平台周边注满水, 水温保持在20 ℃ 左右, 水距平台1.0 cm. 大鼠在平台上可自由饮食饮水, 若其睡眠, 会因肌张力松弛而落入水中警醒. 为排除隔离和水环境造成的影响, 设立大平台实验对照组, 其平台直径为18.0 cm, 大鼠在平台上有一定活动空间, 可以睡眠, 其他环境与实验组相同. SD期间持续40W日光灯照射, 每天更换箱中的水. 对照组单独笼养, 自然昼夜光照, 饲养条件同SD组. 实验前, 让大鼠熟悉适应环境1 wk.
1.2.1 胃黏膜血流量检测: 应用激光多普勒微循环血流计(LDF-3)测定. 剑突下正中切开腹壁, 充分暴露胃后, 切开胃体前壁约0.5 cm, 将血流仪探头插入切口内, 接触胃后壁黏膜, 待血流稳定后开始测量, 每个部位测2次, 每次测1 min, 计算2次的平均值.
1.2.2 胃黏膜损伤检测: 解剖大鼠, 将胃从腹腔中取出, 沿大弯侧剪开、展平, 按照Guth标准[7]进行, 观察记录胃黏膜上点、线条状出血灶的长度并将其打分. 病灶长度<1 mm记1分, 长度1-2 mm记2分, 2-3 mm记3分, 3-4 mm记4分, 若病灶长度>4 mm则分段计分, 病灶宽于2 mm时分数乘以2, 最后将全胃各病灶分数相加的总和作为动物损伤的溃疡指数(ulcer index, UI).
1.2.3 ET和CGRP的检测: SD1, 3, 5 d组分别于睡眠剥夺1, 3, 5 d, CC组、TC组和SD 7 d组于睡眠剥夺7 d取尾血4 mL加入100 g/L乙二胺四乙酸钠30 mL和40 000 kU/kg抑肽酶的试管中, 混匀, 于4 ℃ 3 000 r/min离心10 min, 分离血浆, -20 ℃下保存待测定. 采用放射免疫法测定血浆中ET和CGRP含量. ET及CGRP试剂由解放军总医院东亚免疫技术研究所提供, 操作程序严格按照说明书进行.
统计学处理 采用SPSS10.0统计软件处理分析. 数据均以mean±SD表示, 采用完全随机设计方差分析, LSD法进行多组间两两均数比较.
SD1d组胃黏膜血流量与CC组和TC组相比未见明显差异(P>0.05); SD 3 d组、SD 5 d组、7 d组与CC组 、TC组及SD 1 d组相比显著降低(P<0.05, P<0.01, 表1).
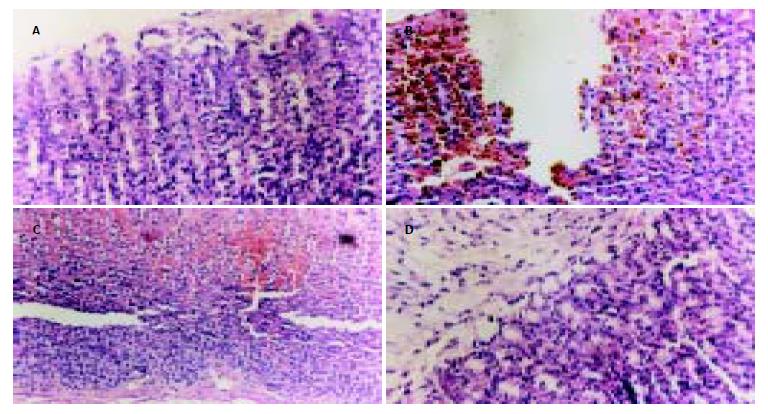
SD1d组胃黏膜溃疡指数与CC组和TC组相比未见明显差异(P>0.05); SD 3 d组、SD 5 d组、7 d组与CC组、TC组及SD 1 d组相比显著升高(P<0.01, 表1). 正常单独笼养组光镜下观察胃: 黏膜连续性完整, 组织结构正常, 细胞排列紧密(图1A).SD 3 d组: 黏膜连续性中断、糜烂, 黏膜可见炎细胞浸润, 伴有红细胞渗出, 组织变性坏死轻微(图1B).SD 5 d组: 黏膜连续性中断, 有溃疡形成, 黏膜层可见炎细胞浸润明显, 伴广泛的红细胞渗出及坏死组织(图1C). 大平台实验对照组: 黏膜连续性完整, 未见组织变性和坏死(图1D).
睡眠剥夺是心理生理应激的一种[2]. 现代化战争昼夜连续作战, 缺少睡眠或睡眠被剥夺引起精神疲劳是经常发生的[5]. 目前对睡眠剥夺导致胃黏膜血流量、胃黏膜损伤及ET和CGRP水平改变的研究报道尚少. ET是目前所知的血管内皮细胞最强大的血管活性肽, 具有强烈的收缩血管作用. 全身多种组织器官都有ET的合成分泌[8-9]. 生理条件下, 他在调节血管张力和局部组织微循环灌注中起着非常重要的作用[10-13]. 而在许多病理情况下, 多种病理应激因素[14-16]可刺激机体大量合成释放ET[17-19], 参与机体的多种病理生理过程[20-21]. 降钙素基因相关肽与内皮素相反, 是体内最强的扩血管物质, 广泛分布于神经和心血管系统[22]. 已有较多研究证明, 内皮素和降钙素基因相关肽在心脑血管疾病、肾脏疾病、糖尿病等疾病中有重要意义, 有关ET和CGRP参与胃黏膜损伤亦有报道[23], 其中ET有强烈的缩血管和致溃疡作用, 而CGRP则有增加胃黏膜血流和细胞保护作用.
从本实验观察结果来看, 睡眠剥夺使胃黏膜血流量减少, 胃黏膜产生损伤, 而且随着所处应激环境时间的延长, 胃黏膜损伤程度也不断增强, 与应激引起胃黏膜损伤的文献[8]报道一致. 近年有研究提示ET与应激性溃疡关系密切, 尤其是出血性损害之间的关系更为密切[24-25], 可能在应激性胃黏膜损伤中起着重要的致病作用[26-29]. 在SD实验中, ET在SD 3 d, SD 5 d和SD 7 d明显升高, 且与胃黏膜血流量下降、胃黏膜损伤指数一致, ET水平增高使胃黏膜组织血液灌注减少, 提示显著降低GMBF可能是ET诱发应激性胃黏膜损伤的重要机制之一[30-31]. 有报道, 应激反应刺激机体外周血管产生ET增加, 局部ET升高可使血管产生强烈而持久的收缩, 从而加重组织缺血性损伤, 形成恶性循环[32]. 另有研究表明ET还可通过收缩血管导致引起组织缺血、缺氧、抑制K+-ATP通道, 促进体内脂质过氧化反应[33-35], 引起氧自由基及MDA大量产生[36-38], 二者对组织细胞有较强的攻击损伤作用[39-42]. 本实验还显示大鼠血浆中CGRP水平是在SD 5 d和SD 7 d增加, 比ET明显升高晚, 表明CGRP是一种代偿性. 有作者报道CGRP在损伤后的明显上升, 他具有拮抗ET的缩血管作用, 但二者在调节黏膜微循环中的作用并不是简单的相反血管活性特征[21,37].
应激源的不断作用势必对某些脏器的功能产生影响, 导致一些临床症状的发生[8]. 从本实验的另一方面我们还可以看到, 睡眠剥夺应激使胃黏膜血流量明显减少, 且胃黏膜血流量减少是胃黏膜损伤的重要机制之一[38,43-45]. 从我们统计的溃疡指数中可以看出, 随着应激时间的延长, 胃黏膜溃疡指数不断增加, 说明胃黏膜损伤的程度不断加大, 由此提示应激对象作用的时间越长, 对应激对象的损伤作用就会更加明显, 因此看来, 应激源对应激对象作用不但对其功能产生影响, 而且器质性病变也再所难免[8,46].
睡眠障碍因素的不断作用就会导致某些疾病的发生, 所以, 研究睡眠剥夺对消化道功能的影响, 对消除某些睡眠剥夺的因素, 减少某些疾病的发生机会, 或者对消化系统某些疾病的预防和治疗将起到重要作用. 因此, 随着社会竞争程度的不断加强, 睡眠对人体健康和生活质量的影响应当受到人们的足够重视.
编辑: 潘伯荣 审读:张海宁
| 1. | Papakonstantinou E, Ryan DH, Harris RB. Dietary fish oil does not protect rats exposed to restraint or sleepdeprivation stress. Physiol Behav. 2003;78:759-765. [PubMed] [DOI] |
| 2. | Edell-Gustafsson UM, Gustavsson G, Yngman Uhlin P. Effects of sleep loss in men and women with insufficientsleep suffering from chronic disease: a model for supportive nursing care. Int J Nurs Pract. 2003;9:49-59. [PubMed] [DOI] |
| 3. | Landrigan CP, Rothschild JM, Cronin JW, Kaushal R, Burdick E, Katz JT, Lilly CM, Stone PH, Lockley SW, Bates DW. Effect of reducing interns'work hours on serious medical errors in intensive care units. N Engl J Med. 2004;351:1838-1848. [PubMed] [DOI] |
| 4. | Nie SN, Qian XM, Wu XH, Yang SY, Tang WJ, Xu BH, Huang F, Lin X, Sun DY, Sun HC. Role of TFF in healingof stress-induced gastric lesions. World J Gastroenterol. 2003;9:1772-1776. [PubMed] [DOI] |
| 5. | Lieberman HR, Tharion WJ, Shukitt-Hale B, Speckman KL, Tulley R. Effects of caffeine, sleep loss, and stress oncognitive performance and mood during U. S. Navy SEAL training. Sea-Air-Land. Psychopharmacology (Berl). 2002;164:250-261. [PubMed] [DOI] |
| 8. | Matsumoto T, Yoshiyama S, Kobayashi T, Kamata K. Mechanisms underlying enhanced contractile response toendothelin-1 in diabetic rat basilar artery. Peptides. 2004;25:1985-1994. [PubMed] [DOI] |
| 9. | Paxian M, Keller S, Baveja R, Korneszczuk K, Huynh T, Clemens M. Functional Link Between ETB Receptors andeNOS Maintain Tissue Oxygenation in the Normal Liver. Microcirculation. 2004;11:437-451. [PubMed] [DOI] |
| 10. | Wang T, Luo F, Shan R, Zhen Y, Zhao J, Zhang S. Changes of endothelin and calcitonin gene-related peptideduring desflurane anesthesia in patients undergoing intracranial aneurysm clipping. J Neurosurg Anesthesiol. 2004;16:236-239. [PubMed] [DOI] |
| 11. | Okada Y, Ichikawa M, Ishii K, Hara H. Effects of topically instilled bunazosin hydrochloride and other ocular hypotensivedrugs on endothelin-1-induced constriction in rabbit retinal arteries. Jpn J Ophthalmol. 2004;48:465-469. [PubMed] [DOI] |
| 12. | Hikoso S, Yamaguchi O, Higuchi Y, Hirotani S, Takeda T, Kashiwase K, Watanabe T, Taniike M, Tsujimoto I, Asahi M. Pressure overload induces cardiac dysfunctionand dilation in signal transducer and activator of transcription 6-deficient mice. Circulation. 2004;110:2631-2637. [PubMed] [DOI] |
| 14. | Caballero-George C, Vanderheyden PM, Okamoto Y, Masaki T, Mbwambo Z, Apers S, Gupta MP, Pieters L, Vauquelin G, Vlietinck A. Evaluation of bioactive saponins and triterpenoidal aglycons for their binding propertieson human endothelin ET(A)and angiotensin AT(1)receptors. Phytother Res. 2004;18:729-736. [PubMed] [DOI] |
| 15. | Turner NA, O抮egan DJ, Ball SG, Porter KE. Endothelin-1 is an essential co-factor for beta2-adrenergicreceptor-induced proliferation of human cardiac fibroblasts. FEBS Lett. 2004;576:156-160. [PubMed] [DOI] |
| 16. | Li L, Roumeliotis N, Sawamura T, Renier G. C-Reactive protein enhances LOX-1 expression in human aortic endothelialcells: Relevance of LOX-1 to C-reactive protein-induced endothelial dysfunction. Circ Res. 2004;95:877-883. [PubMed] [DOI] |
| 17. | Liu CC, Chen ZC, Cheng BC, Lin MT. Prior Antagonism of endothelin-1A receptors alleviates circulatory shock andcerebral ischemia during rat heatstroke. A J Pharmacol Sci. 2004;96:177-187. [PubMed] [DOI] |
| 20. | Goto K. Prospect of endothelin-related drugs. Nippon Rinsho. 2004;62:673-681. [PubMed] |
| 24. | Wang Y, Wang DH. Prevention of endothelin-1-induced increases in blood pressure: role of endogenous CGRP. Am J Physiol Heart Circ Physiol. 2004;287:H1868-1874. [PubMed] [DOI] |
| 25. | 刘 晓岩, 王 银叶, 陈 世忠, 李 长龄. 实验性心肌缺血时内源性 ET, CGRP 和 NO 水平的变化及心舒平的调节作用. 中国中药杂志. 2002;27:534-537. [PubMed] |
| 28. | Akimoto M, Hashimoto H, Maeda A, Shigemoto M, Yamashita K. Roles of angiogenic factors and endothelin-1 ingastric ulcer healing. Clin Sci (Lond). 2002;450S-454S. [PubMed] [DOI] |
| 30. | Kozakai T, Zhao H, Sakate M, Masuo Y, Uchide T, Saida K. Effect of aging on gene expression rates of endothelin-1and endothelin-2/vasoactive intestinal contractor in ethanol-induced gastric mucosal injury of the mouse. Clin Sci (Lond). 2002;103:455S-458S. [PubMed] [DOI] |
| 31. | Zhuikova SE, Samonina GE. Homeostasis of the gastric mucosa and blood circulation. 2. Role of ischemia in disruptionof the gastric mucosa. Usp Fiziol Nauk. 2002;33:77-87. [PubMed] |
| 32. | Lazaratos S, Irukayama-Tomobe Y, Miyauchi T, Goto K, Nakahara A. Oxygen radicals mediate the final exacerbationof endothelin-1-induced gastric ulcer in rat. Eur J Pharmacol. 2001;413:121-129. [PubMed] [DOI] |
| 33. | Maity P, Biswas K, Roy S, Banerjee RK, Bandyopadhyay U. Smoking and the pathogenesis of gastroduodenalulcer-recent mechanistic update. Mol Cell Biochem. 2003;253:329-338. [PubMed] [DOI] |
| 34. | Slomiany BL, Slomiany A. Role of ERK and p38 mitogen-activated protein kinase cascades in gastric mucosalinflammatory responses to Helicobacter pylori lipopolysaccharide. IUBMB Life. 2001;51:315-320. [PubMed] [DOI] |
| 36. | Matsumoto T, Yoshiyama S, Kobayashi T, Kamata K. Mechanisms underlying enhanced contractile response toendothelin-1 in diabetic rat basilar artery. Peptides. 2004;25:1985-1994. [PubMed] [DOI] |
| 37. | Wang XZ, Zhang LJ, Li D, Huang YH, Chen ZX, Li B. Effects of transmitters and interleukin-10 on rat hepatic fibrosisinduced by CCl4. World J Gastroenterol. 2003;9:539-543. [PubMed] [DOI] |
| 38. | Benigni A, Perico N, Remuzzi G. The potential of endothelin antagonism as a therapeutic approach. Expert Opin Investig Drugs. 2004;13:1419-1435. [PubMed] [DOI] |
| 39. | Yokoyama Y, Toth B, Kitchens WC, Schwacha MG, Rue LW. Estradiol's effect on portal response to endothelin-1after trauma-hemorrhage. J Surg Res. 2004;121:25-30. [PubMed] [DOI] |
| 40. | Yokoyama Y, Toth B, Kitchens WC, Schwacha MG, Bland KI, Chaudry IH. Role of thromboxane in producing portalhypertension following trauma-hemorrhage. Am J Physiol Gastrointest Liver Physiol. 2003;285:G1293-1299. [PubMed] [DOI] |
| 41. | Uhlmann D, Armann B, Gaebel G, Ludwig S, Hess J, Pietsch UC, Escher E, Fiedler M, Tannapfel A, Hauss J. Endothelin A receptor blockade reduces hepatic ischemia/reperfusion injury after warm ischemia ina pig model. J Gastrointest Surg. 2003;7:331-339. [PubMed] [DOI] |
| 44. | Yoshida M, Wakabayashi G, Ishikawa H, Kawachi S, Tanabe M, Otani Y, Shimazu M, Kubota T, Kitajima M. Arteriovenous shunting blood flow is intravitally observed in the stomach after thermal injury in rats. Keio J Med. 2002;51:193-200. [PubMed] [DOI] |
| 45. | Holzer P, Painsipp E. Differential effects of clonidine, dopamine, dobutamine, and dopexamine on basal andacid-stimulated mucosal blood flow in the rat stomach. Crit Care Med. 2001;29:335-343. [PubMed] [DOI] |