修回日期: 2004-11-21
接受日期: 2004-12-09
在线出版日期: 2005-02-15
目的: 研究缺氧缺血损伤对肠上皮细胞(IEC)整合素极性及分布的改变的凋亡机制.
方法: 建立缺血缺氧与IEC凋亡的实验模型, 实验分组: 对照组(A组), 缺氧组(B组), 缺血组(C组), 缺氧缺血组(D组); 采用流式细胞仪(FCM)检测IEC凋亡率, 激光共聚焦显微镜(LSCM)检测IEC自基底侧至顶侧5个平面的整合素a3, a5, b1, b2, b5染色荧光强度并定量.
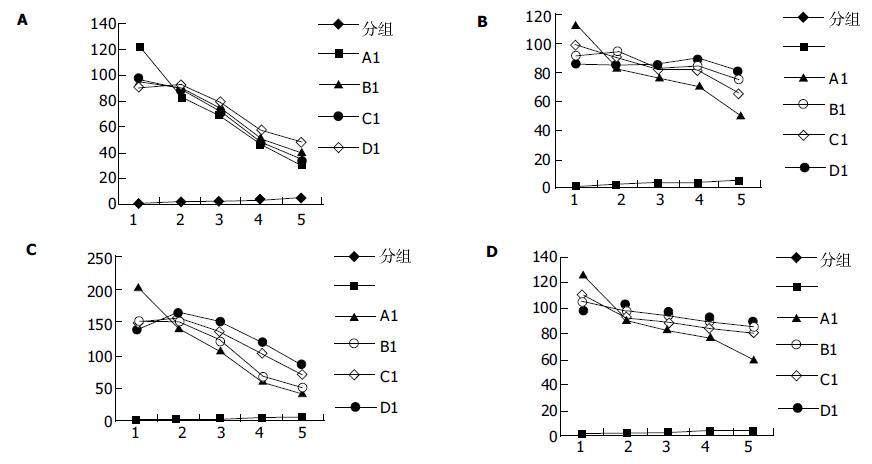
结果: A组细胞整合素a3, a5, b1, b5荧光标记主要分布于细胞基底侧, 损伤后B、C、D组呈上移趋势, 其分布和极性与细胞凋亡率相一致; 整合素a3在C组的中间和顶层没有阳性表达. b2分布较弥散, 无明显变化规律.
结论: 缺氧缺血损伤对IEC整合素分布改变呈规律性变化, 与IEC凋亡密切相关; 对缺氧反应更敏感.
引文著录: 陈前, 秦环龙. 缺血缺氧损伤对肠上皮细胞整合素极性及细胞凋亡的影响. 世界华人消化杂志 2005; 13(4): 456-459
Revised: November 21, 2004
Accepted: December 9, 2004
Published online: February 15, 2005
AIM: To study the influence of ischemia and anoxia injury on the distribution and polarity of integrin in intestine epithelial cells (IEC).
METHODS: IEC ischemia and anoxia injury model was established. The cells were divided into four groups, namely, group A (control group), group B (anoxia group), group C (ischemia group), and group D (ischemia and anoxia group). Cell apoptosis and the polarity and distribution of integrins a3, a5, b1, b2, b5 were determined by flow cytometry (FCM) and laser scanning confocal microscope (LSCM), respectively.
RESULTS: Integrins a3, a5, b1, b5 were expressed exclusively on the basal and lateral surfaces of IECs in group A. After ischemia and anoxia injury, integrins a3, a5, b1, b5 distribution moved from the basolateral to the apical membrane. Cell apoptosis was increased in group B, C and D. Integrin a3 was not observed in the middle and apical membrane in group C. Integrin b2 distribution was not markedly changed in any group.
CONCLUSION: The change in the distribution of integrin is induced by ischemia and anoxia, which is correlated with IEC apoptosis. IEC apoptosis is more sensitive to the anoxia.
- Citation: Chen Q, Qin HL. Influence of ischemia and anoxia on distribution and polarity of integrin in intestine epithelial cells. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 456-459
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/456.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.456
肠上皮细胞是锚着依赖性细胞, 他的存活依靠整合素黏附固定于基质蛋白, 需要整合素与其配体的结合[1]. 如果整合素发生改变, IEC将从其黏附的基质处脱落凋亡, 肠道结构的完整性将遭到破坏. 目前有关IEC从基底膜上脱落的机制尚不完全清楚, IEC损伤时整合素受体分布、极性及含量是否改变, 知之甚少. 我们通过IEC体外原代培养, 观察在缺血缺氧条件下IEC整合素受体的改变, 以探求肠上皮脱落凋亡的机制.
孕14-18 d的SD大鼠20只, 由上海实验动物中心提供, 清洁级, 质量300-390 g.DMEM培养液, 胰蛋白酶(美国GIBCO公司); 胎牛血清FCS(Hyclone公司); EGF(SIGMA公司); 胶原酶Ⅺ型(GIBCO公司); dispase酶(德国, 宝灵曼公司); 抗体: 羊抗大鼠integrin(a3, a5, b1, b2, b5)mAb一抗(DIACLONE公司); FITC标记的兔抗羊的Ig二抗(CALTAG 公司); 凋亡试剂: Aanxin-V/PI试剂盒(Sigma公司); 人工基底膜: matrigel人工基底膜液(2 mL, 晶美生物有限公司); 消化酶A液: 1.25 g/L胰蛋白酶、300 mg/L胶原酶Ⅺ型、600 mg/L dispase酶即配即用. 缓冲液B液: 50 mL/L胎牛血清、20 g/L山梨醇, 调pH值至7.4, 分装, 4 ℃保存. 培养液C液: 100 mL/LFCS、
20 mg/LEGF、1 mmol/L GLN、2.5 mg/L胰岛素、1 mmol/L丙酮酸钠、100 mg/L肝素、100 mg/L青霉素、50 mg/L链霉素、甲状腺素、地塞米松加入各药品, 调pH值至7.2, 分装, 4 ℃保存.
1.2.1 胎鼠IEC的分离培养: SD孕鼠, 剖宫取胎鼠及小肠, 纵行剪开肠管, 剪成1 mm小块, 加入酶液A50 mL, 室温下消化20 min; 吸取上层液离心, 最后将沉淀悬浮于培养液C中, 种植在已涂膜的培养瓶中, 在37 ℃, 50 mL/L CO2孵箱内培养; 2 d后首次换液, 弃去含有非贴壁细胞的上清液, 贴壁细胞用PBS彻底冲洗. 每3 d换以新鲜培养液. 将细胞接种在布膜的坡璃细胞培养瓶中, 待其贴壁后再进行实验; 弃去培养液后, 用Hanks液洗细胞3次, 用-20 ℃的冷丙酮固定; 放入酶反应基质液, 孵育30 min; 加入碱性磷酸酶(AKP)试剂, 孵育45 min; 弃去AKP和酶反应基质液, 三蒸水洗3次; 苏木精孵育30 min后弃去, 三蒸水洗3次; 甘油逢片后, 倒置光显微镜观察, 红色反应表示阳性.
1.2.2 人工基底膜的建立: 取培养瓶, 于实验前滴加matrigel人工基底膜液100 mL后, 置于培养箱中, 培养皿晾干后备用. (1)模拟缺氧: 标本放入特制的密封仓系统(三菱瓦司化学株式会社), 配有与其体积相应量的厌氧气体产生剂及指示剂, 封闭密封仓, 厌氧气体产生剂在20 min内即可置换密封仓内氧气并释放出相同体积的二氧化碳; 厌氧气体指示剂颜色由粉红变成白色即证实缺氧达到要求(O2浓度<1 mL/L); (2)模拟缺血: 把正常的培养液换成同体积的无糖含钙的缓冲液PBS液(配方: 117 mmol/L氯化钠、5.3 mmol/L氯化钾、1.8 mmol/L氯化钙、0.8 mmol/L硫酸镁、26 mmol/L碳酸氢钠、1 mmol/L磷酸二氢钠、0.1 mmol/L酚红), 置于培养箱中; (3)模拟缺血缺氧: 同时达到(1)和(2)的要求.
1.2.3 实验分组及检测指标: 所有实验组在IEC培养7 d采样, 分组: A组, 对照组; B组, 缺氧组; C组, 缺血组; D组, 缺氧缺血组. 上述实验分组在各种病理环境作用2 h后, 进行下列指标的检测. (1)细胞凋亡的检测: 胰酶消化成单个细胞, 悬在AanxinV200 uL中及 PI200 μL避光冰孵孵育; 荧光显微镜下观察后, FCM(Beckman公司)检测, 488 nm激发, 515 nm测定. (2)整合素分布的改变: 细胞爬片致40%, 各组按实验设计要求作用2 h; 加40 g/L的多聚甲醛, 常温下固定30 min; 弃去多聚甲醛, 以PBS冲洗3次; 0.5 mL的1:100的山羊抗大鼠的整合素mAb一抗37 ℃孵育1 h; 以 FITT标记的羊抗兔二抗(1:100)0.5 mL常温避光孵育1 h; PBS冲洗3次, 甘油封片后, 于激光共聚焦显微镜(伯乐Radiance 2 100, 中科院细胞所提供)下观察; 逐格上移聚焦层面, 测量细胞由基底侧至顶侧染色荧光强度的变化, 随机选取10个视野进行统计分析.
统计学处理 利用SPSS10.0 forWindows版统计软件进行统计分析, 各组数据采用均数±标准差(mean±SD)表示, 对各组数据进行χ2检验、t检验. P<0.05认为有统计学意义.
正常细胞自然凋亡率为35.0±7.2%, 但经缺血缺氧处理后IEC凋亡明显增加, 其中最明显的是D组(78.5±10.7%), 比A组高出43.0%(P<0.01), B组(67.0±13.1%)、C组(46.8±6.3%)均比A组为高(P<0.01, P<0.05); D, B组和C组相比也有明显的差异(P<0.01).
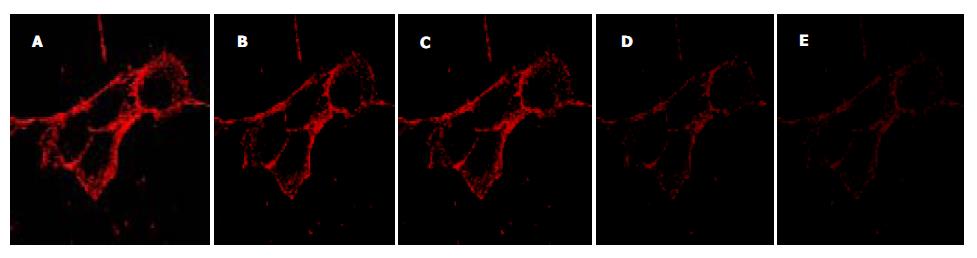
各组IEC整合素a3, a5, b1, b5荧光标记阳性, 且位于细胞膜; A组荧光分布呈明显的极性, 基底层和近基底层的侧层分布强, 顶层和近顶层的侧层分布弱; B, C, D组整合素的分布有向顶侧弥漫的倾向, 基底层减少, 顶层有增加趋势. B, C, D第1层的整合素分布均显著低于A组(P<0.01), B、D的第4, 5层的整合素分布均显著高于A组(P<0.05)(列出整合素分布趋势曲线图1及典型图2). 各组IEC整合素b2荧光标记较弱, 在细胞膜上的分布较弥散, 极性分布不明显, 无明显规律性改变(表1).
| 分组 | 底层(1) | 中间(2-4) | 顶层(5) |
| B | a3, a5, b1, b5 | a5, b1, b5 | a3, a5, b1, b5 |
| C | a3, a5, b1, b5 | 无 | a5, b1, b5 |
| D | a3, a5, b1, b5 | a3, a5, b1, b5 | a3, a5, b1, b5 |
整合素是由a和b亚单位组成的异二聚体跨膜糖蛋白, 整合素因其a和b亚单位的不同组合而出现不同的亚型, a亚基质量在120-180 ku之间, b亚基质量90-110 ku之间. 整合素主要功能是通过与相应的配体结合介导细胞与基质的黏附、信号传导、个体发育、分化、凋亡等病理生理过程. 同大多数体细胞一样, 在 IEC表面也分布着多种整合素受体. 与IEC表面有关的整合素有a2、a3、a5、b1、b4、b5[2]. 不同整合素在 IEC的分布亦有不同, 如a2b1分布于隐窝处, a3b1分布于绒毛底部, a5b1位于隐窝及绒毛的底部, a7b1则局限隐窝顶部及绒毛底部, 而a6b4则均一地分布于整个IEC表面[3-4]. 近年来随着研究的深入, 人们发现整合素还与IEC的凋亡密切相关[5], 整合素可能是IEC黏附于基底膜以维持细胞生存的主要方式, 而且已引起了学者们的关注. 有研究发现IEC经整合素a4封闭后, 其分化、增生、Bcl-2、Bcl-X、Bax、Bak家族基因表达均明显受抑制[6]. 如犬经iv整合素a, b单抗1.0 mg/kg持续2 wk, 可诱导出现消化道出血[2]. 还有学者发现, 整合素调控着肠上皮的凋亡, a5b1似有抗凋亡作用[7]. 最近Levy et al[8]的一项研究发现丁酸(NaBT)可以使Caco-2细胞表面整合素b1的表达下降, 导致细胞从基底膜脱落并发生凋亡.
有关整合素在细胞膜上的表达检测, 国内外较为常用的办法是采用免疫组化、免疫荧光等技术, 此二者不能较为精确地反应表达量, 更无法检测极性分布改变、空间结构变化. 近年来已有采用激光共聚焦显微镜(LSCM)研究整合素的报道. Gailit et al[9]利用LSCM观察体外培养的肾小管上皮细胞整合素a3呈极性分布, 基底层和近基底层的侧层分布强, 顶层和近顶层的侧层分布弱; 在接受亚致死剂量的氧损伤后, 细胞整合素a3的极性分布丧失, 由基底层和近基底层向顶层和近顶层的侧层弥散; 并且导致黏附于基质的细胞数量减少. Wu et al[6]在体研究发现, 肾小管上皮细胞正常情况下整合素b1呈极性分布, 缺血再灌注损伤后, 也向顶侧弥散; Beck et al[2]发现, 在体的缺血再灌注损伤模型未发现整合素a3的顶层的侧层分布. 以上实验结果提示, 缺氧、氧损伤后整合素的极性分布丧失, 是导致上皮细胞黏附性改变的基础; 同时, 也说明了LSCM能够很好地观察整合素的三维结构改变.
我们研究发现, IEC在实验因素刺激下整合素a3, a5, b1, b5发生了极性和分布的改变, 并与细胞凋亡、脱落密切相关. 其具体表现在, A组a3, a5, b1, b5整合素在细胞膜上呈极性分布, 主要位于近基底膜侧; 缺血缺氧后B, C, D组有向顶侧弥散的趋势, 各层面的定量均存在差异, 尤以第1层和第5层改变最为明显(P<0.01, P<0.05); 整合素极性分布的明显改变趋势由大到小依次是缺血缺氧组、缺氧组、缺血组, 且此三组之间也有差异(P<0.01, P<0.05); 无论缺血缺氧还是单纯缺血或缺氧损伤与A组相比较, a3, a5, b1, b5在底层表达均明显下降, 中间层和顶层均增加表达, 说明有整体从基底向顶层移动的现象. 缺血组a3在中间层及顶层没有出现阳性表达, 说明其对缺血损伤可能不敏感. 缺氧组、缺血缺氧组顶层各整合素亚型都发生变化, 并都参与了细胞损伤作用, 说明IEC对缺氧尤为敏感. b2整合素在细胞膜上的分布较均匀, 缺血缺氧后改变不明显; 这可能与整合素b2功能有关, 或其本身没有直接参与细胞脱落、凋亡, 只是其他某些亚型在IEC凋亡中起着重要调节作用.
编辑: 潘伯荣 审读:张海宁
| 1. | Stupack DG, Cheresh DA. Get a ligand, get a life: integrins, signaling and cell survival. J Cell Sci. 2002;115:3729-3738. [PubMed] [DOI] |
| 2. | Beck R, Nebe B, Guthoff R, Rychly J. Inhibition of lens epithelial cell adhesion by the calcium antagonist Mibefradil correlates with impaired integrin distribution and organization of the cytoskeleton. Graefes Arch Clin Exp Ophthalmol. 2001;239:452-458. [PubMed] [DOI] |
| 3. | Goncalves I, Hughan SC, Schoenwaelder SM, Yap CL, Yuan Y, Jackson SP. Integrin alpha IIb beta 3-dependent calcium signals regulate platelet-fibrinogen interactions under flow. Involvement of phospholipase C gamma 2. J Biol Chem. 2003;278:34812-34822. [PubMed] [DOI] |
| 4. | Nebe B, Holzhausen C, Rychly J, Urbaszek W. Impaired mechanisms of leukocyte adhesion in vitro by the calcium channel antagonist mibefradil. Cardiovasc Drugs Ther. 2002;16:183-193. [PubMed] [DOI] |
| 5. | Nebe B, Kunz F, Peters A, Rychly J, Noack T, Beck R. Induction of apoptosis by the calcium antagonist mibefradil correlates with depolarization of the membrane potential and decreased integrin expression in human lens epithelial cells. Graefes Arch Clin Exp Ophthalmol. 2004;242:597-604. [PubMed] [DOI] |
| 6. | Wu X, Davis GE, Meininger GA, Wilson E, Davis MJ. Regulation of the L-type calcium channel by alpha 5beta 1 integrin requires signaling between focal adhesion proteins. J Biol Chem. 2001;276:30285-30292. [PubMed] [DOI] |
| 7. | Matlin KS, Haus B, Zuk A. Integrins in epithelial cell polarity: using antibodies to analyze adhesive function and morphogenesis. Methods. 2003;30:235-246. [PubMed] [DOI] |
| 8. | Lévy P, Robin H, Bertrand F, Kornprobst M, Capeau J. Butyrate-treated colonic Caco-2 cells exhibit defective integrin-mediated signaling together with increased apoptosis and differentiation. J Cell Physiol. 2003;197:336-347. [PubMed] [DOI] |
| 9. | Gailit J, Clarke C, Newman D, Tonnesen MG, Mosesson MW, Clark RA. Human fibroblasts bind directly to fibrinogen at RGD sites through integrin alpha(v)beta3. Exp Cell Res. 1997;232:118-126. [PubMed] [DOI] |