修回日期: 2004-12-02
接受日期: 2004-12-08
在线出版日期: 2005-02-01
目的: 观察一氧化氮(nitric oxide, NO)对离体小鼠十二指肠肌条收缩幅度及去甲肾上腺素(noradrenaline, NA)对NO作用的影响; 探讨NA和NO之间的关系及影响机制.
方法: 将分离的小鼠十二指肠肌标本置于10 mL 37±1 ℃新鲜配置的Krebs液的浴槽中, 从浴槽底部持续通入950 mL/LCO2和50 mL/LO2的混合气体. 通过张力换能器记录张力变化, 观察NO对十二指肠肌条收缩幅度及NA对NO作用的影响, 用多种拮抗剂或抑制剂左旋-硝基精氨酸(L-NNA)、酚妥拉明、ODQ探讨NA与NO之间的关系.
结果: L-Arg对肌条的收缩幅度有明显的抑制作用, 在浓度2×10-2-2×10-6 mol/L范围内呈剂量-效应关系. 除2×10-6 mol/L 组外, 其余各浓度的L-Arg与对照组均有显著性差异(P<0.001). NA对肌条的收缩幅度有明显的抑制作用, 在浓度1.2×10-4-1.2×10-8 mol/L范围内呈剂量-效应关系. 除1.2×10-8 mol/L组外, 其余各浓度的NA与对照组均有显著性差异(P<0.001). 用无反应剂量1.2×10-8 mol/L的 NA 孵育标本后加入浓度为2×10-3, 2×10-4, 2×10-5, 2×10-6 mol/L的 L-Arg 对肌条收缩幅度的抑制作用明显增强, 与单独L-Arg组的作用相比差异有显著性(P<0.001); 而2×10-2 mol/L L-Arg组与单独L-Arg组的作用相比差异无显著性. 用1.2×10-6 mol/LNA孵育标本后加入L-Arg, 各浓度的L-Arg与单独L-Arg组相比差别有显著性(P<0.001). 分别用一氧化氮合酶(NOS)的抑制剂L-NNA, 可溶性鸟苷酸环化酶(sGC)抑制剂ODQ, a肾上腺素能受体阻断剂酚妥拉明均使NO对肌条收缩幅度抑制效应明显减弱, 与对照组比较有显著性差异(P <0.001).
结论: L-Arg经NOS催化生成NO, NO与sGC结合, 激活了NO的下游途径, 从而抑制了十二指肠肌收缩. 而NA可以增强NO的抑制效应, 可能是通过a受体直接或间接影响了NOS的活性或者NO受体后机制.
引文著录: 王晓敏, 胡还忠, 余承高, 马立群, 汪长东, 田琴. 去甲肾上腺素对一氧化氮在小鼠十二指肠肌条收缩中作用的影响机制. 世界华人消化杂志 2005; 13(3): 358-362
Revised: December 2, 2004
Accepted: December 8, 2004
Published online: February 1, 2005
AIM: To investigate the effect of nitric oxide (NO) on the contraction of isolated mouse duodenal muscle strip (DMS), and the influence of noradrenaline (NA) on the action of NO.
METHODS: DMS isolated from mice were suspended in tissue chambers containing Krebs solution (10 mL, 37±1 ℃), with a continuing supply of gas mixture (950 mL/LCO2, 50 mL/LO2) from the bottom. L-Arg was used to produce NO. Contraction of DMS in the presence of NO and NA was recorded with tension transducer. ODQ (inhibitor of sGC), L-NNA (general inhibitor of NOS), and phentolamine (blocker of a adrenergic receptor) were used to explore the relationship between NO and NA.
RESULTS: L-Arg at concentrations from 2×10-5 to 2×10-2 mol/L decreased the DMS contractile amplitude in a dose-dependent manner (P<0.001). No significant effect was observed when L-Arg was used at the concentration of 2×10-6 mol/L. Similarly, NA dose-dependently decreased the DMS contractile amplitude at concentrations ranging from 1.2×10-7 to 1.2×10-4 mol/L (P<0.001), but no significant effect was noted at 2×10-8 mol/L. At 1.2×10-8 mol/L, NA increased the effect of L-Arg at concentrations from 2×10-6 to 2×10-3 mol/L on the contraction of DMS (P<0.001); Furthermore, at 1.2×10-6 mol/L, NA enhanced the effect L-Arg at all concentrations from 2×10-6 to 2×10-2 mol/L (P<0.001). This effect of L-Arg was inhibited by L-NNA, ODQ and phentolamine (P<0.001).
CONCLUSION: NO can inhibit the contraction of the DMS, which can be synergized by NA through augmenting NO synthase activity or via a post-receptor mechanism.
- Citation: Wang XM, Hu HZ, Yu CG, Ma LQ, Wang CD, Tian Q. Effect of noradrenaline on nitric oxide action in the contraction of mouse duodenal muscle strips. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 358-362
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/358.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.358
NO是引起胃肠道舒张的非胆碱能非肾上腺素能(nonad-renergic noncholingeric, NANC)神经递质[1-2]. 近年研究发现, 外源性NO对大鼠空肠环形肌, 豚鼠结肠纵行肌, 大鼠结肠环形肌, 小鼠胃电活动和机械活动均有明显的抑制作用[3-4]. 电刺激离体肌条或内脏神经使NANC神经兴奋, 导致消化道平滑肌舒张, 同时NO生成明显增加. 研究表明, 整个消化道肌间神经丛中均有NOS阳性神经元分布. 除多数NOS阳性神经元之间有突起相连外, 个别NOS神经元与NOS阴性神经元之间也有突起相连, 提示NO作为一种神经递质不仅可单独发挥作用, 也可以与其他的神经递质或神经肽, 如ACh, ATP, GABA, VIP等[5-8]相互协调, 共同影响消化道的生理功能. NA是胃肠道中经典的神经递质, 对胃肠道的运动有抑制作用. 目前尚未见到小鼠十二指肠运动中NO与NA之间关系的报道. 我们观察NO对小鼠十二指肠肌条收缩活动的影响, 探讨NO与NA之间的关系以及可能的机制.
昆明小鼠40只, 质量15-20 g, 由华中科技大学同济医学院动物中心提供. ODQ(H-[1, 2, 4]Oxadiazolo[4, 3-a]quinoxaline-1-one), L-Arg, L-NNA(LW-nitro-L-arginine)粉剂均购于Sigma公司. L-Arg和L-NNA由蒸馏水配制, ODQ溶解在二甲亚砜中. 酚妥拉明购于上海旭东海浦药业有限公司, NA购自武汉远大制药集团股份有限公司. NaCl, KCl, CaCl2, MgSO4, NaHCO3, KH2PO4, 葡萄糖均为国产分析纯试剂. MS2000生物信号记录分析系统购于广州飞龙科技有限公司. 张力换能器(JH-2.5 g)购于北京航天医学工程研究所.
实验前小鼠禁食24 h, 自由饮水. 用颈椎脱臼法处死, 沿腹白线迅速打开腹腔, 暴露全胃, 以胃幽门为起点剪取约5 cm长的全层肌条. 迅速将肌条置于装有Krebs液的烧杯中. 再制成约1 cm长的标本, 将标本的一端固定于盛有10 mL, 37±1 ℃新鲜配置的Krebs液的浴槽中, 从浴槽底部持续通入950 mL/LCO2和50 mL/LO2的混合气体, pH = 7.4.Krebs液成分(mol/L): NaCl 119, KCl 4.5, CaCl2 2.5, MgSO4 2.5, KH2PO4 1.2, NaHCO3 25, 葡萄糖 11.1[9]. 标本另一端与张力换能器相连, 将肌条的收缩活动转化为电信号后, 输入到MS2000生物信号分析记录系统, 记录收缩曲线. 标本置于浴槽后, 给予200 mg的前负荷, 平衡60 min, 记录到有规律的收缩活动, 中间每隔15 min换Krebs液1次. 用微量注射器将一定浓度的药物在孵育液面下1-2 mm处沿管壁注入. 观察和记录每种药物作用后, 用37±1 ℃ Krebs液冲洗3次, 平衡10-15 min, 标本可完全恢复其节律性收缩. 观察一组试剂的作用效果后, 更换标本重复试验. 在实验中根据不同试剂的浓度和作用时间段进行分组. 观察L-Arg作用, 分六组, 每组10例. 其中一组为Krebs液对照组, 其余为剂量分别是2×10-6, 2×10-5, 2×10-4, 2×10-3, 2×10-2 mol/LL-Arg实验组. 将NA分为1.2×10-8, 1.2×10-7, 1.2×10-6, 1.2×10-5, 1.2×10-4 mol/L 5个浓度组, 每组各12例. 再分别用1.2×10-8 mol/L和1.2×10-6 mol/L NA作用标本, 以1 min为观察时间段, 分为1 min, 2 min, 3 min, 4 min, 5 min 5个组, 每组各10例. 观察NA对NO作用, 分两组, 即1.2×10-8 mol/LNA孵育后L-Arg组; 1.2×10-6 mol/LNA孵育后L-Arg组. 组内将L-Arg的浓度分为5种, 即2×10-6, 2×10-5, 2×10-4, 2×10-3, 2×10-2 mol/L(每种浓度n = 10). 数据分析以曲线变化高度作为肌条收缩幅度. 观察单一药物的作用, 以给药前10 min内收缩幅度平均值为对照值, 以给药稳定后收缩幅度平均值为效应值. 药物孵育标本后给药, 对照值为给药前的药物孵育稳定后收缩幅度平均值, 效应值为给药稳定后收缩幅度平均值. 以收缩幅度抑制比为指标, 即抑制比 = (对照值-效应值)/对照值100%.
统计学处理 数据以平均值±标准差(mean±SD)表达, 由SPSS11.5软件进行统计学分析, 用配对t检验判断加药前后的差异, 用ANOVA检验组内和组间各浓度和各时间段之间差异, P<0.05有统计学差异.
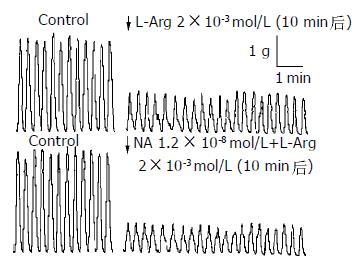
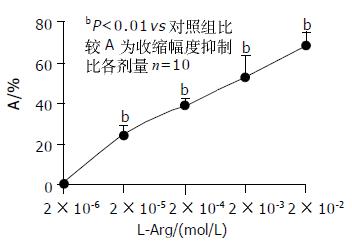
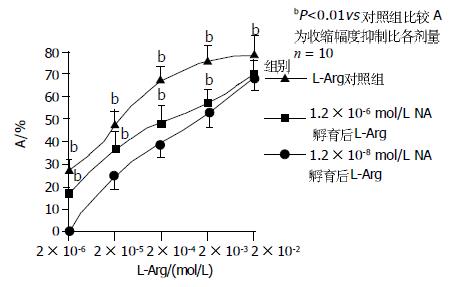
加入与L-Arg溶液等温等体积的Krebs液对肌条收缩活动无影响. 2×10-6-2×10-2 mol/L L-Arg对肌条收缩幅度有抑制作用(图1). 加药10 min稳定后, 收缩幅度抑制比分别为0.72±0.81%, 24.67±5.41%, 39.05±2.49%, 52.36±9.84%, 67.35±9.54%.除2×10-6 mol/L组加药前后无显著性差异外, 其余各组加药前后均有显着性差异(P<0.001). 随着浓度的减少, L-Arg对肌条收缩幅度的抑制减小, 呈剂量-效应关系(图2).
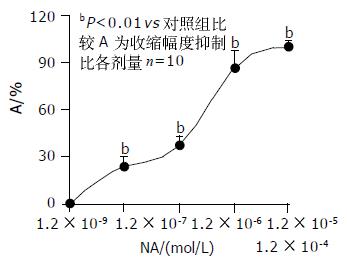
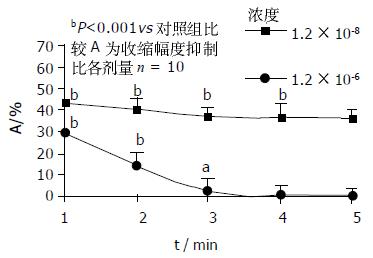
1.2×10-8-1.2×10-4 mol/LNA对肌条收缩幅度的抑制比分别为0.02±0.06%, 23.72±2.74%, 36.89±5.82%, 86.15±10.51%, 100±1.00%.除1.2×10-8 mol/L组加药前后无显著性差异外, 其余各组加药前后均有显著性差异(P<0.001). 各组之间均有显著性差异(P<0.001). 随着NA浓度增加对肌条收缩幅度的抑制作用也增强, 呈剂量-效应关系(图3). 以下实验NA选择1.2×10-6 mol/L和无反应剂量1.2×10-8 mol/L. 再分别用1.2×10-8 mol/L和1.2×10-6 mol/LNA作用标本, 观察不同时间段作用. 其中3 min和4 min组, 4 min和5 min组之间无显著性差异, 其余各组均有显著性差异(P<0.001). 表明孵育浓度NA在3 min抑制效果已趋于稳定(图4). 1.2×10-8 mol/LNA孵育肌条3 min, 加入2×10-6-2×10-2mol/LL-Arg. L-Arg对肌条收缩幅度的抑制程度明显增加, 抑制比分别为18.27±3.05%, 36.93±6.84%, 48.06±10.99%, 56.36±9.84%, 68.25±3.90%.其中NA孵育后2×10-3, 2×10-4, 2×10-5, 2×10-6 mol/L L-Arg组与对应各浓度单独的L-Arg组之间有显著性差异(P<0.001, 图5). 而2×10-2 mol/L浓度孵育组与对应浓度单独的L-Arg组间无显著性差异. 表明1.2×10-8 mol/LNA可以增强较低浓度L-Arg的抑制效应. 1.2×10-6 mol/LNA孵育肌条3 min加入2×10-6-2×10-2 mol/L L-Arg. 观察到L-Arg对肌条收缩幅度的抑制程度明显增强, 抑制比分别为28.14±5.45%, 46.93±6.24%, 63.23±9.84%, 74.36±8.40%, 78.13±11.54%.各组与对应各浓度单独的L-Arg组之间有显著性差异(P<0.001). 表明1.2×10-6 mol/LNA可以增强各浓度L-Arg的抑制效应.
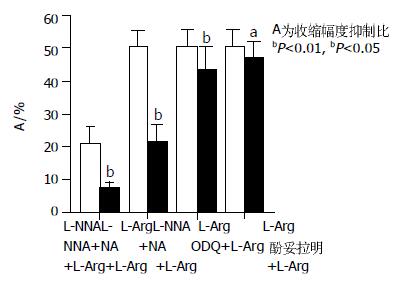
广谱NOS的抑制剂3×10-4 mol/L L-NNA孵育肌条5 min对收缩有增强作用(-18.15±4.77%, P<0.05), 表明内源性NO参与了肌条的活动. 再加入2×10-3 mol/L L-Arg(n = 10)则抑制肌条收缩幅度的效应减弱, 其抑制比为7.64±3.34%, 与单独L-Arg组(52.36±9.84%)之间有显著性差异(P<0.001, 图6). sGC的抑制剂3×10-6 mol/L ODQ孵育肌条5 min能增强收缩活动(-13.25±3.65%), 与加药前比较有统计学差异(P<0.05). 再加入2×10-3 mol/L L-Arg(n = 10)则抑制肌条收缩幅度的效应减弱, 抑制比为43.64±8.63%, 与单独L-Arg组(52.36±9.84%)之间有显著性差异(P<0.001, 图6). 表明L-Arg的抑制作用中有sGC参与. 4×10-6 mol/L酚妥拉明孵育肌条5 min能增强收缩幅度(-9.65±3.82%), 与加药前比较有显著性差异(P<0.001). 再加入2×10-3mol/LL-Arg(n = 10)则抑制肌条收缩幅度的效应减弱, 抑制比为47.29±5.26%, 与单独L-Arg组(52.36±9.84%)之间有差异(P<0.05, 图6). 表明酚妥拉明可以部分抑制L-Arg的作用. 3×10-4 mol/L L-NNA孵育肌条5 min加入2×10-3 mol/LL-Arg, 则抑制肌条收缩幅度的效应减弱, 抑制比为7.64±3.34%, 与单独L-Arg组(52.36±9.84%)之间有差异(P<0.001, 图6). 3×10-4 mol/L L-NNA孵育肌条5 min加入1.2×10-8 mol/L NA, 2 min后再加入2×10-3 mol/L L-Arg, 抑制比为21.79±6.77%, 与单独L-Arg组(52.36±9.84%)以及NA1.2×10-8和L-Arg2×10-3 mol/L组(56.36±9.84%)都有显著性差异(P<0.001, 图6).
L-Arg经NOS催化生成胍氨酸和NO. 我们的结果表明, NO对肌条自发节律性收缩幅度有抑制作用. L-Arg在浓度2×10-2-2×10-6 mol/L范围内呈浓度-效应关系. 低浓度L-Arg(2×10-6 mol/L)对肌条收缩幅度无影响, 而高浓度(2×10-2 mol/L)对肌条收缩有明显的抑制作用. 用L-NNA孵育肌条, 观察到肌条的收缩幅度增加, 说明肠道中有内源性NO的存在并发挥作用; 然后再加入L-Arg, 发现NO的作用将近90%被抑制, 而无100%抑制, 推测是因为L-NNA的浓度不足以全部抑制NO的生成. ODQ是sGC的抑制剂, 加入ODQ后, 使肌条的收缩幅度增加, 表明sGC也参与影响肠道运动; 然后再加入L-Arg, NO的抑制作用减弱, 可见NO的作用途径中需要sGC的参与. 近年的研究表明, NOS为一个双区结构, C端为还原酶区, 含有钙调蛋白(CaM)结合位点; N端为氧化酶区, 含有L-Arg的结合位点, 此区也与酶的催化活性有关. L-Arg进入神经末梢后, 激活电压依赖式Ca2+通道, Ca2+内流, 使得末梢内的[Ca2+]增加. Ca2+与CaM结合, 激活NOS[10]. L-Arg在NOS的催化下, 生成NO. 而L-NNA是L-精氨酸的类似物, 为广谱的NOS的抑制剂, 可与L-Arg竞争NOS N端的结合位点, 从而减少NO的生成. 由神经细胞生成的NO从神经末梢自由穿出, 与效应细胞中的最初受体即sGC血红素基序结合, 使酶发生变构效应而被激活, 使得cGMP生成增加, 进一步激活了cGMP依赖性蛋白激酶[11], 导致Ca2+通道关闭和Ca2+依赖性K+通道的开放[12], 使得肌肉收缩减弱.
交感神经末梢释放NA, 通过NA受体对胃肠运动起抑制作用. NAa, b均为G蛋白偶联受体, 其中a受体主要分布在肠肌间神经丛中的神经元上. NA对小肠运动的抑制性影响, 是通过a受体作用[13]. A的浓度在1.2×10-4-1.2×10-8 mol/L对小鼠十二指肠肌条的收缩幅度有明显的抑制作用, 呈剂量-效应关系. 提示NA是十二指肠运动中非常重要的抑制性神经递质. 分别用无反应剂量(1.2×10-8 mol/L)和有效剂量(1.2×10-6 mol/L)的NA孵育肌条后再加入L-Arg, L-Arg的抑制作用明显增强; 酚妥拉明是aNA受体的抑制剂, 他可以部分阻断NA的作用. 用酚妥拉明孵育肌条后, 再加入L-Arg, L-Arg的抑制作用明显减弱, 说明NA与NO抑制作用增强有关. L-NNA加入后再加入L-Arg(7.64±3.34%), 与L-NNA加入后再加入NA和中效量L-Arg(21.79±6.77%)相比, L-Arg抑制比前者比后者要小. 可见L-NNA对NO作用的抑制要比对NA孵育后的NO作用的抑制要大. 推测可能是由于NA通过某种途径直接或间接增强了NOS的活性, 而L-NNA不足以抑制NOS, 使得NO的生成增多, 也有可能促进了NO的释放或者通过a受体影响NO的受体后机制, 而对于NA促进NO作用的确切机制有待进一步的研究.
总之, NO和NA均可抑制小鼠十二指肠肌条收缩, 并且NA尚有增强NO的作用, 这些效应可能是通过增强神经元末梢的NOS的活性或影响NO的受体后机制实现的.
编辑: 潘伯荣 审读:张海宁
| 1. | Martin MJ, Jimenez MD, Motilva V. New issues about nitric oxide and its effects on the gastrointestinal tract. Curr Pharm Des. 2004;10:2483-2497. [PubMed] |
| 2. | Curro D, Preziosi P. Non-adrenergic non-cholinergic relaxation of the rat stomach. Gen Pharmacol. 1998;31:697-703. [PubMed] [DOI] |
| 3. | Vanneste G, Robberecht P, Lefebvre RA. Inhibitory pathways in the circular muscle of rat jejunum. Br J Pharmacol. 2004;143:107-118. [PubMed] [DOI] |
| 4. | Mule F, Serio R. NANC inhibitory neurotransmission in mouse isolated stomach: involvement of nitric oxide, ATP andvasoactive intestinal polypeptide. Br J Pharmacol. 2003;140:431-437. [PubMed] [DOI] |
| 5. | Van Geldre LA, Lefebvre RA. Interaction of NO and VIP in gastrointestinal smooth muscle relaxation. Curr Pharm Des. 2004;10:2483-2497. [PubMed] [DOI] |
| 6. | Peng X, Feng JB, Yan H, Zhao Y, Wang SL. Distribution of nitric oxide synthase in stomach myenteric plexus of rats. World J Gastroenterol. 2001;7:852-854. [PubMed] [DOI] |
| 7. | Pluja L, Fernandez E, Jimenez M. Neural modulation of the cyclic electrical and mechanical activity in the rat coloniccircular muscle: putative role of ATP and NO. Br J Pharmacol. 1999;126:883-892. [PubMed] [DOI] |
| 8. | Allescher HD, Kurjak M, Huber A, Trudrung P, Schusdziarra V. Regulation of VIP release from rat enteric nerveterminals: evidence for a stimulatory effect of NO. Am J Physiol. 1996;271:G568-574. [PubMed] |
| 9. | Boeckxstaens GE, Pelckmans PA, Bult H, Deman JG, Herman AG, Van Maercke YE. Evidence for nitric oxide as mediatorof non-adrenergic non-cholinergic relaxation induced by ATP and GABA in the canine gut. Br J Pharmacol. 1991;102:434-438. [PubMed] [DOI] |
| 10. | Busse R, Mulsch A. Calcium-dependent nitric oxide synthesis in endothelial cytosol is mediated by calmodulin. FEBS Lett. 1990;265:133-136. [PubMed] [DOI] |
| 11. | Rapoport RM, Murad F. Agonist induced endothelium-dependent relaxation in rat thoracicaorta may be mediatedthrough cyclic GMP. Circ Res. 1983;52:352-357. [PubMed] [DOI] |
| 12. | Craven PA, Derubertis FR. Restoration of the responsiveness of purified guanylate cyclase to nitrosoguanidine, nitricoxide and related activators by heme and heme proteins: evidence for the involvement of the paramagneticnitrosylheme complex in enzyme activation. J Biol Chem. 1978;253:8433-8443. [PubMed] |
| 13. | 周 吕, 柯 美云. 自主神经系统与胃肠运动. 胃肠动力学基础与临床. 北京: 科学出版社 1999; 55-56. |