修回日期: 2004-12-02
接受日期: 2004-12-08
在线出版日期: 2005-02-01
目的: 研究红景天甙对CCl4诱导的肝纤维化大鼠肝组织CBP、Smad基因表达的影响.
方法: SD大鼠90只分为3组: 正常对照组(C组)、模型组(M组)和红景天甙干预组(T组). 以CCl4 sc诱导肝纤维化, T组在造模同时给予红景天甙溶液ip. HE和Masson染色观察肝脏胶原沉积情况, 原位杂交和免疫组化检测肝组织Smad 3, Smad 7和CBP基因表达.
结果: T组肝脏组织学积分减少(2.1±0.3 vs 3.6±0.8, P = 0.041), 胶原平均面积显著减少(138±66 vs 691±189 mm2, P =0.046); 肝脏Smad 7蛋白表达阳性率增加[(4.27±0.43)% vs (2.86±0.86)%, P = 0.035, P<0.05]; Smad 3mRNA表达阳性率减少(0.18±0.03 vs 0.62±0.23, P = 0.026), CBP mRNA表达吸光度值亦明显减少(0.092±0.032 vs 0.235±0.025, P = 0.0 0012).
结论: 红景天甙能有效抑制Smad 3和CBP基因表达, 促进Smad 7表达, 从而干扰肝纤维化的形成.
引文著录: 曾维政, 吴晓玲, 蒋明德, 王丕龙, 褚桂珍. 红景天甙对肝纤维化大鼠肝组织CBP、Smad基因表达的影响. 世界华人消化杂志 2005; 13(3): 341-345
Revised: December 2, 2004
Accepted: December 8, 2004
Published online: February 1, 2005
AIM: To study the effect of Salidroside on gene expression of CREB binding protein (CBP), Smad 3 and Smad 7 in rat hepatic fibrosis induced by CCl4.
METHODS: Healthy male SD rats were randomly divided into three groups: normal group (n = 10), Salidroside therapeutic group (n = 40)and fibrosis model group (n = 40). Liver fibrosis was induced by CCl4 subcutaneous injection (300 mL/L, 3 mL/kg, twice per wk for 8 wks). Rats in therapeutic group received Salidroside (5 mg/kg)celiac injection twice a week. The deposition of collagen was examined using Masson staining. The gene expression of Smad 3, Smad 7 and CBP were detected by in situ hybridization and immunohistochemistry.
RESULTS: The reduction of collagen deposition and rearrangement of the parenchyma were observed in the livers of rats in the therapeutic group, in comparison with those in model group (semi-quantitative histological scores: 2.1±0.3 vs 3.6±0.8, P = 0.041; average area of collagen: 138±66 mm2vs 691189 mm2, P = 0.046). The positive rate of Smad 3 mRNA expression was significantly lower in therapeutic group than that in model group (0.18±0.03 vs 0.62±0.23, P = 0.026), while the positive rate of Smad 7 protein expression was markedly higher (4.27±0.43% vs 2.86±0.86%, P = 0.035). The OD value of CBP mRNA expression was significantly decreased in therapeutic group, as compared with that in model group (0.092±0.032 vs0.235±0.025, P = 0.00 012).
CONCLUSION: Salidroside can effectively reduce CCl4-induced liver fibrosis in rats. The mechanism may be related to its inhibition of Smad 3 and CBP expression, and its promotion of Smad 7 expression.
- Citation: Zeng WZ, Wu XL, Jiang MD, Wang PL, Chu GZ. Effect of Salidroside on gene expression of CBP and Smad in CCl4-induced liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 341-345
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/341.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.341
肝纤维化是多种慢性肝脏疾病发展为肝硬化的中间环节, 积极地控制肝纤维化的进展具有极为重要的临床意义. 寻找有效的治疗药物是目前肝病领域研究的热点[1-2]. 红景天具有保护肝细胞、调节机体免疫功能等多种功效, 在前期的动物实验观察到其具有良好的干预CCl4诱导的肝纤维化作用[3-5]. 我们观察了红景天的主要单体成分-红景天甙对CCl4诱导的肝纤维化大鼠肝脏胶原沉积的影响, 了解其对大鼠肝脏CBP, Smad3, Smad7基因表达的影响, 进一步从分子水平探讨红景天甙干预实验性大鼠肝纤维化的可能分子机制.
健康♂SD大鼠质量150±10 g, 购自华西医科大学实验动物中心; 化学纯CCl4(成都联合化工试剂研究所), 红景天甙粉剂(纯度80%, 昆明同持医药有限公司, 批号2003011016), Smads抗体及免疫组化试剂盒(武汉博士德生物工程公司), CBP探针及原位杂交试剂盒(上海申能生物工程公司).
健康♂SD大鼠随机分为3组: 正常对照组(C组)10只, 红景天甙干预组(T组)40只, 模型组(M组)40只, 各组间暴露因素无差别(P>0.05). 用300 mL/L CCl4石蜡油溶液, 3 mL/kg sc, 2次/wk, 共8 wk诱导大鼠肝纤维化模型. 红景天甙干预组在造模的同时给予100 g/L红景天甙灭菌水溶液, 5 mg/kg, ip, 2次/wk, 共8 wk, CCl4模型组在造模同时予生理盐水ip, 正常对照组予等量石蜡油sc和生理盐水ip处理. 各组动物在最后一次CCl4注射后48 h处死, 肝组织以中性甲醛溶液固定、石蜡包埋, 多聚赖氨酸涂布的载玻片制作5 mm组织切片, 进行HE染色和Masson胶原染色作组织病理学检查; 免疫组织化学(immunohistochemistry, IH)方法检测Smad 7蛋白表达水平, 原位杂交法(in situ hybridization, ISH)检测Smad 3, CBP mRNA表达水平, 检测步骤参考试剂说明书进行. Smad 3 mRNA探针序列(5'→3'): Biotin-GAA GGC CGG CTC ACA GTA GGT GAC TGG CTG(981-1 010 bp, GC% = 63.33), 以生物素标记探针, 碱性磷酸酶搭桥, BCIP/NBT显色反应; CBP mRNA探针序列(5'→3'): Dig-TGA CAG TTG TTT ATG TTT GGA CGC (371-394bp, GC% = 41.67), 以地高辛标记探针, 辣根过氧化物酶搭桥, DAB显色反应, 显微镜下观察结果, 胶原纤维染色、Smads表达水平的ISH, IH检测结果均使用日本Nikon TE2000-H倒置显微镜采集图像, 美国Image-Pro Plus专业图像分析软件进行数据采集和分析.
统计学处理 胶原面积、IH, ISH表达阳性率均以mean±SD表示, Excel 2000统计软件进行t检验.
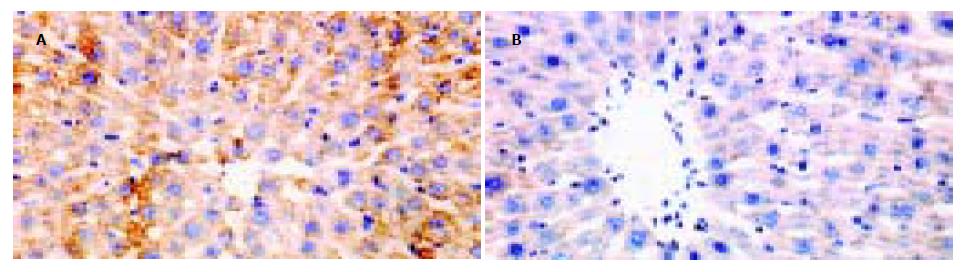
HE染色光镜下可见正常大鼠肝组织肝小叶结构清晰, 肝细胞围绕中央静脉呈放射状排列, 肝纤维化大鼠肝细胞广泛脂肪变性、坏死, 炎性细胞浸润以汇管区及中央静脉周围为重, 肝小叶结构破坏, 胶原纤维明显增生; Masson染色见蓝色胶原纤维明显增多, 汇管区-中央静脉区纤维间隔宽大, 包绕分隔肝小叶, 部分形成假小叶, 肝纤维化半定量组织学积分为3.6±0.8; 红景天甙干预治疗组大鼠肝细胞变性、坏死较轻, 有少量纤维组织增生, 形成纤细的纤维间隔, 肝小叶结构基本完整, 半定量组织学积分为2.1±0.3, 与模型组比较差异显著(P = 0.041, P<0.05, )计算机图象分析模型大鼠肝脏平均胶原面积为(691±189 mm2), 干预组胶原面积则减少为(138±66 mm2), 二者差异显著(P = 0.046, P<0.01, 表1, 图1A-B).
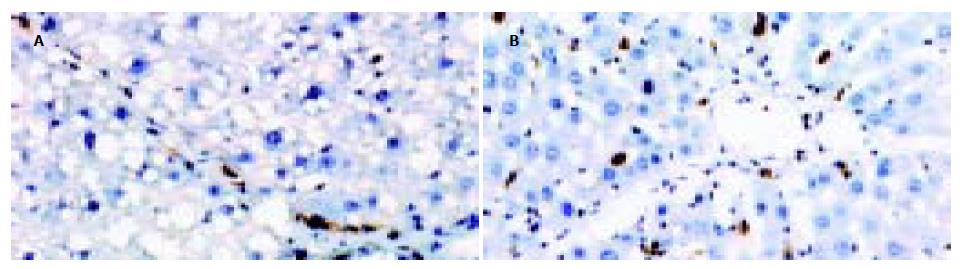
原位杂交检测显示, Smad 3 mRNA在正常大鼠肝脏仅有少许间质细胞显示阳性结果, 为胞质细小的蓝紫色颗粒, 且表达强度微弱; CCl4 sc使大鼠肝脏Smad 3mRNA表达明显增加, 间质细胞和肝细胞均有表达, 计算机图像分析其表达阳性率为0.62±0.23, 而红景天甙干预性治疗使大鼠肝组织Smad 3 mRNA表达阳性率下降为0.18±0.03, 与模型组比较差异显著(P = 0.026, P<0.05). 免疫组化检测表明, 正常大鼠肝脏未检测出Smad 7阳性表达; 模型大鼠肝脏Smad 7蛋白表达水平低下, 仅在汇管区见少数间质细胞阳性显色, 为胞质棕黄色的颗粒(图2A), 计算机图像分析其阳性率为2.86±0.86%; 而红景天甙干预组肝脏Smad7蛋白阳性表达亦位于间质细胞(图2B), 阳性率增加为4.27±0.43%, 与模型组比较差异显著(P = 0.035, P<0.05).
TGFb(transforming growth factor-b, 转化生长因子b)-Smad信号传导通路是肝纤维化主要的信号传导途径[6-12]. Smad蛋白家族是TGFb受体后信息分子, 参与调控细胞的增生、转化、合成、分泌和凋亡, 其成员根据功能不同分为三类: 受体激活Smad(R-Smad), 共用Smad(Co-Smad), 和抑制性Smad(I-Smad). 来自TGFb的信号与细胞膜表面的Ⅰ、Ⅱ型受体结合后使R-Smad(Smad2, 3)磷酸化而活化, Smad2, 3再和胞质中的Smad 4(Co-Smad)结合为多聚体转位入细胞核, 进而与一系列的转录辅激活蛋白或转录辅阻遏分子结合调节靶基因表达[13-16]; Smad6, 7(I-Smad)则分别抑制Smads多聚体形成和抑制R-Smads磷酸化而阻止该信号转导过程[17], 其表达下调可能与慢性肝病的持续化及进展为肝纤维化有关[18]. CREB(cAMP response element(CRE)-binding protein, cAMP反应元件结合蛋白)是一重要的核转录因子, 为bZIP家族成员之一. CREB受多种信号转导通路的调控, 除经典的cAMP调控通路外, 还有Ras-Raf-MAPK通路、Ca2+-CaMK通路、应激相关的P38通路等. 活化的CREB需同转录辅激活因子CBP(CREB binding protein)相结合, 才能激活转录发生. CBP是将TGFb信号转化为生物学效应的关键分子, 通过激活AP-1等转录因子促进靶基因表达, 引起胶原蛋白合成、肝细胞再生、肝小叶重建等生物效应[19-20]. 对TGFb-Smad信号传导通路及其关键分子表达状况的深入研究不仅有助于进一步阐明肝纤维化的发病机制[21-25], 也为肝纤维化的防治提供了一个新的途径.
Flanders[26]认为, TGFb的促纤维化效应主要是由Smad3介导的, 因此, 促进抑制性分子Smad7的过度表达或者使用小分子物质halofuginone抑制Smad3的功能将是非常有效的抗纤维化措施. 国内梁志清et al[27-28] 通过门静脉灌注将高滴度的反义Smad4重组腺病毒载体导入大鼠纤维化肝脏, 结果转基因鼠肝脏内源性Smad4表达降低, 且肝脏Ⅰ型胶原明显减少, 表明抑制Smad4的表达有潜在抗肝纤维化价值. 张国et al[29]研究发现, 中药活血软坚方能够减少肝星状细胞合成Smad3; 宋仕玲et al[30]则在中药金三莪的抗肝纤维化实验中观察到促进Smad7表达、抑制Smad3表达的作用. 这些研究初步证实, 调节Smads分子的表达是行之有效的抗肝纤维化途径.
中药红景天的主要成分为红景天甙、甙元酪醇以及多种氨基酸, 在抗缺氧、抗疲劳、调节免疫、抗缺血等方面广为应用. 前期研究证实, 红景天能保护肝细胞、减少肝脏胶原合成, 有效抑制CCl4诱导的实验性大鼠肝纤维化[3-5]. 红景天甙是红景天的主要活性成分, 细胞培养实验显示红景天甙对肝星状细胞增生、活化有抑制作用, 能减少肝星状细胞合成胶原. 我们以红景天甙溶液ip干预大鼠肝纤维化, 研究药物干预作用下Smad基因及其下游关键的分子CBP的表达状况, 初步探讨红景天甙对大鼠肝纤维化的防治作用及其分子机制, 结果表明红景天甙能有效抑制CCl4诱导的肝组织损害和肝脏胶原沉积, 干预组大鼠肝脏胶原平均面积由691 mm2减少为138 mm2(P<0.01); Smad3 mRNA表达阳性率由62%下降为18%(P<0.05), CBP mRNA表达平均吸光度值由0.235下降为0.092(P<0.01); 同时, Smad7蛋白表达阳性率则由2.86%增加为4.27%(P<0.05). 这些结果表明, 红景天甙干预性治疗能够有效调节实验性大鼠肝纤维化TGFb-Smad信号转导通路中关键信息分子的基因表达, 进而其下游的基因CBP表达亦明显减少, 从而干扰了TGFb介导的肝纤维化信号向细胞内传递及下游效应基因的表达. 本研究中Smads分子主要表达于间质细胞, 符合星状细胞、Kupffer等间质细胞在肝纤维化发病中的关键地位; 但CBP处于该信号通路中较下游的位置, 其表达以肝实质细胞为主, 反映肝细胞也是细胞外基质的重要细胞来源, 可能通过某种未知的通路或者不同的细胞信号通路之间的交互作用(cross-talk)放大了来自TGFb1的肝纤维化信号, 使其效应在实质细胞与间质细胞均有表达, 该信号转导通路的分子传导细节以及红景天甙抗实验性大鼠肝纤维化的确切分子机制有待进一步研究阐明.
编辑: 潘伯荣 审读:张海宁
| 1. | 伍 建业, 郭 传勇. 肝纤维化药物治疗进展. 同济大学学报(医学版). 2004;25:165-168. |
| 3. | 曾 维政, 吴 晓玲, 蒋 明德, 陈 晓斌, 徐 辉, 王 钊, 熊 碧君. 复方红景天对大鼠肝组织转移生长因子-b1 mRNA 表达的影响. 中国中西医结合消化杂志. 2002;10:138-141. |
| 4. | 曾 维政, 吴 晓玲, 蒋 明德, 邓 桂英, 陈 晓斌, 张 勇, 秦 建平, 徐 辉. 复方红景天干预肝纤维化大鼠胶原代谢. 世界华人消化杂志. 2003;11:975-978. [DOI] |
| 5. | Wu XL, Zeng WZ, Wang PL, Lei CT, Jiang MD, Chen XB, Zhang Y, Xu H, Wang Z. Effect of compound rhodiolasachalinensis A Bor on CCl4-induced liver fibrosis in rats and its probable molecular mechanisms. World J Gastroenterol. 2003;9:1559-1562. [PubMed] [DOI] |
| 8. | 王 连升, 陈 颖伟, 李 定国. TGF-β1激活与肝纤维化. 国外医学消化系疾病分册. 2003;23:222-225. |
| 9. | 宋 仕玲, 龚 作炯, 张 全荣. TGF-β及Smad与肝纤维化. 国外医学消化系疾病分册. 2003;23:206-209. |
| 12. | 郭 顺根, 戴 敏, 张 玮, 谢 艳爽. 肝纤维化发生发展与信号转导途径. 中国组织化学与细胞化学杂志. 2003;12:106-111. |
| 13. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-βeta in hepatic fibrosis. Front Biosci. 2002;7:793-807. [PubMed] [DOI] |
| 15. | Liu C, Gaca MDA, Swenson ES, Vellucci VF, Reiss M, Wells RG. Smads 2 and 3 are differentially activated bytransforming growth factor-beta (TGF-βeta)in quiescent and activated hepatic stellate cells. J Biol Chem. 2003;278:11721-11728. [PubMed] [DOI] |
| 16. | ten Dijke P, Hill CS. New insights into TGF-βetα-SMAd signalling. Trends Biochem Sci. 2004;29:265-273. [PubMed] [DOI] |
| 17. | Dooley S, Hamzavi J, Breitkopf K, Wiercinska E, Said HM, Lorenzen J, Ten Dijke P, Gressner AM. Smad7 preventsactivation of hepatic stellate cells and liver fibrosis in rats. Gastroenterology. 2003;125:178-191. [PubMed] [DOI] |
| 18. | Kitamura Y, Ninomiya H. Smad expression of hepatic stellate cells in liver cirrhosis in vivo and hepatic stellate cell linein vitro. Pathol Int. 2003;53:18-26. [PubMed] [DOI] |
| 19. | 畅 晓燕, 方 家椿. 核蛋白CREB的转录调控机制. 国外医学分子生物学分册. 2002;24:136-139. |
| 20. | Janknecht R, Wells NJ, Hunter T. TGF-βeta-stimulated cooperation of smad proteins with the coactivators CBP/p300. Genes Dev. 1998;12:2114-2119. [PubMed] [DOI] |
| 25. | 王 启伟, 朴 英杰. Smad蛋白信号网络. 国外医学分子生物学分册. 2003;25:206-209. |
| 26. | Flanders KC. Smad3 as a mediator of the fibrotic response. Int J Exp Pathol. 2004;85:47-64. [PubMed] [DOI] |