修回日期: 2004-09-19
接受日期: 2004-09-24
在线出版日期: 2005-02-01
目的: 探索卵圆细胞在参与实验性肝损伤修复过程中的作用和地位.
方法: 清洁型SD 大鼠随机分为正常组20只和实验组40只, 各组于肝癌造模后的不同时段取肝组织标本进行常规病理和C-kit, PCNA免疫组化检测.
结果: 正常组大鼠肝脏表面光滑, 组织学形态正常, 偶见C-kit和PCNA阳性细胞. 实验组于肝脏染毒2 wk, 首先于汇管区发现卵圆细胞沿胆管上皮依次排列增生, 这些卵圆细胞呈C-kit和PCNA阳性表达. 随着染毒加重, 大量卵圆细胞以汇管区为中心向肝小叶穿插生长, 正常肝细胞逐渐固缩、消亡. 肝癌形成时, 癌结节内外均见有卵圆细胞聚集.
结论: 卵圆细胞在肝损伤修复中发挥主导作用; 与肝癌的发生密切相关.
引文著录: 龚加庆, 李雅, 方驰华. 大鼠肝卵圆细胞参与肝损伤的修复过程和癌变. 世界华人消化杂志 2005; 13(3): 336-340
Revised: September 19, 2004
Accepted: September 24, 2004
Published online: February 1, 2005
AIM: To explore the role of oval cells in progressing hepatic injury and repair as well as hepatocarcinogenesis.
METHODS: SD rats were randomly divided into normal group(n = 20)and test group(n = 40). Hepatocarcinoma model was established by feeding the rats with 3, 3-diaminobenzidine(DAB). Pathological changes in the liver were examined under light microscope. The expression of c-kit and proliferating cell nuclear antigen(PCNA)were determined by immunohistochemistry.
RESULTS: In the normal group, smooth surface and normal histology of the liver were observed, and little expression of c-kit and PCNA was detected. In the test group, oval cells with positive expression of c-kit and PCNA were first observed in the portal area two weeks after liver injury. The oval cells proliferated along with the bile duct epithelia. With the progress of hepatic injury, the oval cells extended into the centrilobular regions, and the liver cells gradually deflated and disappeared. When hepatocarcinoma occurred, a great number of oval cells were found inside and outside the cancer nodule.
CONCLUSION: The oval cells play a leading role in the progressing hepatic injury and repair, and in the process of hepatocarcinogenesis.
- Citation: Gong JQ, Li Y, Fang CH. Role of oval cells in the repair of liver injury and hepatocarcinogenesis. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 336-340
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/336.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.336
肝细胞损伤修复是一个复杂的、有机的、协调的过程, 目前有观点认为肝卵圆细胞在肝损伤时可向肝细胞和胆管上皮细胞分化, 被称为肝干细胞, 卵圆细胞在参与肝损伤修复过程中的作用和地位到底怎样?目前存在很大争论; 在肝细胞进行性受损过程中, 肝损伤的异常修复意味着可能癌变, 卵圆细胞是否也参与了原发性肝细胞癌(HCC)的形成?这一问题还不清楚; 卵圆细胞的起源怎样?这一问题也存在较大的争议. 本实验行大鼠肝癌造模, 研究卵圆细胞的肝内起源、在肝损伤过程中的作用及其与肝癌的关系.
清洁型SD大鼠60只, 雌雄不限, 体质量120±20 g, 为中山医科大学动物实验中心提供. 3'-甲基-4-二甲基氨偶氮苯(3, 3-diaminobenzidine DAB), 上海化工厂产品; PCNA免疫组化试剂盒(SP法), 北京宝洁公司提供. C-kit多克隆抗体, Sigma公司提供. 即用型免疫组化试剂盒(SABC法), 武汉博士德公司提供.
随机分正常组20只和实验组40只, 正常组大鼠常规喂饲和饮水; 实验组大鼠喂饲0.6 g/L的DAB饲料, 常规饮水. 两组大鼠于肝癌造模后2, 4, 6, 8, 10, 12, 14, 16, 20, 24 wk分别随机活杀2只和4只. 开腹取右肝叶甲醛固定, 左肝叶置-80 ℃保存. 右肝叶经固定、脱水、透明、浸蜡等过程制成蜡块. 蜡块连续切片, 厚度为5 mm, 分别作常规HE染色和免疫组化染色. PCNA免疫组化用SP法, C-kit免疫组化采用S-ABC法, 均用DAB显色. PCNA和C-kit蛋白均呈棕黄色.
正常组大鼠肝脏表面光滑, 质地柔软, 呈褐色, 光泽明显. HE染色后镜下观察, 肝细胞排列呈索状, 围绕中央静脉呈放射状排列, 肝细胞呈多边形, 边界不十分清晰, 多为单核, 嗜碱性, 位于细胞中央, 胞质微嗜酸性. 实验组大体病变早期(1-8 wk): 肝脏形态基本正常, 轻度增大, 肝脏表面可见针尖样细小颗粒, 呈局灶性, 色泽没有明显变化, 偶见肝脏有轻度充血及小出血点; 中期(9-14 wk): 肝脏肿大, 呈暗褐色, 肝表面出现为数不多的灰白色圆形病灶, 直径多在1 mm以内, 至12 wk病灶数目渐多, 肝脏质地变硬, 至14 wk呈典型的肝硬化表现, 个别结节直径可达0.3 cm; 晚期(15-24 wk): 肝脏呈结节状增大, 最大的肿块可延伸至盆腔, 肝脏表面及切面布满了灰白色结节, 最大直径可达3.0 cm, 质地硬, 结节间有时可见纤维隔, 个别大结节可见黑色的出血灶.
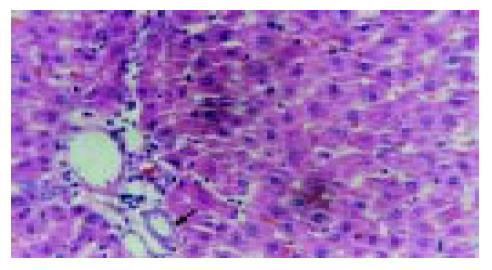
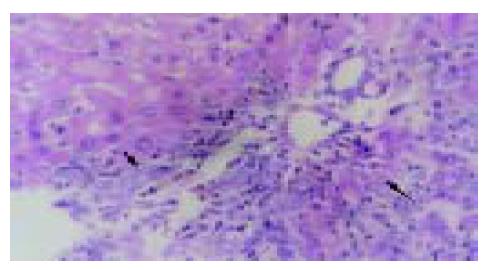
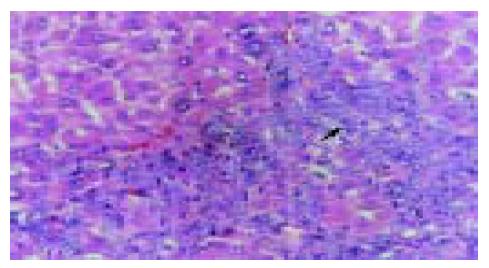
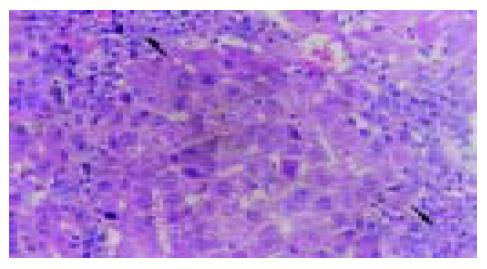
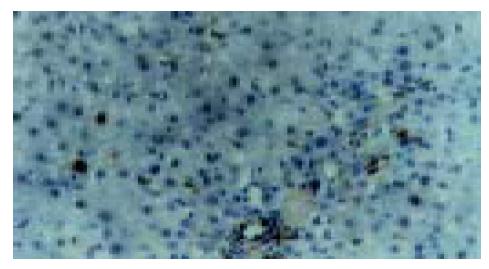
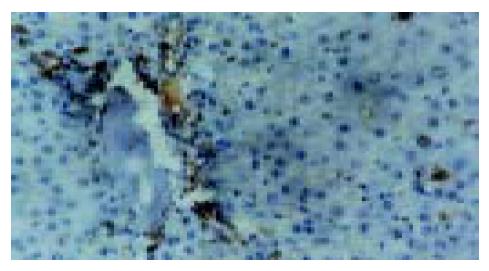
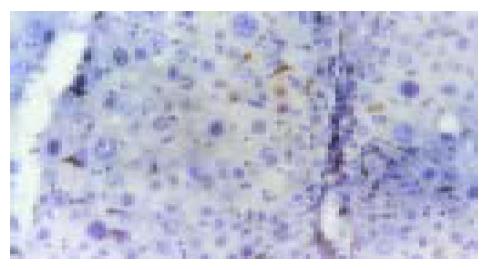
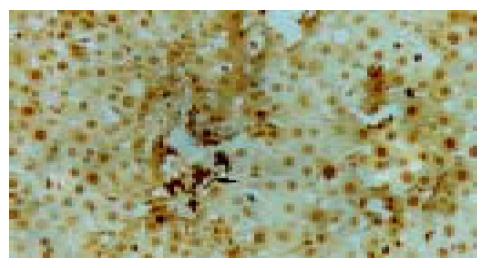
实验组肝组织炎性变期(1-8 wk): 肝小叶结构基本完整, 肝细胞水肿样变性、气球样变性逐渐加重, 细胞核增大(图1). 炎性变后期, 肝细胞呈明显气球样变, 部分肝细胞核固缩甚至消失(图2). 肝细胞索排列较整齐, 肝实质内可见散在坏死灶和炎性细胞浸润; 肝窦充血明显, 汇管区有大量淋巴细胞浸润; 诱癌2 wk, 于汇管区首先可见卵圆细胞沿胆管上皮依次排列增生, 并逐渐向上皮周围游离生长(图1), 随着时间的推移, 卵圆细胞逐渐增多, 破坏附近肝板, 呈溪流样向肝实质内穿梭漂移(图2). 肝组织增生纤维化期(9-14 wk): 光镜下可见有大量形态不一、细胞排列不齐、肝实质内纤维组织增生的假小叶形成; 有些结节细胞排列紊乱, 细胞大小不一, 核深染, 失去正常肝组织结构, 呈非典型增生改变, 偶见核分裂相; 汇管区有大量卵圆细胞增生, 或呈河带样, 或呈溪流样横七竖八、纵横交错的向肝实质内穿插, 肝细胞呈逐渐固缩、消亡趋势, 残存的肝细胞零星夹杂在增生的卵圆细胞之间(图3). 癌变期(15-24 wk): 以混合细胞癌多见, 癌细胞核大小不等, 核分裂相常见; 癌细胞向肝组织周围浸润, 并有灶内出血, 灶内坏死明显; 癌结节外可见有较多卵圆细胞聚集, 癌结节内也可见卵圆细胞出现(图4).
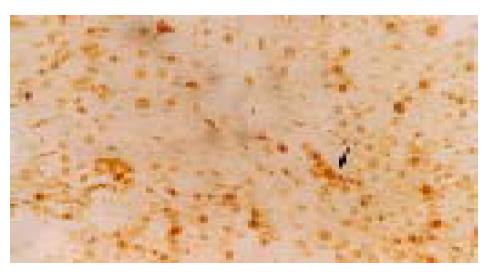
C-kit阳性着色定位于细胞质, 呈均匀弥漫性棕黄色, 正常组肝细胞偶见阳性染色, 通常为正处于分裂增生期的肝细胞, 汇管区未见有阳性着色. 实验组染毒2 wk开始, 汇管区卵圆细胞首先呈c-kit阳性着色, 镜下可见部分阳性细胞沿胆管上皮横断面呈环状排列(图5). 染毒的8 wk, 汇管区C-kit阳性细胞连成片状, 并向肝小叶内穿插生长(图6). 增生纤维化期, 肝组织的正常结构已被大量的假小叶取代, 此期c-kit阳性细胞仍呈大量表达, 以汇管区明显. 染毒22 wk, 癌结节大量形成, 镜下可见细胞核异形性相当明显, 阳性细胞较前有所减少, 仍主要集中在汇管区, 癌结节内也可见散在的阳性细胞(图7).
PCNA阳性着色定位于细胞核, 呈颗粒状或弥漫性, 部分为细胞质着色. 在正常肝组织内偶见阳性染色细胞, 多位于肝小叶内. 染毒2 wk, 实验组汇管区的卵圆细胞首先呈PCNA阳性染色, 这些阳性细胞多沿胆管上皮依次排列生长(图8). 随着肝损伤加重, 小叶内大量的肝细胞也呈阳性表达, 但仍以汇管区卵圆细胞阳性着色为重(图9). 增生纤维化期, 部分肝纤维呈轻度阳性淡染, 沿肝纤维生长呈过阳性表达的细胞类似卵圆细胞(图10). 肝癌形成期, 部分癌结节PCNA呈过度阳性表达, 结节内癌细胞的阳性强度存在较大的异质性, 癌旁PCNA阳性细胞的异质性不如癌细胞明显, 癌旁PCNA阳性细胞明显少于癌组织且分布散在, 以近癌旁组织相对较多.
卵圆细胞呈圆形或卵圆形, 胞质少, 嗜碱性, 核圆形或卵圆形, 着色淡, 核膜及核仁均清晰, 在肝细胞严重受损或分裂增生受抑制时可向肝细胞和胆管上皮细胞分化[1-9], 所以卵圆细胞是一种具有双向分化潜能的祖细胞, 我们习惯称之为肝干细胞. 在肝细胞正常衰亡时, 通常认为由正常肝细胞通过再生方式来填补消亡细胞的空白[10-13], 而在本实验中, 我们发现肝卵圆细胞不仅是肝组织内对进行性受损反应最敏感的一种细胞, 也是参与肝损伤修复的主导细胞. 证据: (1)我们发现在炎性变早期, 肝细胞呈轻度的水肿样变性时, 卵圆细胞沿汇管区胆管上皮增生, 随着肝损伤进行性加重, 汇管区卵圆细胞逐渐增多, 并以汇管区为中心向肝实质内穿插生长, 破坏临近肝板, 以增生纤维化期最为明显; (2)C-kit作为一种干细胞的特异性表面抗原[14-18], 我们应用他对卵圆细胞进行定位. 炎性变早期, 我们发现 C-kit阳性着色首先表达于汇管区的卵圆细胞, 这些阳性细胞沿胆管上皮呈依次排列生长, 随着肝损伤进行性加重, C-kit阳性细胞向肝小叶内穿插, 癌变期, C-kit阳性表达仍以汇管区为主, 这表明汇管区从肝损伤初期到癌变期一直在源源不断的向外输送卵圆细胞; (3)PCNA作为细胞增生指标, 其合成明显与细胞周期相关[19-23]. 我们发现PCNA阳性染色也首先表达于汇管区卵圆细胞, 这些阳性细胞多沿胆管上皮生长, 而小叶内肝细胞呈现迟发性PCNA阳性表达.
我们发现在致癌因素存在的情况下, 肝癌的形成与卵圆细胞异常分化密切相关. 卵圆细胞为肝组织内对损伤反应最敏感的一种细胞, 他的出现贯穿于肝癌发生、发展全过程, 癌结节内外也可见大量卵圆细胞聚集, 可见卵圆细胞对肝癌的发生、发展起到重要作用; C-kit和PCNA免疫组化证实卵圆细胞为一个增生活跃的幼稚细胞群体, 在其分化成熟过程中, 如果致癌因素存在的情况下, 其基因完全有可能发生突变, 向癌细胞转化; 卵圆细胞可向肝细胞和胆管上皮细胞分化, 从理论上说, 卵圆细胞如果可向癌细胞转变, 其癌细胞类型应以混合型多见, 这与我们的肝癌形成期的病理检查结果相符.
成体肝组织内存在干细胞已是不争的事实, 但干细胞究竟来源于何处?一直以来仍无定论. 我们发现, 汇管区胆管上皮为卵圆细胞的肝内发源地. 病理观察发现, 卵圆细胞首先出现于汇管区的胆管上皮层, 随着肝脏染毒的加重, 卵圆细胞以汇管区为中心向肝实质内穿插生长; C-kit和PCNA免疫组化发现, 这些阳性细胞最初均沿汇管区胆管上皮依次排列生长, 随着染毒的加重, 阳性细胞向肝小叶内穿插. 严格的说, 卵圆细胞仅只是肝内的一种祖细胞, 我们的研究证实卵圆细胞起源于汇管区胆管上皮, 有关这一点, 我们在以前的文献中也作过表述[24-25]真正的卵圆细的前体-肝干细胞究竟起源于何处, 许多作者进行了有益的探索, 但仍存在很大的争论[26-29].
编辑: 潘伯荣 审读:张海宁
| 1. | Weiss MC, Strick-Marchand H. Isolation and characterization of mouse hepatic stem cells in vitro. Semin Liver Dis. 2003;23:313-324. [PubMed] [DOI] |
| 2. | Alison MR. Characterization of the differentiation capacity of rat-derived hepatic stem cells. Semin Liver Dis. 2003;23:325-336. [PubMed] [DOI] |
| 3. | Zheng YW, Taniguchi H. Diversity of hepatic stem cells in the fetal and adult liver. Semin Liver Dis. 2003;23:337-348. [PubMed] [DOI] |
| 4. | Grompe M. The role of bone marrow stem cells in liver regeneration. Semin Liver Dis. 2003;23:363-372. [PubMed] [DOI] |
| 5. | Strain AJ, Crosby HA, Nijjar S, Kelly DA, Hubscher SG. Human liver-derived stem cells. Semin Liver Dis. 2003;23:373-384. [PubMed] [DOI] |
| 6. | Lemmer ER, Vessey CJ, Gelderblom WC, Shephard EG, Van Schalkwyk DJ, Van Wijk RA, Marasas WF, Kirsch RE, Hall Pde L. Fumonisin B1-induced hepatocellular and cholangiocellular tumors in male Fischer 344 rats: potentiating effects of 2-acetylaminofluorene on oval cell proliferation and neoplastic development in a discontinued feeding study. Carcinogenesis. 2004;25:1257-1264. [PubMed] [DOI] |
| 7. | Hisatomi Y, Okumura K, Nakamura K, Matsumoto S, Satoh A, Nagano K, Yamamoto T, Endo F. Flow cytometric isolation of endodermal progenitors from mouse salivary gland differentiate into hepatic and pancreatic lineages. Hepatology. 2004;39:667-675. [PubMed] [DOI] |
| 8. | He ZP, Tan WQ, Tang YF, Zhang HJ, Feng MF. Activation, isolation, identification and in vitro proliferation of oval cells from adult rat livers. Cell Prolif. 2004;37:177-187. [PubMed] [DOI] |
| 9. | Matthews VB, Klinken E, Yeoh GC. Direct effects of interleukin-6 on liver progenitor oval cells in culture. Wound Repair Regen. 2004;12:650-656. [PubMed] [DOI] |
| 10. | Caldwell SH, Crespo DM, Kang HS, Al-Osaimi AM. Obesity and hepatocellular carcinoma. Gastroenterology. 2004;127:S97-103. [PubMed] [DOI] |
| 11. | Oberholzer C, Oberholzer A, Tschoeke SK, Minter RM, Bahjat FR, LaFace D, Hutchins B, Moldawer LL. Influence of recombinant adenovirus on liver injury in endotoxicosis and its modulation by IL-10 expression. J Endotoxin Res. 2004;10:393-401. [PubMed] [DOI] |
| 12. | Al-Mulhim AS, Mohammad HA. Non-operative management of blunt hepatic injury in multiply injured adult patients. Surgeon. 2003;1:81-85. [PubMed] [DOI] |
| 13. | Labori KJ, Raeder MG. Diagnostic approach to the patient with jaundice following trauma. Scand J Surg. 2004;93:176-183. [PubMed] |
| 14. | Suárez-Rodríguez R, Belkind-Gerson J. Cultured nestin-positive cells from postnatal mouse small bowel differentiate ex vivo into neurons, glia, and smooth muscle. Stem Cells. 2004;22:1373-1385. [PubMed] [DOI] |
| 15. | Maulik G, Bharti A, Khan E, Broderick RJ, Kijima T, Salgia R. Modulation of c-Kit/SCF pathway leads to alterations in topoisomerase-I activity in small cell lung cancer. J Environ Pathol Toxicol Oncol. 2004;23:237-251. [PubMed] [DOI] |
| 16. | Miyazaki M, Masaka T, Akiyama I, Nakashima E, Sakaguchi M, Huh NH. Propagation of adult rat bone marrow-derived hepatocyte-like cells by serial passages in vitro. Cell Transplant. 2004;13:385-391. [PubMed] [DOI] |
| 17. | von Schönfeldt V, Wistuba J, Schlatt S. Notch-1, c-kit and GFRalpha-1 are developmentally regulated markers for premeiotic germ cells. Cytogenet Genome Res. 2004;105:235-239. [PubMed] [DOI] |
| 18. | Potti A, Ganti AK, Foster H, Knox S, Hebert BJ, Tendulkar K, Sholes K, Koch M, Kargas S. Immunohistochemical detection of HER-2/neu, c-kit (CD117) and vascular endothelial growth factor (VEGF) overexpression in soft tissue sarcomas. Anticancer Res. 2004;24:333-337. [PubMed] |
| 19. | Zhu Z, Xing S, Cheng P, Li G, Yang Y, Zeng F, Lu G. The relationship of expression of bcl-2, p53, and proliferating cell nuclear antigen (PCNA) to cell proliferation and apoptosis in renal cell carcinoma. J Huazhong Univ Sci Technolog Med Sci. 2004;24:354-357. [PubMed] [DOI] |
| 20. | Corrette-Bennett SE, Borgeson C, Sommer D, Burgers PM, Lahue RS. DNA polymerase delta, RFC and PCNA are required for repair synthesis of large looped heteroduplexes in Saccharomyces cerevisiae. Nucleic Acids Res. 2004;32:6268-6275. [PubMed] [DOI] |
| 21. | Yeung CK, Chiang SW, Chan KP, Lam DS, Pang CP. The transfer of ocular cells using collagen. Cell Transplant. 2004;13:585-594. [PubMed] [DOI] |
| 22. | Shimoji Y, Sugie S, Kohno H, Tanaka T, Nanda K, Tamura Y, Nishikawa Y, Hayashi R, Uenakai K, Ohigashi H. Extract of vinegar "Kurosu" from unpolished rice inhibits the development of colonic aberrant crypt foci induced by azoxymethane. J Exp Clin Cancer Res. 2003;22:591-597. [PubMed] |
| 23. | Menon MM, Simha MR. Telomerase and telomere length in normal and malignant human endometrium as prognostic markers. Indian J Pathol Microbiol. 2003;46:394-398. [PubMed] |
| 24. | Fang CH, Gong JQ, Zhang W. Function of oval cells in hepatocellular carcinoma in rats. World J Gastroenterol. 2004;10:2482-2487. [PubMed] [DOI] |
| 25. | Gong JQ, Fang CH, Li Y, Tian FZ. [The experimental study on the oval cells participating in hepatocarcinogenesis]. Zhonghua Wai Ke Za Zhi. 2004;42:291-295. [PubMed] |
| 26. | Menthena A, Deb N, Oertel M, Grozdanov PN, Sandhu J, Shah S, Guha C, Shafritz DA, Dabeva MD. Bone marrow progenitors are not the source of expanding oval cells in injured liver. Stem Cells. 2004;22:1049-1061. [PubMed] [DOI] |
| 27. | Masson S, Harrison DJ, Plevris JN, Newsome PN. Potential of hematopoietic stem cell therapy in hepatology: a critical review. Stem Cells. 2004;22:897-907. [PubMed] [DOI] |
| 28. | Oztürk MA, Güven GS, Haznedaroglu IC. How hematopoietic stem cells know and act in cardiac microenvironment for stem cell plasticity? Impact of local renin-angiotensin systems. Med Hypotheses. 2004;63:866-874. [PubMed] [DOI] |
| 29. | Gelderblom WC, Marasas WF, Lebepe-Mazur S, Swanevelder S, Vessey CJ, Hall Pde L. Interaction of fumonisin B(1) and aflatoxin B(1) in a short-term carcinogenesis model in rat liver. Toxicology. 2002;171:161-173. [PubMed] [DOI] |