修回日期: 2004-11-02
接受日期: 2004-11-12
在线出版日期: 2005-02-01
目的: 研究EBV相关胃癌(EBV associated gastric carcinomas, EBVaGC)和EBV阴性胃癌(EBV negative gastric carcinomas, EBVnGC)组织中c-Met基因的扩增及表达, 探讨c-Met基因扩增和表达与EBV感染的相关性以及二者在胃癌发生发展中的作用.
方法: 应用半定量多聚酶链反应(PCR)检测EBVaGC 13例和EBVnGC 45例组织中c-Met基因的扩增, 免疫组化抗原热修复技术检测c-Met蛋白表达.
结果: EBVaGC和EBVnGC组织中均检测到c-Met基因扩增, EBVaGC组织与EBVnGC组织间c-Met基因的扩增水平无显著性差异. EBVaGC癌组织c-Met基因过度扩增率为53.8%(7/13), EBVnGC癌组织c-Met基因过度扩增率为44.4%(20/45), 两组之间无差异. EBVaGC和EBVnGC癌组织中c-Met蛋白阳性率分别为76.9%(10/13)和64.4%(29/45), 两组之间无显著性差异. EBVaGC和EBVnGC癌组织中c-Met蛋白过表达率分别为69.2%(9/13)和37.8%(17/45), 统计学分析表明EBVaGC癌组织中c-Met蛋白的过表达高于EBVnGC组, 两组之间有差异(χ2 = 4.0 345, P = 0.0 446). EBVaGC和EBVnGC癌组织中c-Met基因的表达和扩增与肿瘤大小、肿瘤部位、淋巴结转移、分化程度以及临床分期等均无相关性.
结论: 胃癌组织中均存在c-Met基因的扩增, EBVaGC与EBVnGC组织中c-Met基因扩增水平和c-Met蛋白阳性率无明显差异, 但EBVaGC癌组织中c-Met蛋白的过表达率高于EBVnGC组.
引文著录: 李莉, 王云, 赵鹏, 黄葆华, 罗兵. 胃癌组织中c-Met蛋白过表达与EBV的相关性. 世界华人消化杂志 2005; 13(3): 312-316
Revised: November 2, 2004
Accepted: November 12, 2004
Published online: February 1, 2005
AIM: To detect the amplification and expression of c-Met in Epstein-Barr virus (EBV)-associated gastric carcinoma (EBVaGC) and EBV-negative gastric carcinoma (EBVnGC), and to investigate the relationshi pof the amplification and expression of c-Met with EBV infection in the process of gastric carcinogenesis.
METHODS: The amplification of c-Met gene and the expression of c-Met protein in the tissues of EBVaGC (n = 13) and EBVnGC (n = 45) were detected by semi-quantitative polymerase chain reaction (PCR) and immunohistochemical methods, respectively.
RESULTS: The amplification of c-Met was observed in both EBVaGC and EBVnGC. The overamplification rates were 53.8% (7/13) in EBVaGC and 44.4% (20/45) in EBVnGC. There was no significant difference between the two types of caners. c-Met protein was positive in 76.9% (10/13) EBVaGC, and 64.4% (29/45) EBVnGC tissues. The difference between them was not significant either. The overexpression rate of c-Met protein in EBVaGC was significantly higher than that in EBVnGC (69.2% vs 37.8%, P = 0.0 446). No significant correlation was observed between the amplification and expression of c-Met with the tumor size, location, lymph node metastasis, differentiation degree or clinical staging.
CONCLUSION: c-Met is amplified in both EBVaGC and EBVnGC tissues. The amplification level of c-Met gene and the positive rate of c-Met protein are not significantly different between EBVaGC and EBVnGC. However, the overexpression rate of c-Met protein in EBVaGC is higher than that in EBVnGC.
- Citation: Li L, Wang Y, Zhao P, Huang BH, Luo B. Relationship between Epstein-Barr virus and overexpression of c-Met protein in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 312-316
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/312.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.312
约7-10%的胃癌与EBV感染相关, 这种相关性以胃癌组织中存在EBV基因组为特征, 并常常伴有基质中的淋巴细胞浸润, 其组织学分型类似于鼻咽部上皮细胞癌. EBV感染在胃癌发生发展过程中的作用尚未阐明, EBV相关胃癌中EBV与癌基因的相互作用成为EBV致癌机制研究的热点[1-4]. c-Met原癌基因是一种具有酪氨酸酶活性的生长因子受体, 编码190 ku的跨膜糖蛋白, 具有经典的信号肽序列、细胞外位点结构、跨膜位点结构以及酪氨酸激酶位点结构. HGF/SF(肝细胞生长因子/分散因子, hepatocyte growth factor/scatter factor, HGF/SF)可以刺激c-Met基因编码蛋白的b亚单位发生快速的酪氨酸磷酸化. HGF/SF与c-Met系统所介导的信号转导系统, 不仅可作为一种有丝分裂原促进肝细胞等上皮细胞进行有丝分裂必需的正常信号转导过程, 而且还与一系列肿瘤的发生发展过程有关. 我们采用半定量聚合酶链反应(PCR)和免疫组化抗原热修复技术检测c-Met基因在EBV相关胃癌(EBV associated gastric carcinoma, EBVaGC)组织及EBV阴性胃癌(EBV negative gastric carcinoma, EBVnGC)组织中的扩增和表达, 探讨c-Met基因扩增、c-Met蛋白表达以及EBV感染在胃癌发生发展中的作用及相互关系.
2001-01/2002-12手术切除的新鲜胃癌组织185例, PBS-40 g/L甲醛固定后石蜡包埋, 用以制备组织切片进行病理学分析、原位杂交和免疫组化检测. 另取新鲜组织, 用酚-氯仿-异戊醇法常规提取组织DNA, 4 ℃保存备用. 全部病例均经病理诊断证实. PCR-Southern技术检测胃癌组织中EBV DNA, 然后采用原位杂交技术检测PCR阳性胃癌组织石蜡切片中EBV编码小RNA(EBER1)的表达, EBER1阳性者确定为EBV相关胃癌[5]. PCR-Southern结合原位杂交(ISH)技术共确证EBVaGC 13例, 将13例EBVaGCs作为EBV阳性组, 选择临床指标和组织类型与之匹配的45例EBVnGCs作为EBV阴性组进行c-Met基因扩增和c-Met蛋白表达的检测. 统计学分析表明, EBVaGC组和EBVnGC组病例在年龄、性别、肿瘤部位、组织学类型、分化程度、有无淋巴结转移以及临床分期等方面均无显著性差异.
1.2.1 半定量PCR检测c-Met基因的扩增: 引物设计与合成参照文献[6]设计扩增c-Met基因和内参照GAPDH基因的特异性引物, 由上海生工生物工程技术服务有限公司合成, 引物序列和PCR产物长度: c-Met: 5'primer; TTC ACC GCG GAA ACA CCC ATC, 3'primer; GTC TTC CAG CAC AGG CCC AGT, 141 bp; GAPDH: 5'primer; CTC AGA CAC CAT GGG GAA GGT GA, 3'primer; ATG ATC TTG AGG CTG TTG TCA TA, 450 bp. PCR反应体系为30 mL, 包括10×buffe 3 mL, MgCl2终浓度1.5 mmol/L, 4×dNTP终浓度为0.2 mmol/L, Taq DNA聚合酶1U, 目的基因引物和内参照基因引物浓度均为0.4 mmol/L, 模板DNA 2.0 mL, 无菌去离子水补充至30 mL. 扩增参数为94 ℃预变性5 min; 然后94 ℃变性45 s, 58 ℃复性45 s, 72 ℃延伸1 min, 共35个循环; 最后72 ℃延伸5 min. 取PCR扩增产物10 mL于含EtBr(0.5 mg/L)的20 g/L琼脂糖凝胶中电泳, 80 V, 1 h, 紫外透射仪下观察电泳结果并照相记录. 在光密度扫描仪下扫描照片, 计算曲线下峰面积作为PCR产物的相对含量. 每份标本均观察到内参照基因GAPDH和目的基因c-Met的特异性扩增条带, 用c-Met峰面积与GAPDH峰面积的比值表示c-Met基因的相对扩增水平, 若该比值大于或等于全部肿瘤标本该比值的平均值则视为c-Met基因的过度扩增.
1.2.2 免疫组化检测c-Met蛋白的表达: 石蜡切片常规脱蜡至水, 30 mL/L过氧化氢消除内源性过氧化物酶活性, 0.01 mol/L柠檬酸盐缓冲液微波修复抗原8 min2次, PBS冲洗后滴加1:200稀释的兔抗人c-Met多克隆抗体(Santa Cruz Biotechnology, Inc, USA.)4 ℃过夜. 过氧化物酶标记的链霉卵白素(SP)染色后常规DAB溶液显色, 苏木素复染, 封片后观察结果. PBS代替一抗设为阴性对照, 已知c-Met阳性的乳腺癌组织标本作为阳性对照. c-Met免疫组化染色阳性信号以细胞膜(主要是腺腔面)出现棕黄色着色为特征, 可同时伴有胞质的棕黄色颗粒. 参照文献[7]确定c-Met蛋白表达判断标准, 根据染色深浅可分为强阳性、中等强度阳性、弱阳性和阴性结果. 若同一切片阳性细胞数>30%同类病变细胞则视为阳性病例, 以强阳性和中等强度阳性为c-Met过表达.
统计学处理 c-Met基因扩增的半定量PCR检测结果采用两组计量资料的t检验, 过度扩增采用四格表χ2检验, 免疫组化结果采用四格表χ2检验进行统计学分析, P<0.05表示有显著性差异.
部分EBVaGC组织中c-Met基因扩增电泳结果(图1), 扫描凝胶电泳照片中c-Met基因与GAPDH基因扩增条带的吸光度值, 并计算每例标本二者的吸光度比值(表1). 应用计量资料的t检验对13例EBVaGCs组织和45例EBVnGCs组织中c-Met基因的扩增水平进行统计分析, 结果显示EBVaGC和 EBVnGC 癌组织中c-Met基因的扩增水平无显著性差异(t= 0.1 359 t0.05(56) = 2.000 P>0.05). 有7例EBVaGCs癌组织c-Met基因过度扩增, 占53.8%(7/13); 20例EBVnGCs癌组织c-Met基因过度扩增, 为44.4%(20/45). 统计学分析表明c-Met基因的过度扩增在EBVaGC和EBVnGC两组之间无显著差异(χ2 = 0.3583, P =0.5 494).
| 标本号 | 吸光度比值(c-Met/GAPDH) | 标本号 | 吸光度比值(c-Met/GAPDH) |
| GA21 | 1.32 | GA46 | 0.72 |
| GA371 | 1.08 | GA50 | 1.07 |
| GA531 | 1.16 | GA54 | 0.86 |
| GA781 | 0.72 | GA56 | 0.76 |
| GA791 | 1.26 | GA58 | 0.83 |
| GA931 | 1.02 | GA59 | 0.51 |
| Y13A1 | 0.79 | GA60 | 0.84 |
| Y20A1 | 0.88 | GA61 | 0.78 |
| Y28A1 | 1.03 | GA64 | 0.89 |
| Y32A1 | 0.70 | GA66 | 0.96 |
| 13133A1 | 0.68 | GA71 | 0.92 |
| 12284A1 | 0.72 | GA72 | 0.90 |
| 13139A1 | 0.74 | GA81 | 1.06 |
| GA3 | 1.02 | GA94 | 0.77 |
| GA4 | 0.96 | GA95 | 0.56 |
| GA5 | 0.78 | GA103 | 1.04 |
| GA6 | 1.23 | Y1A | 0.64 |
| GA7 | 0.83 | Y2A | 0.53 |
| GA8 | 0.88 | Y8A | 0.70 |
| GA9 | 1.06 | Y9A | 0.98 |
| GA17 | 1.14 | Y11A | 0.64 |
| GA19 | 0.50 | Y12A | 0.73 |
| GA20 | 0.72 | Y15A | 0.84 |
| GA21 | 0.65 | Y17A | 0.92 |
| GA23 | 0.92 | Y19A | 0.62 |
| GA33 | 0.56 | Y22A | 0.87 |
| GA38 | 1.18 | Y23A | 1.18 |
| GA42 | 0.83 | Y26A | 0.59 |
| GA45 | 0.79 | Y29A | 1.21 |
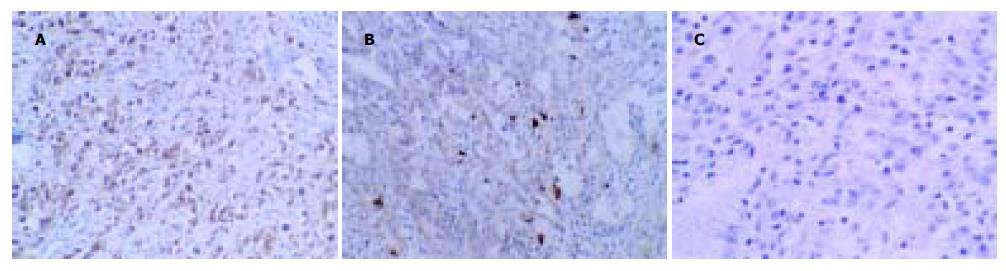
免疫组化检测c-Met蛋白阳性信号定位于细胞膜或胞质(图2A-C), 根据阳性细胞的数量和阳性细胞染色强度确定c-Met蛋白的表达水平. EBVaGC癌组织c-Met蛋白阳性率为76.9%(10/13); EBVnGC癌组织c-Met蛋白阳性率为64.4%(29/45), 统计学分析表明c-Met蛋白的表达率在EBVaGC和EBVnGC两组之间无差异(χ2 = 0.2 590, P = 0.6 108). EBVaGC癌组织中c-Met蛋白过表达率为69.2%(9/13); EBVnGC癌组织中c-Met蛋白过表达率为37.8%(17/45). 统计学分析表明EBVaGC癌组织中c-Met蛋白的过表达高于EBVnGC组, 两组之间有差异(χ2 = 4.0345, P = 0.0446).
我们分别对13例EBVaGCs和45例EBVnGCs组织中c-Met基因扩增和c-Met蛋白表达与患者临床病理资料的相关性进行分析, 统计结果分析表明EBVaGC及EBVnGC组织中c-Met基因的扩增和c-Met蛋白表达与肿瘤大小、肿瘤部位、分化程度、淋巴结转移以及浸润程度之间均无显著性差异(表2).
| n | EBVaGC(n = 13) | EBVnGC(n = 45) | P值 | |
| 平均年龄(年) | 58 | 59.76±10.17 | 57.31±14.05 | P = 0.5 622(t = 0.5 844) |
| 性别 | P = 0.1 563(χ2c = 2.1 070) | |||
| 男 | 13 | 35 | ||
| 女 | 0 | 10 | ||
| 平均直径(mm) | 58 | P = 0.6 688(χ2c = 0.1 959) | ||
| ≥5 cm | 9 | 36 | ||
| <5 cm | 4 | 9 | ||
| 肿瘤部位 | 58 | P = 0.1 610(χ2c = 2.0 566) | ||
| 贲门、胃体和残胃 | 9 | 21 | ||
| 胃窦 | 4 | 24 | ||
| 组织类型 | 58 | P = 0.6 784(χ2c = 0.1 811) | ||
| 腺癌 | 12 | 41 | ||
| 印戒细胞癌 | 1 | 4 | ||
| 分化程度 | 58 | P = 0.7 912(χ2c = 0.0 716) | ||
| 中分化 | 1 | 7 | ||
| 低分化 | 11 | 38 | ||
| 淋巴结转移 | 58 | P = 1.0 000(χ2c = 0.0 098) | ||
| 有 | 10 | 33 | ||
| 无 | 3 | 12 | ||
| 临床分期 | 58 | P = 1.0 000(确切概率法) | ||
| 早期(黏膜及黏膜下层) | 0 | 1 | ||
| 晚期(透过黏膜下层) | 13 | 44 |
肿瘤组织中有关EBV感染与c-Met基因扩增和c-Met蛋白表达的研究报道较少, 主要见于何杰金病(HD)等淋巴系统恶性增生性疾病. Weimar et al[8]研究证实EBV感染可诱发c-Met阴性的正常外周血B淋巴细胞c-Met基因的表达, 而在EBV感染正常B细胞诱导建立的B细胞系, c-Met基因的表达至少可持续3 mo. HD患者淋巴结组织切片免疫组化检测结果显示: c-Met原癌基因表达与EBV感染密切相关, 8例EBV阳性的HD患者标本中有6例检测到c-Met原癌基因的表达, 而10例EBV阴性HD患者淋巴结组织切片中均未检测到c-Met基因的表达. Teofili et al[9]的研究结果则与之相反, 他们对来自HD患者的45例淋巴结和12份骨髓活检标本中c-Met, EBER1和LMP1的表达进行检测, 结果表明EBV阳性和EBV阴性HD标本中c-Met蛋白的免疫反应性没有差异, 即HD淋巴结组织中c-Met表达不依赖于EBV感染. 本研究结果显示EBVaGC和EBVnGC癌组织中c-Met基因扩增水平和c-Met蛋白表达没有差异, 但在EBVaGC的癌组织中c-Met蛋白的过表达要高于EBVnGC组, 提示EBV感染可能诱发胃癌组织中c-Met蛋白的过表达. Kijima et al[6]将393例行胃切除术的胃癌分为EBVaGC 组和EBVnGC组, 采用竞争性PCR和免疫组化技术检测c-Met基因在EBVaGC和EBVnGC组织中的扩增与过表达. 分析结果显示EBVaGC组织中c-Met基因的扩增和过表达只与肿瘤的深度浸润有关(P<0.05), 而与肿瘤部位、是否淋巴结转移、淋巴浸润和静脉浸润无关. EBV阴性胃癌c-Met基因的扩增和过表达表达则与肿瘤部位、深度浸润、淋巴结转移、淋巴浸润和静脉浸润均有相关性(P均<0.05), 表明c-Met基因在EBVaGC和EBVnGC中对肿瘤的发展与转移起着不同的作用, 目前还不清楚c-Met基因这种不同作用是否提示EBV相关胃癌预后较好. 本研究结果表明EBVaGC及EBVnGC组织中c-Met基因的扩增和表达与肿瘤的大小、肿瘤部位、分化程度、淋巴结转移及浸润程度之间均无明显相关性, 与Kijima et al[6]的研究结果不完全一致, 分析认为与取材时肿瘤处于不同的临床分期有关, 在本次研究中大多数患者属癌症的晚期(57/58), 推测EBV感染在胃癌的早期和晚期发挥不同的作用.
EBV潜伏感染和细胞转化能力被广泛认为是其致癌的基础, 目前已知引起细胞转化的基因主要有潜伏性基因中的核抗原家族基因(EBNAs, 包括EBNA1, EBNA2, EBNA3, EBNA4和EBNA6)和潜伏膜蛋白基因LMP1. 目前上皮性恶性肿瘤细胞中c-Met基因表达与EBV感染的相关性研究报道尚少, 近年来对鼻咽癌(nasopharyngeal carcinoma, NPC)的研究发现, c-Met原癌基因产物作为肝细胞生长因子/分散因子(HGF/SF)的一种高亲和力受体, 可以促进多种细胞运动和侵袭能力, 其表达与NPC患者颈部淋巴结转移密切相关[10]. LMP1是EBV编码的一种癌蛋白, 在大约50-70%的鼻咽癌标本中可检测到. 在鼻咽癌的发生发展过程中LMP1起重要作用[11]. Horikawa et al[10]的研究发现LMP1可通过活化Ets-1转录因子诱导c-Met基因的表达, 从而与NPC的高转移特性有关. 本研究中c-Met蛋白过表达与EBV感染相关, 但大多数的研究表明EBVaGCs标本中潜伏期基因LMP1表达缺失[5,12-13]. 由于EBV感染与胃癌相关性的研究起步较晚, EBVaGC组织中病毒基因的表达规律尚未完全明确, 因此EBV的何种基因诱导胃癌组织c-Met蛋白过表达有待于进一步研究.
编辑: 潘伯荣 审读:张海宁
| 3. | Ishii H, Gobe G, Kawakubo Y, Sato Y, Ebihara Y. Interrelationship between Epstein-Barr virus infection in gastriccarcinomas and the expression of apoptosis-associated proteins. Histopathology. 2001;38:111-119. [PubMed] [DOI] |
| 4. | Kume T, Oshima K, Shinohara T, Takeo H, Yamashita Y, Shirakusa T, Kikuchi M. Low rate of apoptosis andoverexpression of bcl-2 in Epstein-Barr virus-associated gastric carcinoma. Histopathology. 1999;34:502-509. [PubMed] [DOI] |
| 6. | Kijima Y, Hokita S, Yoshinaka H, Itoh T, Koriyama C, Eizuru Y, Akiba S, Aikou T. Amplification and overexpression ofc-met gene in Epstein-Barr virus-associated gastric carcinomas. Oncology. 2002;62:60-65. [PubMed] [DOI] |
| 7. | Humphrey PA, Zhu X, Zarnegar R, Swanson PE, Ratliff TL, Vollmer RT, Day ML. Hepatocyte growth factor and itsreceptor (c-MET) in prostatic carcinoma. Am J Pathol. 1995;147:386-396. [PubMed] |
| 8. | Weimar IS, de Jong D, Muller EJ, Nakamura T, van Gorp JM, de Gast GC, Gerritsen WR. Hepatocyte growthfactor/scatter factor promotes adhesion of lymphoma cells to extracellular matrix molecules via alpha 4 beta 1 andalpha 5 beta 1 integrins. Blood. 1997;89:990-1000. [PubMed] |
| 9. | Teofili L, Di Febo AL, Pierconti F, Maggiano N, Bendandi M, Rutella S, Cingolani A, Di Renzo N, Musto P, Pileri S. Expression of the c-met proto-oncogene and its ligand, hepatocyte growth factor, in Hodgkindisease. Blood. 2001;97:1063-1069. [PubMed] [DOI] |
| 10. | Horikawa T, Sheen TS, Takeshita H, Sato H, Furukawa M, Yoshizaki T. Induction of c-Met proto-oncogene byEpstein-Barr virus latent membrane protein-1 and the correlation with cervical lymph node metastasis ofnasopharyngeal carcinoma. Am J Pathol. 2001;159:27-33. [PubMed] [DOI] |
| 11. | Yoshizaki T. Promotion of metastasis in nasopharyngeal carcinoma by Epstein-Barr virus latent membraneprotein-1. Histol Histopathol. 2002;17:845-850. [PubMed] |
| 12. | zur Hausen A, Brink AA, Craanen ME, Middeldorp JM, Meijer CJ, van den Brule AJ. Unique transcription pattern ofEpstein-Barr virus (EBV) in EBV-carrying gastric adenocarcinomas: expression of the transforming BARF1 gene. Cancer Res. 2000;60:2745-2748. [PubMed] |
| 13. | Hoshikawa Y, Satoh Y, Murakami M, Maeta M, Kaibara N, Ito H, Kurata T, Sairenji T. Evidence of lytic infectionof Epstein-Barr virus (EBV) in EBV-positive gastric carcinoma. J Med Virol. 2002;66:351-359. [PubMed] [DOI] |