修回日期: 2005-10-01
接受日期: 2005-10-11
在线出版日期: 2005-12-28
目的: 建立一种以丙型肝炎病毒(HCV)干扰素敏感决定区(ISDR)特异性引物为基础的聚合酶链反应(PCR)方法, 对HCV ISDR进行序列测定.
方法: 根据GenBank中6株HCV全序列核苷酸序列, 设计共同的外引物及三组ISDR型特异性内引物. 建立了HCV ISDR PCR检测方法, 对27例HCV基因型1b的慢性丙型肝炎患者血清HCV RNA进行测定, 并对PCR阳性标本的产物进行多位点分析.
结果: A组PCR结果阳性率为37%(10/27), A-B组为30%(8/27), A-C组为4%(1/27), A-B-C组为22%(6/27), 三组均阳性者有5例为使用IFN治疗6-12 mo后定性PCR检测HCV RNA转阴, 停药3 mo后PCR检测HCV RNA结果仍为阴性.
结论: 以ISDR特异性引物为基础的PCR法可靠、简便, 可用于丙型病毒性肝炎患者对HCV进行敏感决定区的测定, 用于以NS5A-ISDR突变数量来预测HCV基因型1b感染的患者对IFN的持续应答.
引文著录: 张剑平, 徐道振, 闫杰, 何忠平, 董庆鸣, 戴旺苏, 沈冰, 魏红山, 成军. 丙型肝炎病毒干扰素敏感决定区聚合酶链反应检测方法的建立及应用. 世界华人消化杂志 2005; 13(24): 2874-2876
Revised: October 1, 2005
Accepted: October 11, 2005
Published online: December 28, 2005
AIM: To establish a polymerase chain reaction (PCR) method based on the special primers of the interferon sensitivity determining region (ISDR) of hepatitis C virus (HCV), and to detect the sequence of the HCV ISDR.
METHODS: The universal outer primers and 3 suits of ISDR type-specific inner primers (A, B, C group) were designed on the basis of the nucleotide sequences of 6 typical full-genomic HCV. The HCV RNA in the serum that colleted from 27 patients infected with chronic HCV genotype 1b was tested by the established PCR method, and multi-site analysis was performed on the PCR positive products.
RESULTS: The positive rats were 37% (10/27), 30% (8/27), 4% (1/27), and 22% (6/27) in group A, group A-B, group A-C, and group A-B-C after detection by the established PCR method. For the 6 HCV RNA positive patients, HCV RNA became negative when they were treated with IFN for 6 to 12 mo, and HCV RNA was still negative in those patients 3 mo after the treatment.
CONCLUSION: The PCR method based on the ISDR of HCV is simple and reliable, and can be used in the detection of HCV ISDR in patients with hepatitis C and in the prediction of the persistent response to the IFN in HCV genotype 1b infected patients by the number of mutations within the ISDR.
- Citation: Zhang JP, Xu DZ, Yan J, He ZP, Dong QM, Dai WS, Shen B, Wei HS, Cheng J. Establishment and application of polymerase chain reaction method for detection of interferon sensitivity determining region of hepatitis C virus. Shijie Huaren Xiaohua Zazhi 2005; 13(24): 2874-2876
- URL: https://www.wjgnet.com/1009-3079/full/v13/i24/2874.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i24.2874
理论上讲, 抗病毒治疗最理想的结果是把丙型肝炎病毒(hepatitis C virus, HCV)从体内清除, 临床最理想的治疗结果通常是指达到持久的病毒学应答(sustained virological response, SVR). 迄今为止, 国际上公认有效的主要的抗HCV药物仍是干扰素(interferon, IFN). 目前研究发现, 治疗前的高病毒含量、基因型1b、肝细胞铁蓄积增高、高变区氨基酸的高度替换以及进展性组织学改变是预测IFN治疗应答率低的重要因素[1], 日本名古屋大学医学院的I.Nakano博士及其同事对HCV患者采用了单一干扰素治疗, 发现在不同基因型的HCV感染者中基因型1b的患者对干扰素治疗产生应答最低[2]. 据统计我国HCV感染者中基因型1b高达91.1%, 基因型2a占6.2%, 混合型只占2.7%[3]. 1996年以来国外一些学者[4]发现HCV的核心区、非结构区、NS5A区出现基因变异者, 与其对干扰素治疗的敏感程度有很重要的关系. Poliak et al认为对干扰素治疗无应答取决于变异株间的差异程度, 这也可能是预测IFN应答的另一重要因素[5]. 我们实验旨在建立一种简便、科学的方法, 即以基因型1b特异引物的聚合酶链反应(polymerase chain reaction, PCR)方法, 测定HCV NS5A基因区干扰素敏感性决定区(interferon sensitivity determining region, ISDR), 并用此方法对接受IFN治疗的慢性丙型肝炎患者的ISDR进行分析, 并希望在丙型病毒性肝炎的临床治疗监测中能够预测IFN治疗的临床效果.
1.1.1 HCV基因序列数据分析: 选择GenBank中已发表的6株HCV, 应用Vector NTI suite 7软件和Tree View软件分别对全基因序列及NS5A区序列进行同源性比较和分子进化关系分析, 选择最佳的基因型1b特异性引物.
1.1.2 引物设计: 根据HCV基因序列比较结果和Enomoto et al[6]的研究, 设计了共同的外引物P1、P2及三组基因型1b特异性内引物P3、P4、P5、P6、P7(表1).
| 引物 | 序列 |
| 第一轮PCR | |
| P1 | 5'-TGGATGGACTGCGGTTGCACAGGTA-3' |
| P2 | 5'-TCTTTCTCCGTGGAGGTGGTATTGG-3' |
| 第二轮PCR | |
| A组 | |
| P3 | 5'-CAGGTTCGCTCCGGCGTGCA-3' |
| P4 | 5'-GGGGCCTTGCTAGGTGGCAA-3' |
| B组 | |
| P5 | 5'-TTGAAGGCGACATGTACTACCCAT-3' |
| P6 | 5'-TTCTGACTCCACACGGGTGATGTT-3' |
| C组 | |
| P6 | 5'-TTCTGACTCCACACGGGTGATGTT-3' |
| P7 | 5'-ACCCTTCATGACTCCCCGGACGCC-3' |
1.1.3 血清标本: 血清标本采自北京地坛医院住院的27例慢性丙型肝炎患者, 其定性PCR检测HCV RNA均为阳性, 基因型均为1b, 并采用单一干扰素治疗. 诊断标准按2000年第十次全国病毒性肝炎及肝病学术会议修订的"病毒性肝炎防治方案"[7].
1.1.4 分组: A组为采用引物P3、P4特异性引物进行的PCR实验, B组为采用引物P5、P6特异性引物进行的PCR实验, C组为采用引物P6、P7特异性引物进行的PCR实验. A-B-C为三点变异组, A-B为两点变异组, A-C也为两点变异组.
1.2.1 核酸提取: 采用异硫氰酸胍-酚氯仿法[8].
1.2.2 PCR反应条件: 逆转录: 取核酸10 μL, Rnase 10 μL, dNTPs各200 μmol, 引物P2为1 μmol, Buffer 1.5 μL(10×), AMV 4 μL, 补H2O至15 μL反应体系, 反应条件: 42℃ 2 400 s, 95℃ 300 s. 第一轮扩增: 取模板15 μL, dNTPs各100 μmol, 引物P1、P2各1 μmol, Buffer 3 μL (10×), Taq DNA聚合酶1.5 μL, MgCl2 1.25 mmol, 补H2O至30 μL反应体积, 反应条件: 94℃预变性180 s, 94℃ 45 s, 50℃ 45 s, 72℃ 50 s, 扩增35个循环, 72℃延伸600 s. 第二轮A组扩增: 取第一次PCR产物3 μL作模板, dNTPs各100 μmol, 引物P3、P4各1 μmol, Taq DNA聚合酶, Buffer 3 μL(10×), MgCl2 1.25 mmol, 补H2O至30 μL反应体积, 循环条件为: 94℃预变性180 s, 94℃ 45 s, 55℃ 45 s, 72℃ 50 s, 扩增35个循环, 72℃延伸600 s. B组扩增: 取第一次PCR产物3 μL作模板, dNTPs各100 μmol, 引物P5、P6各1 μmol, Taq DNA聚合酶, Buffer 3 μL(10×), MgCl2 1.25 mmol, 补H2O至30 μL反应体积, 循环条件为: 94℃预变性180 s, 94℃ 30 s, 60℃ 30 s, 72℃ 30 s, 扩增35个循环, 72℃延伸600 s. C组扩增: 取第一次PCR产物3 μL 作模板, dNTPs各100 μmol, 引物P6、P7各1 μmol, Taq DNA聚合酶, Buffer 3 μL(10×), MgCl2 1.25 mmol, 补H2O至30 μL反应体积, 循环条件为: 94℃预变性180 s, 94℃ 30 s, 60℃ 30 s, 72℃ 30 s, 扩增35个循环, 72℃延伸600 s. 每次PCR均设阳性和阴性对照.
1.2.3 电泳: 取第二次PCR产物8 μL在8%的聚丙烯酰胺凝胶上电泳, EB染色, 紫外灯下观察结果.
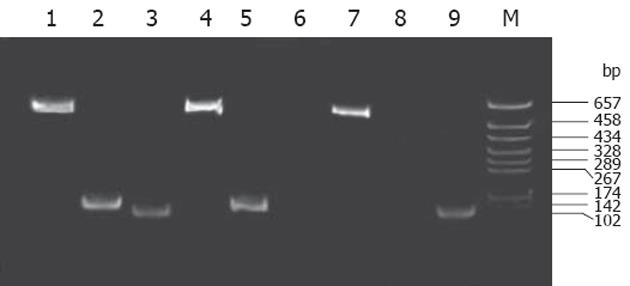
27例慢性丙型肝炎患者HCV基因ISDR测定结果: 27例慢性丙型肝炎患者HCV基因分型均为1b, A组PCR结果阳性占37%(10/27), 其中A-B组PCR结果阳性占30%(8/27), A-C组PCR结果阳性占4%(1/27), A-B-C三组PCR结果均为阳性占22%(6/27), 三组均阳性者中有5例在使用IFN治疗6-12 mo后定性PCR检测HCV RNA转阴(图1). 停药后3 mo后PCR检测HCV RNA结果仍为阴性. 三组扩增片段分别为: A组572 bp, B组126 bp, C组96 bp.
NS5A蛋白在HCV多蛋白的成熟和RNA的复制过程中具有十分重要的作用[9-12], HCV NS5A是病毒编码的一种功能广泛的非结构蛋白质, 他具有多种生物学功能, 并参与许多重要的调节过程. HCV NS5A位于HCV多蛋白的羧基末端2 209-2 248 aa, NS5A能够与肝细胞中的IFNα刺激蛋白-双链RNA依赖的蛋白激酶(PKR)相互作用, 抑制PKR的功能, 从而下调IFNα刺激的抗病毒效应[13]. 日本学者Enomoto et al[6,13]最早提出位于NS5A蛋白中央包括一段干扰素敏感决定区(ISDR), 该区被认为是介导NS5A与IFNα诱导的双链RNA依赖的蛋白激酶(PKR)结合的部位, 与干扰素α治疗的敏感性相关[14,15]; 同时NS5A显示出诱导CXC趋化因子、白介素-18(IL-18), 可抵消IFNα抗病毒效应[16,17]. 丙型肝炎病毒(HCV)NS5A蛋白的干扰素敏感性决定区(ISDR)是由HCV基因型1b感染患者的干扰素持续病毒反应所决定的问题尚有争议.
我国对此项研究尚未见报道. 我们将NS5A 2 209-2 248区定为基因易变异区, 选择三个突变点设计HCV基因型特异引物, 利用PCR技术, 并建立了HCV ISDR测定方法, 对HCV基因变异与临床表现和转归关系进行研究比较, 其结果显示27例慢性丙型肝炎患者HCV基因ISDR: A组阳性占37%(10/27), HCV基因分型均为1b, 其中A-B组阳性占30%(8/27), A-C组阳性占4%(1/27), A-B-C组阳性占22%(6/27), 三组均阳性者有5例为使用IFN治疗6-12 mo后定性PCR检测HCV-RNA转阴, 并在停药后3 mo后PCR检测HCV-RNA结果仍为阴性. 这说明HCV感染者的NS5A ISDR区出现基因变异者, 确与患者对干扰素的敏感程度有一定的关系, A-B-C三组PCR结果阳性即三点出现变异者对IFN更敏感. 这一实验结果显示, 测定HCV NS5A基因区干扰素敏感性决定区的基因突变, 可能会成为预测HCV基因型1b感染的患者对干扰素的持续应答的一个重要指标. 目前IFN虽然是唯一有效治疗慢性丙型病毒性肝炎的药物, 但IFN治疗费用昂贵, 对部分患者有较大的副作用, 据统计HCV感染者对IFN治疗的完全应答率只有10-30%. 选择适当的病例进行IFN治疗, 更是尤为重要的问题.
因此, 在慢性丙型病毒性肝炎的治疗中, 如能利用本研究的PCR技术测定HCV对干扰素敏感区域的变异情况, 预测IFN对慢性丙肝的治疗效果, 比较准确的判断是否应使用干扰素治疗, 以减少患者的经济负担, 提高治疗的有效率, 这在临床治疗中有着不可估量的应用价值. 本实验结果稳定, 操作较简便, 费用较低, 适用于临床丙型病毒性肝炎治疗的预测和治疗过程的常规监测工作.
电编: 张敏 编辑: 菅鑫妍 审读: 张海宁
| 1. | Davis GL. Prediction of response to interferon treatment of chronic hepatitis C. J Hepatol. 1994;21:1-3. [PubMed] [DOI] |
| 2. | Nakano I, Fukuda Y, Katano Y, Nakano S, Kumada T, Hayak-awa T. Why is the interferon sensitivity-determining region (ISDR) system useful in Japan? J Hepatol. 1999;30:1014-1022. [PubMed] [DOI] |
| 3. | 樊 文梅, 朱 万孚, 张 世勇, 王 齐欣, 尹 利民, 万 华, 高 燕, 田 秀兰, 于 敏, 金 剑. 河北省赵县某农村单采血浆还输血细胞献血员丙型肝炎病毒感染的追踪调查. 中华医学杂志. 2004;84:392-396. |
| 4. | Enomoto N, Sakuma I, Asahina Y, Kurosaki M, Murakami T, Yamamoto C, Izumi N, Marumo F, Sato C. Comparison of full-length sequences of interferon-sensitive and resistant hepatitis C virus 1b. Sensitivity to interferon is conferred by amino acid substitutions in the NS5A region. J Clin Invest. 1995;96:224-230. [PubMed] [DOI] |
| 5. | Polyak SJ, Paschal DM, McArdle S, Gale MJ Jr, Moradpour D, Gretch DR. Characterization of the effects of hepatitis C virus nonstructural 5A protein expression in human cell lines and on interferon-sensitive virus replication. Hepatology. 1999;29:1262-1271. [PubMed] [DOI] |
| 6. | Enomoto N, Sakuma I, Asahina Y, Kurosaki M, Murakami T, Yamamoto C, Ogura Y, Izumi N, Marumo F, Sato C. Mutations in the nonstructural protein 5A gene and response to interferon in patients with chronic hepatitis C virus 1b infection. N Engl J Med. 1996;334:77-81. [PubMed] [DOI] |
| 8. | Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem. 1987;162:156-159. [PubMed] [DOI] |
| 9. | 钟 彦伟, 成 军, 施 双双, 杨 继珍, 董 菁, 夏 小兵, 李 克, 刘 妍, 陈 菊梅. 丙型肝炎病毒非结构蛋白NS5A人源单链抗体的筛选与表达. 中华中西医杂志. 2001;2:97-99. |
| 10. | 成 军. 丙型肝炎病毒NS5A蛋白的生物学调节作用. 国外医学·微生物学分册. 2001;24:12-14. |
| 11. | 成 军, 钟 彦伟, 施 双双, 刘 妍, 王 刚, 董 菁, 夏 小兵, 陈 菊梅. HCV非结构蛋白NS5A人源单链可变区抗体基因的筛选与鉴定. 中华实验和临床病毒学杂志. 2001;15:216-218. |
| 12. | 成 军, 陈 菊梅. 丙型肝炎病毒5'-非翻译区及其结合蛋白的研究进展. 国外医学·微生物学分册. 2001;24:7-9. |
| 13. | Gale M Jr, Blakely CM, Kwieciszewski B, Tan SL, Dossett M, Tang NM, Korth MJ, Polyak SJ, Gretch DR, Katze MG. Control of PKR protein kinase by hepatitis C virus nonstructural 5A protein: molecular mechanisms of kinase regulation. Mol Cell Biol. 1998;18:5208-5218. [PubMed] [DOI] |
| 14. | 成 军, 杨 守纯. 现代肝炎病毒分子生物学. 北京: 人民军医出版社 1997; . |
| 15. | Sato C. Effects of hepatitis C virus proteins on the interferon-stimulated signal transduction. Nippon Rinsho. 2001;59:1271-1276. [PubMed] |