修回日期: 2005-09-25
接受日期: 2005-09-30
在线出版日期: 2005-12-28
目的: 探讨氧应激和脂质过氧化在高脂饮食所致脂肪性肝炎形成中的作用, 复方中药防治非乙醇性脂肪性肝炎的作用机制.
方法: 雄性SD大鼠 60只随机分组为6组, 每组10只. 正常组普通饲料喂养; 模型Ⅰ组、Ⅱ组喂高脂饲料; 中药治疗Ⅰ、Ⅱ组分别在喂饲高脂饲料9 wk、13 wk予复方中药灌胃; 饮食治疗组在喂饲高脂饲料13wk后改为普通饲料喂养. 12 wk末处死正常组、模型Ⅰ组、中药治疗Ⅰ组大鼠; 剩余3组大鼠继续喂养至16 wk末处死, 测定血清转氨酶 (ALT、AST), 全血谷胱甘肽过氧化物酶 (GSH-PX), 肝匀浆丙二醛 (MDA) 含量, 超氧化物歧化酶 (SOD) 活性, 总抗氧化能力 (T-AOC), 一氧化氮 (NO), 诱导型一氧化氮合酶 (iNOS), 谷胱甘肽 (GSH) 水平, 观察肝组织学改变.
结果: 模型组大鼠12 wk出现单纯性脂肪肝, 16 wk发展为脂肪性肝炎. 与正常组比, 模型组大鼠肝组织脂质过氧化产物MDA含量明显增多 (6.45±1.07, 8.38±1.32 µmol/g vs 5.08±0.91 µmol/g, P<0.01), 而抗氧化物SOD (171±14, 148±26 kNU/gt vs 198±25 kNU/gt, P<0.05 和 P<0.01), GSH(40.8±5.1, 35.0±9.0 mg/g vs 48.5±7.6 mg/g, P <0.05 和 P <0.01), GSH-PX(11.2±1.5, 10.3±1.8 µmol/L vs 16.4±3.7 µmol/L, P<0.01) 含量明显降低, 且肝脏的脂肪变性严重程度随着高脂饮食喂养的时间延长而加剧. 中药治疗组各项指标较模型组有明显改善 (P<0.05 或 P<0.01), 脂肪变性程度明显减轻. 而饮食治疗组大鼠肝脏病理学仍呈轻-中度脂肪变性, 各项指标与模型组比无显著差异.
结论: 氧应激和脂质过氧化在NASH形成中发挥重要作用, 复方中药通过抗脂质过氧化等作用来治疗大鼠NASH.
引文著录: 于洪波, 戴林, 彭海英, 牟新春, 左中. 复方中药对大鼠高脂饮食所致脂肪性肝炎肝组织氧化和抗氧化系统的影响. 世界华人消化杂志 2005; 13(24): 2842-2847
Revised: September 25, 2005
Accepted: September 30, 2005
Published online: December 28, 2005
AIM: To explore the action of oxygen stress and lipid peroxidation in the establishment of steatohepatitis and the action mechanisms of compound from Chinese medicine (CCM) in the treatment of steatohepatitis in rats fed by high-fat diets.
METHODS: Sixty male Sprague Dawley rats were randomly assigned into 6 groups. The rats fed by normal food served as the controls. The rats in model groups (Ⅰ, Ⅱ) were fed with high-fat diets, and those in medication Ⅰ and Ⅱ group were given CCM 9 and 13 wk after high-fat diets feeding. The rats in diet therapeutic group were fed with normal food 13 wk after high-fat diet feeding. The animal in control, model Ⅰ, and medication Ⅰ group were killed at 12 wk, and the rest ones were killed at 16 wk. Blood sample were collected for the detection of serum aspartate transaminase (AST), alanine aminotransferase (ALT), and glutathione perioxidase (GSH-PX), and liver tissues were obtained for the detection of malondialdehyde (MDA) contents, superoxide dismutase (SOD) activity, total antioxidative capacity (T-AOC), nitric exide (NO), inducible nitric oxide synthase (iNOS) and glutathione (GSH) levels. The histological changes were observed under light microscope.
RESULTS: Pure fatty liver was formed in the model rats at 12, and fatty hepatitis was established at 16 wk. In comparison with those of normal rats, the contents of MDA were increased (6.45±1.07, 8.38±1.32 µmol/g vs 5.08±0.91 µmol/g, P <0.01) but anti-oxide SOD (171±14, 148±26 kNU/gt vs 198±25 kNU/gt, P <0.05 and P <0.01), GSH (40.8±5.1, 35.0±9.0 mg/g vs 48.5±7.6 mg/g, P <0.05 and P <0.01), GSH-PX (11.2±1.5, 10.3±1.8 µmol/L vs 16.4±3.7 µmol/L, P <0.01) contents were decreased significantly. The severity degree of hepatic fatty degeneration aggravated with the prolonging of the high-fat diet given time. In comparison with those of model rats, the markers such as MDA, SOD, GSH, and GSH-PX etc. were all significantly improved in the medication rats (P <0.05 or P <0.01), and the degree of fatty degeneration was also alleviated. Light or moderate fatty degeneration was observed in diet therapeutic rats, and the relative markers were not notably different from those of model group.
CONCLUSION: Oxygen stress and lipid peroxidation play a key role in the establishment of nonalcoholic steatohepatitis in rats, and the compound of Chinese medince has therapeutic effect on nonalcoholic steatohepatitis by anti-lipid peroxidation.
- Citation: Yu HB, Dai L, Peng HY, Mou XC, Zuo Z. Effects of compound from Chinese medicine on oxidation and anti-oxidation system of rat liver with steatohepatitis induced by high-fat diets. Shijie Huaren Xiaohua Zazhi 2005; 13(24): 2842-2847
- URL: https://www.wjgnet.com/1009-3079/full/v13/i24/2842.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i24.2842
非乙醇性脂肪性肝炎 (nonalcoholic steatohepatitis, NASH) 是一种与乙醇性脂肪性肝炎相类似的病理学状态[1,2], 其发病率逐年增高[3], 而且研究表明其是隐源性肝硬化的重要病因[4,5], 甚至可发展为肝癌[6-8,36-38], 但其发病机制尚不十分明确[9]. 研究认为氧应激和脂质过氧化在NASH发病中占有重要地位[1,10,11,18]. 目前临床上药物治疗效果尚不理想[1]. 我们通过高脂饮食建立NASH大鼠模型, 动态检测氧化和抗氧化指标并应用复方中药进行干预, 观察实验性NASH肝组织的氧化损伤, 探讨复方中药通过抗氧化作用防治NASH.
雄性SD大鼠50只, 体质量150±10 g, 购自大连医科大学实验动物中心. 复方中药 (西洋参5 g、黄芪10 g、泽泻10 g、山楂10 g、白术10 g、车前草10 g、柴胡5 g、丹参8 g, 8味中药复合而成) 由大连210医院中药局按常规剂量上药水提为流浸膏, 参照人体用量, 按系数折算出大鼠用量, 加蒸馏水稀释成灌胃溶液 (含生药290 g/L). 胆固醇购自上海伯奥生物工程公司, 猪油自备. 超氧化物歧化酶 (SOD)、丙二醛 (MDA)、一氧化氮 (NO)、诱导型一氧化氮合酶 (iNOS)、总抗氧化能力 (T-AOC)、谷胱甘肽过氧化物酶 (GSH-PX)、还原型谷胱甘肽 (GSH) 等试剂盒购自南京建成生物工程公司.
大鼠普通饲料喂养1 wk后, 随机分为6组 (n=10). 正常组普通饲料喂养; 模型Ⅰ、Ⅱ组喂高脂饲料(880 g/kg普通饲料+100 g/kg猪油+20 g/kg胆固醇); 中药治疗Ⅰ、Ⅱ组分别在喂饲高脂饲料9 wk、13 wk予复方中药5 mL/(kg·d) 灌胃, 每日1次, 其他组以相同剂量蒸馏水罐胃; 饮食治疗组在喂饲高脂饲料13 wk改为普通饲料喂养. 各组大鼠自由进食、进水, 分笼 (每笼5只) 饲养于20±2 ℃、明暗各12 h的动物实验室内. 12 wk末处死正常组、模型Ⅰ组、治疗Ⅰ组大鼠; 剩余3组大鼠继续喂养至16 wk末处死. 方法为禁食12 h, 乙醚麻醉, 下腔静脉采血后处死, 迅速取出肝脏, 按常规制备血清、肝匀浆、肝组织石蜡切片标本, 肝组织于-70 ℃低温保存. (1) 测定体质量, 肝比重和Lee's指数; (2) 采用全自动生化分析仪测定血清ALT, AST, 全血GSH-PX (DTNB直接法); (3) 肝匀浆测定MDA含量 (改进后的硫代巴比妥酸荧光法), SOD活性 (改良的盐酸羟胺法), T-AOC, NO, iNOS, GSH (按试剂盒说明操作); (4) 肝脏病理学检查, 光镜下评估脂肪变性程度.
统计学处理 计量资料以mean±SD表示, 各组间实验数据采用两样本均数的t检验; 等级资料采用秩和检验.
模型Ⅰ, Ⅱ组, 饮食组大鼠均呈明显腹型肥胖状态. 模型Ⅰ, Ⅱ组及饮食组体质量, 肝比重, Lee's指数和和正常组相比显著增高 (P<0.05, P<0.01); 中药Ⅰ组肝比重, Lee's指数模型Ⅰ组相比显著下降 (P<0.01, P<0.05), 中药Ⅱ组肝比重, Lee's指数和模型Ⅱ组相比显著下降 (P<0.05, P<0.01, 表1).
模型Ⅰ, Ⅱ组及饮食组ALT, AST显著增高 (P<0.01), 模型Ⅰ, Ⅱ组GSH-PX显著下降 (P<0.01), 饮食组GSH-PX也降低 (P<0.05); 中药Ⅰ组ALT, AST和模型Ⅰ组比降低 (P<0.01, P<0.05), GSH-PX增高 (P<0.05); 中药Ⅱ组ALT, AST和模型Ⅱ组比显著下降 (P<0.05, P<0.01), GSH-PX显著增高 (P<0.05, 表2).
与正常组比较, 模型Ⅰ组MDA显著增高, SOD, GSH下降明显 (P<0.05); 模型Ⅱ组MDA, iNOS, NO显著增高 (P<0.01, P<0.05); 模型Ⅱ组SOD, T-AOC, GSH增高(P<0.01); 中药治疗Ⅰ组GSH显著降低 (P<0.05); 中药治疗Ⅱ组SOD显著降低 (P<0.05), MDA增高明显(P<0.01); 饮食治疗组SOD, T-AOC, GSH下降明显 (P<0.01), MDA, NO, iNOS增高显著 (P<0.01, P<0.05). 与模型Ⅰ组比, 中药治疗Ⅰ组MDA显著降低 (P<0.05); 与模型Ⅱ组比, 治疗Ⅱ组SOD, GSH及T-AOC增高明显 (P<0.05); 治疗Ⅱ组MDA, iNOS, NO显著降低 (P<0.05, P<0.01, 表3).
| 分组 | SOD(kNU/gt) | TAOC(μkat/g) | GSH(mg/g) | MDA(μmol/g) | NO(μmol/g) | iNOS(kU/g) |
| 正常 | 198±25 | 26.8±3.7 | 48.5±7.6 | 5.08±0.91 | 0.89±0.21 | 0.41±0.12 |
| 模型Ⅰ | 171±14a | 24.2±3.4 | 40.8±5.1a | 6.45±1.07b | 0.95±0.15 | 0.45±0.12 |
| 中药Ⅰ | 190±18 | 25.6±3.6 | 40.1±7.7a | 5.31±0.98c | 0.88±0.19 | 0.36±0.10 |
| 模型Ⅱ | 148±26b | 21.8±3.6b | 35.0±9.0b | 8.38±1.32b | 1.08±0.17a | 0.60±0.15b |
| 中药Ⅱ | 172±19ac | 25.8±3.0c | 44.6±6.7c | 6.30±0.59bd | 0.89±0.15c | 0.42±0.11d |
| 饮食 | 165±14b | 22.3±2.5b | 38.6±5.1b | 7.36±1.08b | 1.05±0.11a | 0.50±0.07a |
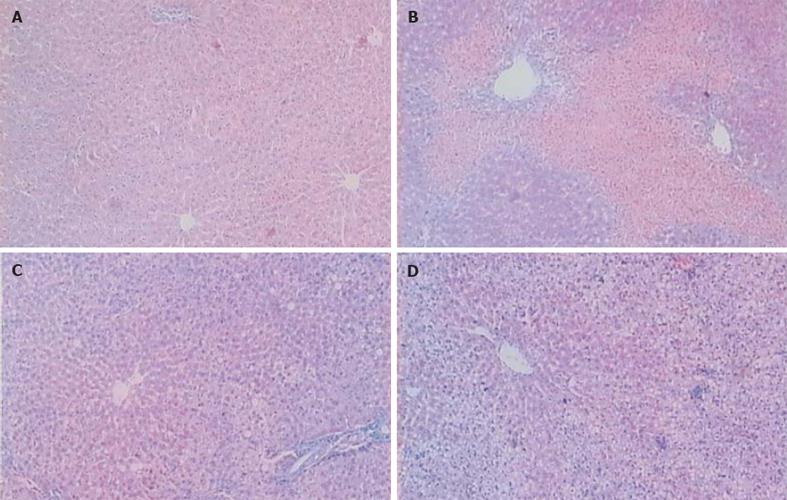
光镜下评估肝脂肪变性程度[12]. 正常组大鼠无脂肪变性; 与正常组比较, 模型组大鼠可见肝细胞明显肿胀, 胞质疏松, 气球样变, 胞质内还可见大小不等、数量不一的脂滴空泡, 可见灶状及碎屑状坏死, 偶见桥接坏死, 伴有中等以上炎症反应 (P<0.01); 中药治疗组大鼠HE染色可见肝细胞结构基本趋于正常, 偶见灶状坏死及肝细胞少量脂滴空泡, 较模型组脂肪变性程度明显减轻 (P<0.05), 但与正常组比较仍有差异 (P<0.01); 而饮食治疗组肝脂肪变性程度与模型组无显著差异, 与正常组有明显差异 (P<0.01, 表4, 图1).
化痰祛湿、活血化瘀、健脾消导, 清热解郁等是中医治疗脂肪肝的基本方法. 我们所采用的复方中药中西洋参、黄芪为君药, 以其益气养阴之效起主要作用. 泽泻、白术、车前草、生山楂为臣药, 其中泽泻清热渗湿; 白术既健脾益气, 又澡湿利水; 车前草利水而清热解毒, 且可清肝明目; 三药与君药协同作用, 使养阴而不腻, 利湿而不燥, 共奏健脾益气养阴, 清热利湿之功. 生山楂可助君药健脾消食, 兼活血化瘀. 佑以柴胡、丹参, 柴胡可舒肝解郁; 丹参可活血化瘀, 凉血解毒. 越来越多的研究表明NASH与乙醇性脂肪肝炎 (ASH) 可能存在着共同的发病机制[2]. 自由基介导的肝损伤是ASH的最重要发病机制, 其主要表现为氧化产物增多和(或)抗氧化作用减弱[13]. 目前认为ROS大量产生引起氧应激进而导致脂质过氧化和肝脏抗氧化系统异常是NASH形成的最终共同发病机制[14-20]. 来自分子氧的游离基或ROS过度产生超过肝细胞自由基清除系统对其去除能力时则产生氧应激[14,21]; 而因产生过量的ROS而增加的脂质过氧化是脂肪肝向NASH转化的标志[1,9]. 我们采用高脂、高胆固醇饮食成功造摸, 形成典型的NASH动物模型[22,23], 包括脂肪肝和脂肪性肝炎. 随着喂养时间的延长, 肝脏病变程度及氧化损伤指标呈进行性发展. 自由基不但氧化细胞膜的脂质, 而且氧化细胞膜的蛋白质, 最终导致肝细胞膜的结构与功能损害. 缺氧、内毒素、细胞色素P450ⅡE1表达增强、过氧化物酶体增殖物激活受体表达下调, 肝组织铁负荷过重等作为第2次打击因素引起的肝损伤破坏膜结构, 膜的流动性失常, 使ALT、AST释放入血. 复方中药治疗组大鼠血清转氨酶较模型组显著降低, 说明复方中药可通过增强细胞膜的稳定性, 保护肝细胞免受损伤.
SOD是机体抗氧化损伤防御体系中的最重要的抗氧化酶之一; T-AOC是反映机体整体水平的抗氧化水平高低的重要指标之一[24]; GSH是机体的另一种重要的抗氧化剂, 是"抗氧化剂复合链"的主要成员之一[25]; GSH-PX是机体内广泛存在的一种重要的过氧化物分解酶. 我们发现模型组大鼠肝组织SOD, T-AOC, GSH下降明显, 全血GSH-PX也显著降低, 而脂质过氧化终产物MDA明显增高, 表明NASH时产生大量的自由基和脂质过氧化物, 消耗了大量的SOD, T-AOC, GSH, GSH-PX, 从而使机体的抗氧化损伤的防御机制受损, 不能清除过多的自由基而导致肝损伤[26]. 复方中药治疗组与模型组相比, 能显著降低MDA, 抑制自由基的产生, 提高SOD, T-AOC, GSH, GSH-PX, 表明复方中药具有抑制脂质过氧化、增强机体抗氧化能力的作用. NO在众多的氧化损伤中发挥着重要作用[27-29], 而NOS是NO生成的主要限速因子[30]. 氧应激的终末产物可激活NF-κB介导的NO合成[15,31-33]; 且在内毒素、细胞因子等刺激下iNOS基因表达增加, 同样可生成大量的NO[34,35]. 我们观察到模型组大鼠NO和iNOS含量增加, 提示高脂、高胆固醇饮食可通过诱导iNOS活性, 参与对肝脏的氧化损伤. 而复方中药治疗组相对降低NO含量和iNOS活性提示, 复方中药可能通过抑制iNOS活性, 抑制NO含量的增加, 从而起到对肝脏的保护作用. 模型组大鼠肝脏可见中-重度脂肪变性, 间质内可见较多炎细胞浸润, 腺泡Ⅲ带脂肪变最重, 而腺泡Ⅰ带脂肪变最轻. 而复方中药治疗组脂肪变性明显减轻, 较少炎细胞浸润. 说明复方中药在改善脂肪变性程度的同时, 可以减轻炎症反应.
总之, 氧应激和脂质过氧化是NASH形成的一个重要发病机制. 复方中药可能通过保护肝细胞、抗脂质过氧化等综合作用来治疗大鼠NASH. 因此, 对NASH患者进行保肝治疗的同时, 检测脂质过氧化和抗氧化防御参数可能成为临床判定疗效和指导治疗的重要指标[26,39].
电编: 张勇 编辑: 潘伯荣 审读: 张海宁
| 1. | Sanyal AJ. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002;123:1705-1725. [PubMed] [DOI] |
| 3. | Nonalcoholic steatohepatitis clinical research network. Hepatology. 2003;37:244. [PubMed] [DOI] |
| 4. | Caldwell SH, Oelsner DH, Iezzoni JC, Hespenheide EE, Battle EH, Driscoll CJ. Cryptogenic cirrhosis: clinical characterization and risk factors for underlying disease. Hepatology. 1999;29:664-669. [PubMed] [DOI] |
| 5. | Ayata G, Gordon FD, Lewis WD, Pomfret E, Pomposelli JJ, Jenkins RL, Khettry U. Cryptogenic cirrhosis: clinicopathologic findings at and after liver transplantation. Hum Pathol. 2002;33:1098-1104. [PubMed] [DOI] |
| 6. | Shimada M, Hashimoto E, Taniai M, Hasegawa K, Okuda H, Hayashi N, Takasaki K, Ludwig J. Hepatocellular carcinoma in patients with non-alcoholic steatohepatitis. J Hepatol. 2002;37:154-160. [PubMed] [DOI] |
| 7. | Bugianesi E, Leone N, Vanni E, Marchesini G, Brunello F, Carucci P, Musso A, De Paolis P, Capussotti L, Salizzoni M. Expanding the natural history of nonalcoholic steatohepatitis: from cryptogenic cirrhosis to hepatocellular carcinoma. Gastroenterology. 2002;123:134-140. [PubMed] [DOI] |
| 8. | Ong JP, Younossi ZM. Is hepatocellular carcinoma part of the natural history of nonalcoholic steatohepatitis? Gastroenterology. 2002;123:375-378. [PubMed] [DOI] |
| 9. | Younossi ZM, Diehl AM, Ong JP. Nonalcoholic fatty liver disease: an agenda for clinical research. Hepatology. 2002;35:746-752. [PubMed] [DOI] |
| 10. | Chitturi S, Farrell GC. Etiopathogenesis of nonalcoholic steatohepatitis. Semin Liver Dis. 2001;21:27-41. [PubMed] [DOI] |
| 11. | Roskams T, Yang SQ, Koteish A, Durnez A, DeVos R, Huang X, Achten R, Verslype C, Diehl AM. Oxidative stress and oval cell accumulation in mice and humans with alcoholic and nonalcoholic fatty liver disease. Am J Pathol. 2003;163:1301-1311. [PubMed] [DOI] |
| 12. | Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholicsteatohepatitis: a proposal for grading and staging the histological lesions. Am J Gastroenterol. 1999;94:2467-2474. [PubMed] [DOI] |
| 13. | Walsh K, Alexander G. Alcoholic liver disease. Postgrad Med J. 2000;76:280-286. [PubMed] [DOI] |
| 14. | Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002;346:1221-1231. [PubMed] [DOI] |
| 15. | Day CP. Non-alcoholic steatohepatitis (NASH): where are we now and where are we going? Gut. 2002;50:585-588. [PubMed] [DOI] |
| 16. | Medina J, Fernandez-Salazar LI, Garcia-Buey L, Moreno-Otero R. Approach to the pathogenesis and treatment of nonalcoholic steatohepatitis. Diabetes Care. 2004;27:2057-2066. [PubMed] [DOI] |
| 17. | Reid AE. Nonalcoholic steatohepatitis. Gastroenterology. 2001;121:710-723. [PubMed] [DOI] |
| 18. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 19. | Chalasani N, Gorski JC, Asghar MS, Asghar A, Foresman B, Hall SD, Crabb DW. Hepatic cytochrome P450 2E1 activity in nondiabetic patients with nonalcoholic steatohepatitis. Hepatology. 2003;37:544-550. [PubMed] [DOI] |
| 20. | Emery MG, Fisher JM, Chien JY, Kharasch ED, Dellinger EP, Kowdley KV, Thummel KE. CYP2E1 activity before and after weight loss in morbidly obese subjects with nonalcoholic fatty liver disease. Hepatology. 2003;38:428-435. [PubMed] [DOI] |
| 21. | Kahn BB, Flier JS. Obesity and insulin resistance. J Clin Invest. 2000;106:473-481. [PubMed] [DOI] |
| 22. | Lieber CS, Leo MA, Mak KM, Xu Y, Cao Q, Ren C, Ponomarenko A, DeCarli LM. Model of nonalcoholic steatohepatitis. Am J Clin Nutr. 2004;79:502-509. [PubMed] |
| 23. | Koteish A, Diehl AM. Animal models of steatosis. Semin Liver Dis. 2001;21:89-104. [PubMed] [DOI] |
| 24. | Salvemini D, Riley DP, Cuzzocrea S. SOD mimetics are coming of age. Nat Rev Drug Discov. 2002;1:367-374. [PubMed] |
| 26. | Koruk M, Taysi S, Savas MC, Yilmaz O, Akcay F, Karakok M. Oxidative stress and enzymatic antioxidant status in patients with nonalcoholic steatohepatitis. Ann Clin Lab Sci. 2004;34:57-62. [PubMed] |
| 27. | Garvin JL, Ortiz PA. The role of reactive oxygen species in the regulation of tubular function. Acta Physiol Scand. 2003;179:225-232. [PubMed] [DOI] |
| 28. | Zhou JF, Cai D, Zhu YG, Yang JL, Peng CH, Yu YH. A study on relationship of nitric oxide, oxidation, peroxidation, lipoperoxidation with chronic chole-cystitis. World J Gastroenterol. 2000;6:501-507. [PubMed] |
| 29. | Ding SP, Li JC, Jin C. A mouse model of severe acute pancreatitis induced with caerulein and lipopolysaccharide. World J Gastroenterol. 2003;9:584-589. [PubMed] [DOI] |
| 31. | Hensley K, Kotake Y, Sang H, Pye QN, Wallis GL, Kolker LM, Tabatabaie T, Stewart CA, Konishi Y, Nakae D. Dietary choline restriction causes complex I dysfunction and increased H(2)O(2) generation in liver mitochondria. Carcinogenesis. 2000;21:983-989. [PubMed] [DOI] |
| 32. | Hashimoto T, Fujita T, Usuda N, Cook W, Qi C, Peters JM, Gonzalez FJ, Yeldandi AV, Rao MS, Reddy JK. Peroxisomal and mitochondrial fatty acid beta-oxidation in mice nullizygous for both peroxisome proliferator-activated receptor alpha and peroxisomal fatty acyl-CoA oxidase. Genotype correlation with fatty liver phenotype. J Biol Chem. 1999;274:19228-19236. [PubMed] [DOI] |
| 33. | Nardo B, Caraceni P, Pasini P, Domenicali M, Catena F, Cavallari G, Santoni B, Maiolini E, Grattagliano I, Vendemiale G. Increased generation of reactive oxygen species in isolated rat fatty liver during postischemic reoxygenation. Transplantation. 2001;71:1816-1820. [PubMed] [DOI] |
| 35. | Kone BC, Kuncewicz T, Zhang W, Yu ZY. Protein interactions with nitric oxide synthases: controlling the right time, the right place, and the right amount of nitric oxide. Am J Physiol Renal Physiol. 2003;285:F178-F190. [PubMed] [DOI] |
| 36. | Sanyal AJ. Mechanisms of Disease: pathogenesis of nonalcoholic fatty liver disease. Nat Clin Pract Gastroenterol Hepatol. 2005;2:46-53. [PubMed] [DOI] |
| 37. | Ong JP, Younossi ZM. Approach to the diagnosis and treatment of nonalcoholic fatty liver disease. Clin Liver Dis. 2005;9:617-34. [PubMed] [DOI] |
| 38. | Brunt EM. Pathology of nonalcoholic steatohepatitis. Hepatol Res. 2005;33:68-71. [PubMed] [DOI] |