修回日期: 2005-10-01
接受日期: 2005-10-19
在线出版日期: 2005-12-15
目的: 探讨核糖体蛋白L5(ribosomal protein L5, RPL5)在胃癌细胞中的表达及对胃癌细胞生长的影响.
方法: Western blot检测RPL5在胃癌细胞系中的表达, 构建RPL5特异性siRNA载体, 转染细胞, Western blot进行鉴定, MTT方法和流式细胞术检测转染细胞的生长变化.
结果: RPL5在胃癌细胞系AGS、MKN45、SGC7901、MGC803中的表达均明显强于在GES-1和正常胃黏膜上皮中的表达. 成功构建RPL5特异性siRNA载体U6-RPL5A和U6-RPL5B, 转染AGS细胞, 进行稳定筛选, 发现U6-RPL5A能显著抑制RPL5的表达, 其相应的细胞系AGS-U6-RPL5A的生长速度减慢. 细胞周期检测结果显示AGS-U6-RPL5A细胞中处于增殖期的细胞减少了约5%.
结论: 对RPL5功能的进一步深入研究可能会有助于胃癌的诊断和治疗.
引文著录: 刘骥, 李纪鹏, 陈冬利, 张洪伟, 王为忠. 核糖体蛋白L5在胃癌中的表达及功能. 世界华人消化杂志 2005; 13(23): 2731-2735
Revised: October 1, 2005
Accepted: October 19, 2005
Published online: December 15, 2005
AIM: To investigate the expression of ribosomal protein L15 (RPL5) in gastric cancer as well as its effect on the proliferation of gastric cancer cells.
METHODS: The expression of RPL5 was detected in gastric cancer cell lines AGS, MKN45, SGC7901 and MGC803 by Western blot. The specific siRNA vector of RPL5 was constructed and then transfected into AGS cells. The expression of RPL5 in the transfectants was examined by Western blot. The growth of transfected cells was evaluated by MTT assay and flow cytometry.
RESULTS: The expression of RPL5 in gastric cancer cell lines AGS, MKN45, SGC7901 and MGC803 were all significantly higher than that in GES-1 and normal epithelial cells of gastric mucosa. The specific siRNA vectors of RPL5, named U6-RPL5A and U6-RPL5B, were successfully constructed and transfected into AGS cells. U6-RPL5A could inhibit the expression of RPL5 significantly. The growth rate of U6-RPL5A transfected cells, named AGS-U6-RPL5A, was lower than the control cells, and the percentage of the cells that was in proliferation phase was decreased by about 5%.
CONCLUSION: RPL5 can inhibit the proliferation of gastric cancer cells, and further investigation of RPL5 function will be helpful in the diagnosis and treatment of gastric cancer.
- Citation: Liu J, Li JP, Chen DL, Zhang HW, Wang WZ. Expression and functional study of ribosomal protein L5 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2005; 13(23): 2731-2735
- URL: https://www.wjgnet.com/1009-3079/full/v13/i23/2731.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i23.2731
核糖体既是蛋白质生物合成的场所, 也是一个功能单位. 核糖体蛋白(ribosomal protein, RP)除组成核糖体, 参与蛋白质的合成之外, 还具有其他功能, 尤其近年来发现的许多核糖体的体外功能, 对重新认识和评估核糖体的作用具有重要的意义[1-5]. 我们在前期的基因芯片的研究中发现, 核糖体蛋白RPL5在胃癌组织中的表达明显高于癌旁组织, 提示RPL5可能在胃癌的发生发展中可能发挥作用. 我们将在先前的工作的基础上进一步探讨RPL5在胃癌中所起的作用和可能分子机制.
1.1.1 组织标本和细胞株: 正常胃黏膜组织的胃镜标本分别来源于2例胃镜下胃黏膜表现正常的患者, 病理检查亦表明为正常胃黏膜上皮组织. 标本取出后立即置于液氮中, 后于-70℃保存. 永生化正常胃上皮细胞系GES-1、胃癌细胞系AGS、MKN45、SGC7901、MGC803均为本实验室保存.
1.1.2 主要试剂: mU6pro载体为美国密西根大学Turner教授惠赠. RPL5单克隆抗体和ECL试剂购自Santa Cruz公司, β-actin单克隆抗体、MTT和DMSO均购自Sigma公司. 羊抗鼠二抗购自北京中山生物技术有限公司, NC膜购自Hybond公司. 小量质粒抽提试剂盒为Promega公司产品, Lipofectamin 2000为Invitrogen公司产品, G418为Gibco公司产品.
1.2.1 质粒构建和细胞转染: 以mU6pro为载体, 根据siRNA设计原则设计两对RPL5特异性siRNA寡核苷酸. 第一对正向寡核苷酸L1: 5'-tttgtgcatcatcatggagttaacataactccatgatg-atgcacttttt-3', 反向寡核苷酸L2: 5'-ctagaaaaagtgcatcatcatggagttatgttaactccatgatgatgca-3'. 第二对正向寡核苷酸L3: 5'-tttgcaatggtcttaatgttccacaggaacattaagaccattgcttttt-3', 反向寡核苷酸L4: 5'-ctagaaaaagcaatggtcttaatgttcctgtggaacattaagaccattg-3'. 正反向寡核苷酸体外退火, 退火后的双链siRNA与用BbsⅠ和XbaⅠ酶切后的mU6pro载体片段于16℃连接过夜. 连接产物转化E.coli DH5α感受态细胞, 挑取单克隆并且提取质粒, 以Hind Ⅲ和XbaⅠ酶切鉴定重组质粒. 收集酶切鉴定正确的重组质粒, 送上海生工公司进行测序. 采用Invitrogen公司LipofectAMINE 2000TM并按其说明书方法进行. 细胞转染时将AGS细胞接种于6孔板, 待细胞生长融合达80%后进行细胞转染, 每孔分别加入4 μL Lipofectamin 2000和2 μg质粒, 因为对于mU6pro表达载体, 由于其不含有筛选标签, 稳定转染时同时共转染pcDNA3.1A. 转染后2 d加G418进行抗性筛选, 浓度为500 mg/L, 筛选时间为6 wk. 挑取10个克隆进行鉴定.
1.2.2 细胞生长曲线绘制: 采用MTT法进行. 取对数生长期细胞按每孔2×103接种于96孔板, 分AGS、AGS-mU6pro和AGS-U6-RPL5A三组, 每组3个复孔, 置于细胞培养箱中常规培养. 在第1, 3, 5, 7 d, 每天每种细胞各取出3孔进行MTT计数, 每孔加入20 μL MTT贮存液(5 g/L), 继续培养4 h. 将培养上清置换成200 μL DMSO, ELISA仪读取吸光度, 检测波长为490 nm. 仅含培养液的孔作为空白对照, 仅用DMSO处理组为阴性对照.
1.2.3 细胞周期测定: 收获对数生长期的细胞, 胰酶消化后用冷PBS洗涤2次, 离心弃上清, 加入0.5 mL的PBS混悬细胞, 再加入1 mL无水乙醇固定, 4℃过夜. 离心弃上清, 冷PBS洗涤2次, 经碘化丙啶染色后, 流式细胞仪进行细胞周期检测. 重复三次, 取一典型测定结果为代表.
1.2.4 Western blot: 以80 μg蛋白为加样量进行SDS-PAGE电泳, 然后转移至hybond-NC膜, 以TTBS对膜进行漂洗, 室温封闭2 h, 加入一抗, 4℃孵育过夜. TTBS洗膜, 加入相应二抗室温孵育1 h, 最后用ECL试剂进行蛋白条带显色. 以β-actin作为内参照. 利用BioRad公司的Quantity One软件进行条带的定量.
统计学处理 采用Student-Newman-Keuls检验进行数据差异分析, P<0.05认为有显著性差异.
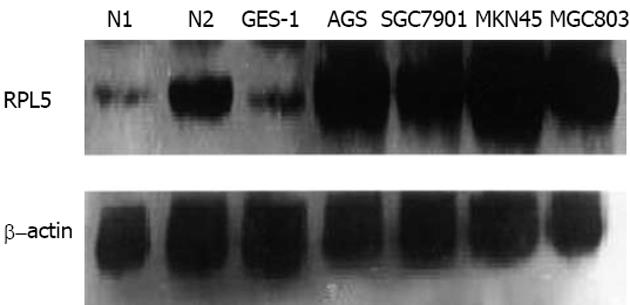
为了研究RPL5在胃癌的表达, 我们以两例正常胃黏膜组织和人永生化正常细胞系GES-1作为对照, 对胃癌细胞系AGS、MKN45、SGC7901、MGC803进行Western blot检测, 比较RPL5的含量. 在各细胞总蛋白上样量相同的条件下(β-actin条带的亮度基本相同), RPL5在肿瘤细胞系中高表达, 在GES-1和两例正常胃黏膜上皮组织中的表达均较弱(图1). 用Quantity One软件定量分析的结果表明, RPL5在胃癌细胞系中的表达均强于GES-1和正常胃黏膜上皮. RPL5蛋白的分子量为23 kD. 在进一步的实验中, 我们选用了RPL5表达较高的AGS细胞作为研究对象.
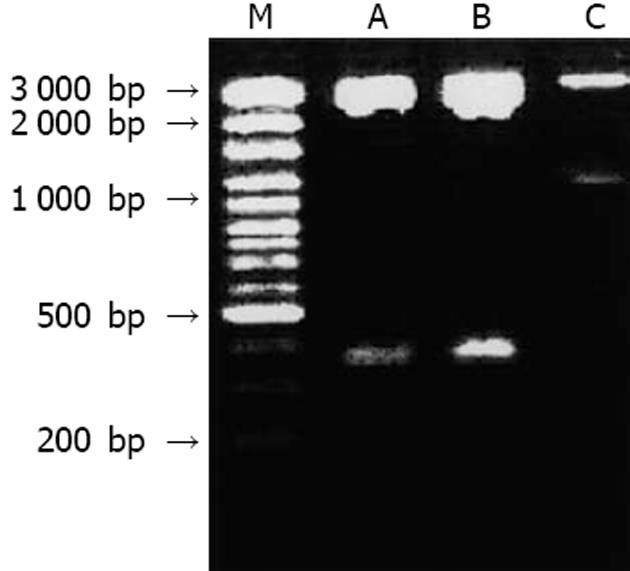
将退火后的两对寡核苷酸分别克隆入mU6pro载体, 命名为U6-RPL5A和U6-RPL5B, 用Hind Ⅲ和XbaⅠ双酶切鉴定, 释放出大小为380 bp的片断(包括U6启动子和克隆入的寡核苷酸), 表明载体构建成功(图2), 测序结果也与预期一致. 空载体对照mU6pro酶切释放出1 100 bp的片断(包括U6启动子和EGFP基因序列).
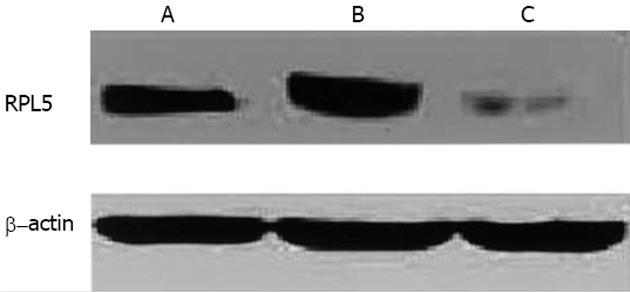
将U6-RPL5A和U6-RPL5B分别以10∶1的比pcDNA3.1A混和, 共同转染AGS细胞, 2 d后用500 mg/L的G418筛选, 分别挑取10个单克隆, 用Western blot鉴定RPL5的表达. U6-RPL5A和U6-RPL5B转染后阳性单克隆的鉴定结果显示, AGS-U6-RPL5A中RPL5的表达明显低于AGS-mU6pro的表达, 而AGS-U6-RPL5B中RPL5的表达与AGS-mU6pro差异不明显(图3). 这一结果表明U6-RPL5A更能有效抑制RPL5的表达, 且我们成功获得了RPL5低表达的细胞系.
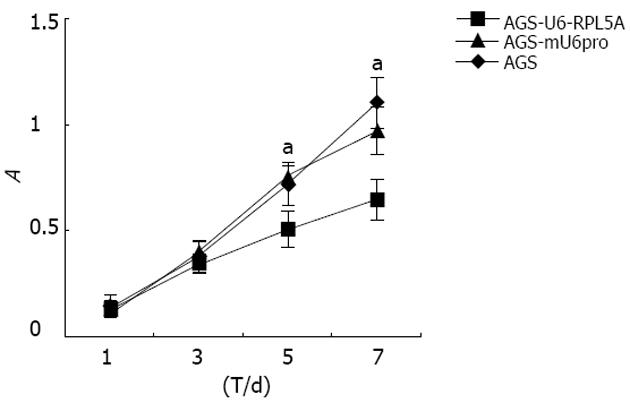
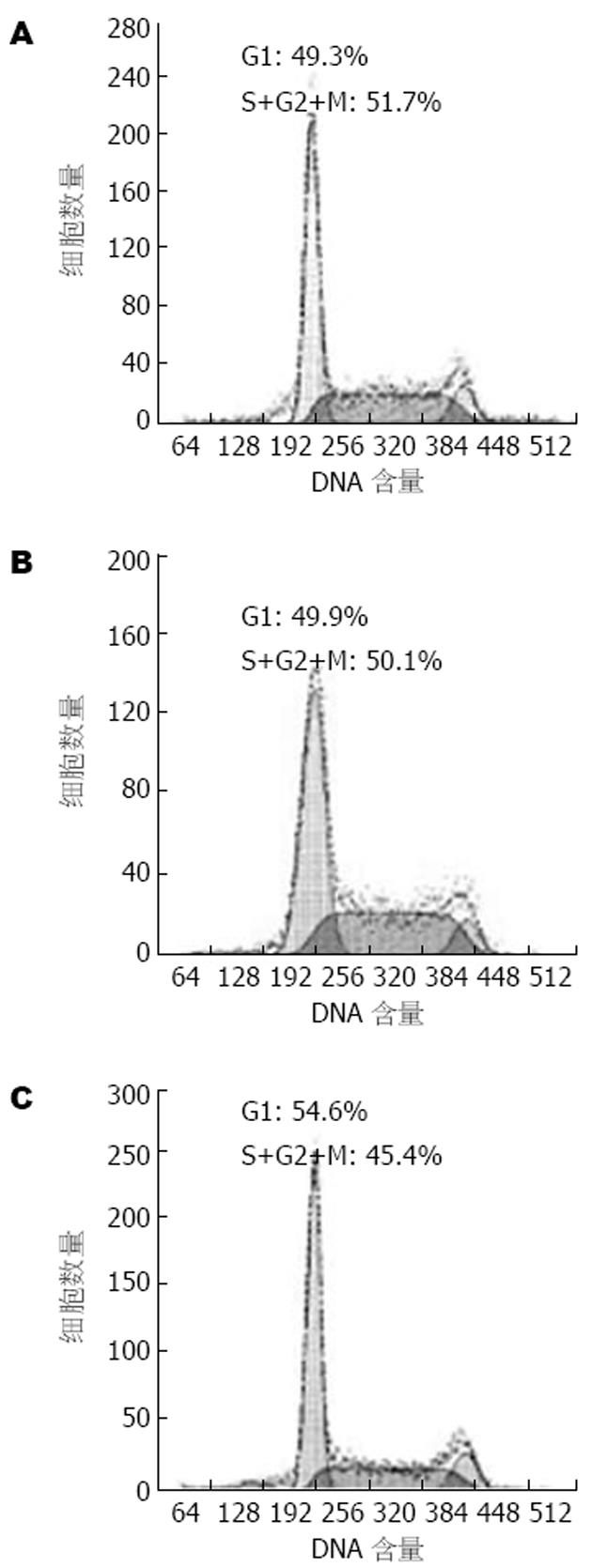
我们用MTT方法检测了转染细胞的生长速度, 发现RPL5的表达下调可使细胞的生长速度明显减慢, 表现为AGS-U6-RPL5A细胞在第5, 7 d的吸光度值均明显低于AGS和AGS-mU6pro(P<0.05, 图4). 进一步进行细胞周期的分析, 结果表明AGS-U6-RPL5A处于S+G2+M增殖期的细胞数明显低于AGS和AGS-mU6pro, 其比例约减少5%(图5).
翻译调节和核糖体组装是细胞内重要的生理过程, 与细胞的生长和细胞周期进展密切相关. 这一生理过程在肿瘤细胞中常常出现异常, 结果导致蛋白合成速率的增加, 细胞生长速度和细胞周期进展加快. 核糖体蛋白的异常表达是肿瘤细胞翻译调节和核糖体组装异常的重要表现之一[6-11].
核糖体蛋白与肿瘤的关系的直接证据来源于Amsterdam et al[12]. 对斑马鱼的研究他们筛选产生了12种易发生肿瘤的斑马鱼, 发现其中有11种斑马鱼有不同核糖体蛋白的突变, 证实这些核糖体蛋白的突变导致了斑马鱼肿瘤的发生. 因而他们认为斑马鱼中的核糖体蛋白是肿瘤相关基因.
而在人类肿瘤中, Pogue-Geile et al[13,14]首先发现RPS3在大肠癌中的表达上调. 随后越来越多的研究表明, 人类核糖体蛋白的高表达与肿瘤密切相关[15-20], 特别是近年来由于基因芯片和消减杂交技术等高通量技术的大量应用, 鉴定了多个在肿瘤中高表达的核糖体蛋白. 例如: 在化学致癌剂诱导的口腔癌中, RPS2的表达上调[21]; 在乳腺癌中, RPL7[22]、RPL19[23]和RPL8是高表达的; RPL19和RPS12[24]在头颈部肿瘤中的表达是升高的; RPS19在子宫平滑肌瘤和头颈部肿瘤[25]中的表达上调; RPL17a在大肠癌中的表达升高[26,27]. 另外, RPS2和RPL10a在多种肿瘤中也有较高表达[28]. Wang et al[29]在克隆了RPL15全长的基础上研究了RPL15在食道癌上的表达, 发现RPL15在食道癌中的表达是升高的. 而我们的先前的基因芯片的研究中发现, RPL5在胃癌组织中的表达明显强于癌旁组织, 本项研究进一步发现, RPL5在多株胃癌细胞系中的表达均明显强于胃黏膜上皮组织和永生化胃黏膜上皮细胞系GES-1, 表明RPL5很可能是胃癌细胞中一个上调的蛋白, 他可能在胃癌的诊断方面有一定的作用. 进一步的临床标本研究将有助于阐明RPL5在胃癌患者中的表达频率、强度以及分布.
Gardner-Thorpe et al[30]探讨了核糖体蛋白用于肿瘤治疗的可能, 他们将核糖体蛋白P2的反义核酸转染PaCa-2和BxPC-3细胞系, 结果发现核糖体蛋白P2的反义核酸能显著抑制肿瘤细胞系PaCa-2和BxPC-3生长, 其抑制率分别为63%和65%. 而我们的研究也表明, 用siRNA技术干预RPL5的表达可以显著抑制胃癌细胞系AGS的生长. 这两项类似的结果表明干预肿瘤细胞中核糖体蛋白的表达可能可以用于肿瘤的治疗. RPL5可能有希望成为胃癌治疗的一个新的靶分子. RPL5的siRNA抑制胃癌细胞生长的机制目前不清, 可能与胃癌细胞周期的阻滞或凋亡的诱导有关系, 尚需进一步的实验来探讨.
Amsterdam et al[12]发现斑马鱼中核糖体蛋白的突变与肿瘤的发生密切相关, 但是在人类中尚未发现肿瘤中有突变的核糖体蛋白存在, 因此, RPL5在胃癌中存在突变的可能性不大, 这一点还需要我们进一步用实验进行证实.
电编: 张敏 编辑: 潘伯荣 审读: 张海宁
| 1. | Ogle JM, Carter AP, Ramakrishnan V. Insights into the decoding mechanism from recent ribosome structures. Trends Biochem Sci. 2003;28:259-266. [PubMed] [DOI] |
| 2. | Rodnina MV, Daviter T, Gromadski K, Wintermeyer W. Struct-ural dynamics of ribosomal RNA during decoding on the ribosome. Biochimie. 2002;84:745-754. [PubMed] [DOI] |
| 3. | Wahl MC, Moller W. Structure and function of the acidic ribo-somal stalk proteins. Curr Protein Pept Sci. 2002;3:93-106. [PubMed] [DOI] |
| 4. | Stoneley M, Willis AE. Cellular internal ribosome entry seg-ments: structures, trans-acting factors and regulation of gene expression. Oncogene. 2004;23:3200-3207. [PubMed] [DOI] |
| 5. | Ramakrishnan V. Ribosome structure and the mechanism of translation. Cell. 2002;108:557-572. [PubMed] [DOI] |
| 6. | Holland EC, Sonenberg N, Pandolfi PP, Thomas G. Signaling control of mRNA translation in cancer pathogenesis. Oncogene. 2004;23:3138-3144. [PubMed] [DOI] |
| 7. | Ruggero D, Pandolfi PP. Does the ribosome translate cancer? Nat Rev Cancer. 2003;3:179-192. [PubMed] [DOI] |
| 8. | Holland EC. Regulation of translation and cancer. Cell Cycle. 2004;3:452-455. [PubMed] [DOI] |
| 9. | Berven LA, Crouch MF. Cellular function of p70S6K: a role in regulating cell motility. Immunol Cell Biol. 2000;78:447-451. [PubMed] [DOI] |
| 10. | Kowalczyk P, Woszczynski M, Ostrowski J. Increased express-ion of ribosomal protein S2 in liver tumors, posthepactomized livers, and proliferating hepatocytes in vitro. Acta Biochim Pol. 2002;49:615-624. [PubMed] |
| 11. | Woo MS, Ohta Y, Rabinovitz I, Stossel TP, Blenis J. Ribosomal S6 kinase (RSK) regulates phosphorylation of filamin A on an important regulatory site. Mol Cell Biol. 2004;24:3025-3035. [PubMed] [DOI] |
| 12. | Amsterdam A, Sadler KC, Lai K, Farrington S, Bronson RT, Lees JA, Hopkins N. Many ribosomal protein genes are cancer genes in zebrafish. PLoS Biol. 2004;2:E139. [PubMed] [DOI] |
| 13. | Pogue-Geile K, Geiser JR, Shu M, Miller C, Wool IG, Meisler AI, Pipas JM. Ribosomal protein genes are overexpressed in colorectal cancer: isolation of a cDNA clone encoding the hum-an S3 ribosomal protein. Mol Cell Biol. 1991;11:3842-3849. [PubMed] [DOI] |
| 14. | Pipas JM, Pogue-Geile K, Finley GG, Cartwright CA, Meiesler AI. Gene structure and expression in colorectal cancer. Adv Exp Med Biol. 1993;330:67-75. [PubMed] [DOI] |
| 15. | Barnard GF, Staniunas RJ, Bao S, Mafune K, Steele GD Jr, Gollan JL, Chen LB. Increased expression of human ribosomal phosphoprotein P0 messenger RNA in hepatocellular carcino-ma and colon carcinoma. Cancer Res. 1992;52:3067-3072. [PubMed] |
| 16. | Zhou J, Callapina M, Goodall GJ, Brune B. Functional integrity of nuclear factor kappaB, phosphatidylinositol 3'-kinase, and mitogen-activated protein kinase signaling allows tumor necrosis factor alpha-evoked Bcl-2 expression to provoke internal ribosome entry site-dependent translation of hypoxia-inducible factor 1alpha. Cancer Res. 2004;64:9041-9048. [PubMed] [DOI] |
| 17. | Chiao PJ, Shin DM, Sacks PG, Hong WK, Tainsky MA. Elevated expression of the ribosomal protein S2 gene in human tumors. Mol Carcinog. 1992;5:219-231. [PubMed] [DOI] |
| 18. | Denis MG, Chadeneau C, Lecabellec MT, LeMoullac B, LeMevel B, Meflah K, Lustenberger P. Over-expression of the S13 ribosomal protein in actively growing cells. Int J Cancer. 1993;55:275-280. [PubMed] [DOI] |
| 19. | Ropolo M, Geroldi A, Rossi O, Degan P, Zupo S, Poggi A, Frosi-na G. Expression of the Drosophila melanogaster S3 ribosomal/repair protein in T24 human bladder cells. Anticancer Res. 2004;24:3811-3818. [PubMed] |
| 20. | Clark DE, Errington TM, Smith JA, Frierson HF Jr, Weber MJ, Lannigan DA. The serine/threonine protein kinase, p90 ribosomal S6 kinase, is an important regulator of prostate cancer cell proliferation. Cancer Res. 2005;65:3108-3116. [PubMed] |
| 21. | Shin DM, Chiao PJ, Sacks PG, Shin HJ, Hong WK, Hittelman WN, Tainsky MA. Activation of ribosomal protein S2 gene expression in a hamster model of chemically induced oral carcinogenesis. Carcinogenesis. 1993;14:163-166. [PubMed] [DOI] |
| 22. | Zhu Y, Lin H, Li Z, Wang M, Luo J. Modulation of expression of ribosomal protein L7a (rpL7a) by ethanol in human breast cancer cells. Breast Cancer Res Treat. 2001;69:29-38. [PubMed] [DOI] |
| 23. | Henry JL, Coggin DL, King CR. High-level expression of the ribosomal protein L19 in human breast tumors that overexpress erbB-2. Cancer Res. 1993;53:1403-1408. [PubMed] |
| 24. | Cheng Q, Lau WM, Chew SH, Ho TH, Tay SK, Hui KM. Identi-fication of molecular markers for the early detection of human squamous cell carcinoma of the uterine cervix. Br J Cancer. 2002;86:274-281. [PubMed] [DOI] |
| 25. | Shim C, Zhang W, Rhee CH, Lee JH. Profiling of differentially expressed genes in human primary cervical cancer by complementary DNA expression array. Clin Cancer Res. 1998;4:3045-3050. [PubMed] |
| 26. | Wang Y, Cheong D, Chan S, Hooi SC. Ribosomal protein L7a gene is up-regulated but not fused to the tyrosine kinase receptor as chimeric trk oncogene in human colorectal carcinoma. Int J Oncol. 2000;16:757-762. [PubMed] [DOI] |
| 27. | Kasai H, Nadano D, Hidaka E, Higuchi K, Kawakubo M, Sato TA, Nakayama J. Differential expression of ribosomal proteins in human normal and neoplastic colorectum. J Histochem Cytochem. 2003;51:567-574. [PubMed] [DOI] |
| 28. | Koga M, Shichijo S, Yamada A, Ashihara J, Sawamizu H, Kusukawa J, Itoh K. Identification of ribosomal proteins S2 and L10a as tumor antigens recognized by HLA-A26-restricted CTL. Tissue Antigens. 2003;61:136-145. [PubMed] [DOI] |
| 29. | Wang Q, Yang C, Zhou J, Wang X, Wu M, Liu Z. Cloning and characterization of full-length human ribosomal protein L15 cDNA which was overexpressed in esophageal cancer. Gene. 2001;263:205-209. [PubMed] [DOI] |
| 30. | Gardner-Thorpe J, Ito H, Ashley SW, Whang EE. Ribosomal protein P2: a potential molecular target for antisense therapy of human malignancies. Anticancer Res. 2003;23:4549-4560. [PubMed] |