修回日期: 2005-09-01
接受日期: 2005-09-17
在线出版日期: 2005-11-28
目的: 探讨乌司他丁对急性坏死性胰腺炎大鼠核因子-κB(NF-κB)的表达及有关细胞因子的影响.
方法: 将30只Sprague-Dawley大鼠随机分为假手术组(SO组)、急性坏死性胰腺炎组(ANP组)和急性坏死性胰腺炎乌司他丁治疗组(UTI组), 比较各组大鼠NF-κB、IL-6、TNF-α、血清淀粉酶的水平.
结果: ANP组淀粉酶活性195907.51±38618.39 nkat/L, TNF-α值41.37±7.54 ng/L, IL-6值32.32±8.62 ng/L, 肺、胰腺组织NF-κB表达增加, 与SO组比较P均<0.01, 乌司他丁治疗后, 淀粉酶活性69804.30±19432.55 nkat/L, TNF-α值18.66±6.45 ng/L, IL-6值23.41±7.65 ng/L, 肺、胰腺组织NF-κB表达降低, 与SO组和ANP组比较P均<0.01.
结论: 急性坏死性胰腺炎时NF-κB活化, 上调IL-6、TNF-α, 加重胰腺及肺的损伤, 乌司他丁抑制NF-κB表达而减轻胰腺及肺的损伤, 改善急性坏死性胰腺炎的预后.
引文著录: 刘瑞林, 刘牧林, 马良龙, 吴薇. 大鼠急性坏死性胰腺炎 NF-κB 的变化及乌司他丁的调控作用. 世界华人消化杂志 2005; 13(22): 2700-2703
Revised: September 1, 2005
Accepted: September 17, 2005
Published online: November 28, 2005
AIM: To evaluate the effect of ulinastatin (UTI) on the expression of nuclear factor-κB (NF-κB) and related cytokines in acute necrotic pancreatitis (ANP) in rats.
METHODS: Thirty Sprague-Dawley rats were random-ly divided into sham operation (SO) group, ANP group and UTI treatment group. The levels of NF-κB, interleu-kin-6 (IL-6), tumor necrosis factor-α (TNF-α) and ser-um amylase in rats were detected. ANP model was in-duced by retrograde administration of 50 g/L sodium taurocholate into biliary-pancreatic duct.
RESULTS: In ANP group, the levels of serum amylase (195907.51±38618.39 nkat/L), TNF-α (41.37±7.54 ng/L), IL-6 (32.32±8.62 ng/L) as well as the expression of pancreatic and pulmonary NF-κB were all increased as compared with those in SO group (all P <0.01). Aft-er treatment with UTI, the levels of serum amylase (69804.30±19432.55 nkat/L), TNF-α (18.66±6.45 ng/L), IL-6 (23.41±7.65 ng/L) as well as the expression of pa-ncreatic and pulmonary NF-κB were all significantly de-creased as compared with those in SO and ANP group (P <0.01).
CONCLUSION: In the pathogenesis of ANP, activated NF-κB and up-regulated TNF-α and IL-6 aggravated the injuries of pancreas and lung tissues. UTI plays a protective role in ANP by inhibiting the activation of NF-κB, so as to alleviate the injuries of pancreas and lung tissues.
- Citation: Liu RL, Liu ML, Ma LL, Wu W. Effect of ulinastatin on nuclear factor-κB expression in acute necrotic pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2005; 13(22): 2700-2703
- URL: https://www.wjgnet.com/1009-3079/full/v13/i22/2700.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i22.2700
急性坏死性胰腺炎(ANP)是普外科最常见的急腹症之一, 是由胰腺广泛出血、坏死而引起的一种严重疾病, 临床表现重, 病死率高, 平均约为20-30%[1], 其发病也有逐年升高的趋势. 目前, ANP确切的发病机制尚未完全阐明. 国内外学者以前推崇的是胰酶自身消化学说, 认为是胰酶的广泛激活而引起的一种全身性损害. 但近年来的大量实验数据提示, 细胞因子级联效应也是ANP病程不断恶化的主要原因[2,3].
核因子-κB(NF-κB)是一类能与多种基因启动子部位κB位点发生特异性结合, 并促进基因转录的蛋白质总称. 目前发现急性胰腺炎早期腺泡细胞就发生NF-κB的过度表达, 其对急性胰腺炎时细胞因子的表达有调控作用[4]. NF-κB表达与急性胰腺炎的肺损伤密切相关[5,6]. 广谱蛋白酶抑制剂乌司他丁具有抑制多种胰酶和抑制炎症介质释放的作用, 是治疗急性胰腺炎的有效药物[7,8], 但其作用机制是否与抑制NF-κB的表达有关, 国内外研究甚少, 我们试图揭示乌司他丁与NF-κB变化的关系.
(1)牛磺胆酸钠(Sigma公司), 乌司他丁(广东天普生化医药股份有限公司). (2)TNF-α、IL-6细胞因子ELISA试剂盒(上海É雄科技实业有限公司), 洗板机(ENLEY, DRAGON), 酶标仪(DENLEY, DRAGON), 振荡器KJ-201A型, 混合型XH-B型, 温箱PYX-DHS-40×50. (3)超薄切片机(LKBV型), 光学显微镜(Olympus BA). (4)LGR-160-W高速微量低温离心机. (5)蛋白抽提试剂盒(Active Motiff公司), BCA蛋白定量试剂盒(Pierce公司), EMSA(电泳迁移率变迁检测)试剂盒(Pierce公司), DNA探针(5'-GCC TCC AAT GTT CGC GAA CTT TCG-3')由上海生工公司合成并进行末端生物素标记, 垂直电泳仪及半干转移仪(Bio-Rad公司).
1.2.1 动物分组及模型制作[9]: ♂Sprague-Dawley大鼠30只, 体质量220-280 g, 随机分为假手术组(SO组)、急性坏死性胰腺炎组(ANP组)及急性坏死性胰腺炎乌司他丁治疗组(UTI组), 每组10只, 术前12 h禁食, 自由饮水. 假手术组(SO组): 开腹后·动胰腺, 经门静脉注射生理盐水4 mL/kg. ANP组: 经胰胆管逆行加压注射50 g/L牛磺胆酸钠溶液1 mL/kg, 然后立即经门静脉注射生理盐水4 mL/kg, 5 min后可见整个胰腺出现明显充血、水肿、片状出血, 证实ANP动物模型已建立成功. UTI组: ANP模型建立后5 min, 经门静脉给予乌司他丁4 mL/kg(40 000 U/kg). 各组动物均于术后6 h处死, 取血标本作淀粉酶、TNF-α, IL-6检测, 取胰腺、肺组织, 40 g/L甲醛固定, 组织切片行HE染色及免疫组化检查.
1.2.2 淀粉酶(Amy)检测: 取血清样品待测液, 经碘-淀粉酶法分别测定660 nm波长下测定管(加入血清样品)和对照管(不含血清样品)的吸光度(A), 计算淀粉酶含量.
1.2.3 血清TNF-α、IL-6含量测定: 取血清样品待测液, 通过大鼠TNF-α、IL-6定量ELISA试剂盒测定, 严格参照试剂盒操作说明进行.
1.2.4 组织病理学检查: 将胰腺、肺组织固定于40 g/L中性甲醛溶液中, 常规脱水, 石蜡包埋切片, HE染色后光镜下观察病理变化.
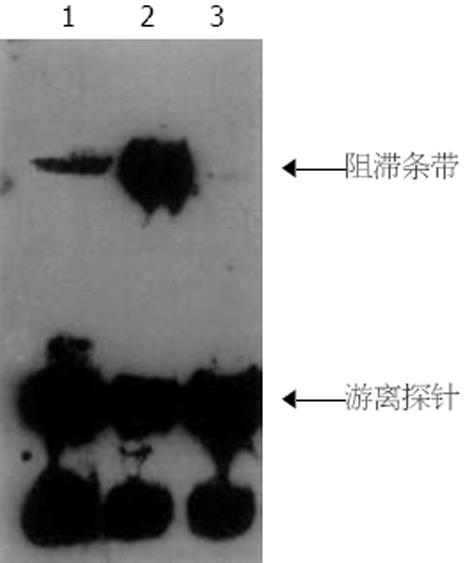
1.2.5 NF-κB活化表达检测: (1)SP(链霉素抗生素蛋白-过氧化酶)法: 免疫组化法测胰腺、肺组织NF-κB的活化表达, 标本取出后迅速放入中性(40 g/L)甲醛溶液中固定, 常规脱水, 石蜡包埋切片, 采用SP法进行免疫组化染色, 正常情况下NF-κB与抑制蛋白IκB结合, 胰腺炎时, IκB释放, NF-κB的亚单位P65区暴露, 应用抗P65单克隆抗体与其结合, 经过特殊处理, 可以在原位识别活化的NF-κB. 结果评定: 着色强度按未着色, 淡黄, 粽黄及黄褐色分为-、+、++、+++. 阳性比率: 随机观察5个中倍视野(10×20), 计算阳性细胞占细胞数的比例. (2)EMSA法: 新鲜胰腺取材组织称质量匀浆后抽提核蛋白, 步骤按试剂盒说明书. 以BCA法测定抽得的蛋白浓度. 制备60 g/L非变性聚丙烯酰胺凝胶. 按照EMSA试剂盒说明书, 每孔取抽提的核蛋白6 μg, 与缓冲液及探针混匀, 室温孵育20 min后, 上样电泳, 100 V, 1.5-2 h. 半干电转移(280 mA 40 min)将蛋白转至带阳性电荷的尼龙膜. 紫外灯交联后化学发光显色.
统计学处理 TNF-α、IL-6、Amy均以均数±标准差(mean±SD)表示, 采用方差分析、q检验和等级相关分析.
ANP组较SO组及UTI组明显增高, 有统计学意义(P<0.01), UTI组较ANP含量低, 但高于SO组(P<0.01).
2.2.1 胰腺SO组: 胰腺组织分散, 形状不规则, 胰腺细胞形态正常, 胰岛清晰可见, 胰腺小叶完整, 间质无充血水肿, 无炎细胞浸润. ANP组: 胰腺水肿、出血明显呈暗红色, 分叶结构模糊, 胰周腹膜大量皂化斑. 镜下胰腺组织大片坏死, 细胞结构模糊, 片状出血, 小叶轮廓不清, 间质出血, 大量炎细胞浸润. UTI干预组: 胰腺质软, 水肿较轻, 分叶结构模糊, 点状出血坏死较少. 镜下小叶轮廓存在, 可见点状出血, 偶见坏死灶, 间质有少量炎细胞浸润.
2.2.2 肺SO组: 两肺分叶清楚, 无水肿渗出充血. 镜下肺小叶结构完整, 肺泡腔无渗出, 间质无充血水肿, 无炎细胞浸润. ANP组: 肺组织充血水肿. 镜下肺泡壁增厚, 肺泡腔浆液渗出, 肺泡间隔增宽, 间质有大量炎细胞浸润. UTI干预组: 肺组织炎症反应较ANP组明显减轻.
重症急性胰腺炎发病急骤, 病情较重, 死亡率居高不下. 重要原因之一就是病变早期就可引起肺、肾、心脏等器官功能衰竭[10,11]等. 其发病机制仍不清楚, 传统胰腺酶激活和自身消化机制不能完全解释. 近年实验室研究表明细胞因子的瀑布样级联反应在胰外器官损害中起着重要的作用[12-14]. NF-κB是细胞因子释放的开关[15], 在急性胰腺炎发病机制中起着重要作用, 本实验也证实此点.
NF-κB是NF-κB/Rel家族中的最主要成员之一[16], 正常情况下NF-κB以无活性状态存在于细胞质中, 他是一条由Mr 50 000的多肽链(NF-κB1)和一条Mr 65 000的多肽链(RelA)构成的二聚体, 与其抑制蛋白IκB结合形成非活性的三聚体, 处于不表达状态. 细胞外的许多刺激物如LPS、TNF-α、IL-1β、生长因子、病毒蛋白以及缺血-再灌注、内毒素血症、氧中毒等病理生理状态下均可激活NF-κB. 首先引起NF-κB诱导激酶的活化, 继而活化IκB激酶, IκB磷酸化, IκB从NF-κB复合体上脱落, 活化的NF-κB移向细胞核内, 结合到靶基因的启动子或增强子的κB结构域, 引起许多因子的转录, 包括细胞因子: TNF-α、IL-1β、IL-2和IL-6等; 化学趋化因子: IL-8, 巨噬细胞趋化肽; 细胞黏附分子: E-选择素, ICAM-1, VCAM-1; 生长因子: IL-3, GM-CSF; 免疫受体; 急性期反应蛋白等[17,18]. Gukovsky et al[19]发现NF-κB的激活是急性胰腺炎发病中重要的早期事件, 制作急性胰腺炎模型后6 h NF-κB达高峰, 此后开始下降. Telek et al[20]认为急性胰腺炎早期腺泡细胞氧自由基大量生成并造成细胞损伤与NF-κB的激活密切相关. Vaquero et al[21]在以大鼠胰胆管逆行注射50 g/L牛磺胆酸钠建立的急性坏死性胰腺炎模型上发现胰腺组织NF-κB的活性与TNF-α及IL-6等炎性细胞因子和化学趋化因子的表达密切相关, 而且与胰腺组织损伤的程度也密切相关, 因而认为NF-κB的激活在急性重症胰腺炎的发病中起重要作用. 我们在模型制成后6 h处死大鼠, 取胰腺及肺组织测定NF-κB的表达, 结果表明, 假手术组很少表达, ANP组表达明显增强并有统计学意义(P<0.01), 相应地, TNF-α、IL-6和淀粉酶也显著高于假手术组(P<0.01). 我们另一研究内容发现NF-κB和TNF-α、IL-6表达呈正相关, 说明NF-κB活化过量表达在ANP的病程演变及ANP肺损伤时起重要作用, 为治疗急性坏死性胰腺炎提供线索.
乌司他丁是从人尿中分离纯化出的一种糖蛋白[22], 分子质量为67 ku, 经国内外学者研究证实其主要有以下作用: (1)具有抑制胰蛋白酶、弹性蛋白酶、纤溶酶等蛋白水解酶、透明质酸酶、淀粉酶、脂肪酶等糖类和脂类水解酶的作用[23]. (2)稳定溶酶体膜, 抑制溶酶体的释放. ANP发生后, 由于溶酶体膜、线粒体膜受到损伤, 导致细胞呼吸功能受损, 最后引起多脏器功能衰竭. 因此, 乌司他丁用于ANP后, 可稳定溶酶体膜, 减少细胞损伤, 具有保护器官作用. (3)抑制炎症介质和细胞因子的释放, 从而减轻ANP后全身炎症反应并预防多器官功能损害[24], 其抑制炎症介质释放的机制未完全阐明. 我们从基因水平研究了乌司他丁在治疗ANP时对细胞因子影响的机制. 从结果中我们可以看出, 乌司他丁干预组与ANP组血清中TNF-α、IL-6及胰腺、肺组织中NF-κB的表达差别显著(P<0.01). 提示乌司他丁治疗ANP预防并发症可能和抑制NF-κB活化有关, 为我们更好地认识乌司他丁的治疗作用机制提供了新的思路.
本实验结果表明: ANP时NF-κB活化, 上调TNF-α、IL-6等细胞因子, 参予ANP的病程, 并促进ANP肺损伤的发生. 乌司他丁可能通过抑制NF-κB活化、下调TNF-α、IL-6的表达而减轻胰腺炎及胰腺炎肺损伤, 改善ANP的预后.
电编: 张敏 编辑: 张海宁
| 1. | Woodcock S, Siriwardena A. High early mortality rate from acute pancreatitis in Scotland, 1984-95. Br J Surg. 2000;87:379-380. [PubMed] [DOI] |
| 2. | Brady M, Christmas S, Sutton R, Neoptolemos J, Slavin J. Cytokines and acute pancreatitis. Baillieres Best Pract Res Clin Gastroenterol. 1999;13:265-289. [PubMed] [DOI] |
| 3. | Mayer J, Rau B, Gansauge F, Beger HG. Inflammatory mediato-rs in human acute pancreatitis: clinical and pathophysiological implications. Gut. 2000;47:546-552. [PubMed] [DOI] |
| 5. | Imrie CW, Ferguson JC, Murphy D, Blumgart LH. Arterial hypoxia in acute pancreatitis. Br J Surg. 1977;64:185-188. [PubMed] [DOI] |
| 6. | Willemer S, Feddersen CO, Karges W, Adler G. Lung injury in acute experimental pancreatitis in rats. I. Morphological studi-es. Int J Pancreatol. 1991;8:305-321. [PubMed] |
| 8. | Okuhama Y, Shiraishi M, Higa T, Tomori H, Taira K, Mamadi T, Muto Y. Protective effects of ulinastatin against ischemia-reperfusion injury. J Surg Res. 1999;82:34-42. [PubMed] [DOI] |
| 9. | Lerch MM, Adler G. Experimental animal models of acute pancreatitis. Int J Pancreatol. 1994;15:159-170. [PubMed] |
| 10. | Imrie CW, Whyte AS. A prospective study of acute pancrea-titis. Br J Surg. 1975;62:490-494. [PubMed] [DOI] |
| 11. | Renner IG, Savage WT, Pantoja JL, Renner VJ. Death due to acute pancreatitis. A retrospective analysis of 405 autopsy cases. Dig Dis Sci. 1985;30:1005-1018. [PubMed] [DOI] |
| 12. | Karne S, Gorelick FS. Etiopathogenesis of acute pancreatitis. Surg Clin North Am. 1999;79:699-710. [PubMed] [DOI] |
| 13. | Denham W, Norman J. The potential role of therapeutic cytok-ine manipulation in acute pancreatitis. Surg Clin North Am. 1999;79:767-781. [PubMed] [DOI] |
| 14. | Norman J. The role of cytokines in the pathogenesis of acute pancreatitis. Am J Surg. 1998;175:76-83. [PubMed] [DOI] |
| 15. | Steinle AU, Weidenbach H, Wagner M, Adler G, Schmid RM. NF-kappaB/Rel activation in cerulein pancreatitis. Gastroenterology. 1999;116:420-430. [PubMed] [DOI] |
| 16. | Liu HS, Pan CE, Liu QG, Yang W, Liu XM. Effect of NF-kappaB and p38 MAPK in activated monocytes/macrophages on pro-inflammatory cytokines of rats with acute pancreatitis. World J Gastroenterol. 2003;9:2513-2518. [PubMed] |
| 17. | Siebenlist U, Franzoso G, Brown K. Structure, regulation and function of NF-kappa B. Annu Rev Cell Biol. 1994;10:405-455. [PubMed] [DOI] |
| 18. | Stancovski I, Baltimore D. NF-kappaB activation: the I kappaB kinase revealed. Cell. 1997;91:299-302. [PubMed] [DOI] |
| 19. | Gukovsky I, Gukovskaya AS, Blinman TA, Zaninovic V, Pand-ol SJ. Early NF-kappaB activation is associated with hormone-induced pancreatitis. Am J Physiol. 1998;275:G1402-1414. [PubMed] |
| 20. | Telek G, Ducroc R, Scoazec JY, Pasquier C, Feldmann G, Roze C. Differential upregulation of cellular adhesion molecules at the sites of oxidative stress in experimental acute pancreatitis. J Surg Res. 2001;96:56-67. [PubMed] [DOI] |
| 21. | Vaquero E, Gukovsky I, Zaninovic V, Gukovskaya AS, Pandol SJ. Localized pancreatic NF-kappaB activation and inflammat-ory response in taurocholate-induced pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2001;280:G1197-1208. [PubMed] |
| 22. | Suzuki M, Kobayashi H, Tanaka Y, Hirashima Y, Terao T. Stru-cture and function analysis of urinary trypsin inhibitor (UTI): identification of binding domains and signaling property of UTI by analysis of truncated proteins. Biochim Biophys Acta. 2001;1547:26-36. [PubMed] [DOI] |
| 23. | Yoshida K, Toki F, Takeuchi T. Antienzyme preparations in the treatment of acute pancreatitis. Nippon Rinsho. 1990;48:165-172. [PubMed] |