修回日期: 2005-08-15
接受日期: 2005-08-26
在线出版日期: 2005-11-28
目的: 介绍从胆汁中培养纳米细菌的方法.
方法: 无菌抽取30例胆囊结石患者的胆汁经"稀释-离心-过滤"或"过滤法"预处理后, 在常规细胞培养条件下进行纳米细菌培养. 光镜下观察细菌形态. 采用间接免疫荧光染色对培养所得细菌进行鉴定, 并在电镜下观察.
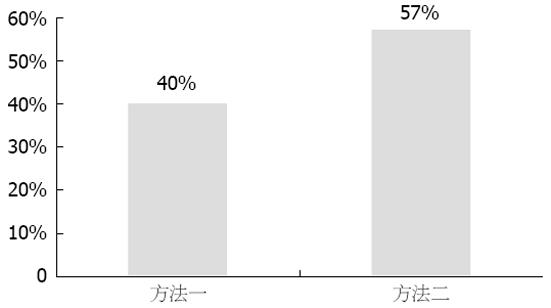
结果: 30例胆汁样本, 经过"稀释-离心-过滤"预处理后, 纳米细菌培养的阳性率为40%, 经"过滤法"预处理后, 纳米细菌培养的阳性率为57%, 两种方法预处理后, 胆汁纳米细菌培养阳性率无统计学差异(χ2 = 1.669, P>0.05). 培养2 wk时, 显微镜下可见做布朗运动的微小的颗粒状纳米细菌. 4 wk时, 可见纳米细菌开始贴附于培养瓶底部形成细菌被膜. 培养所得纳米细菌与8D10抗体产生特异性结合, 电镜下观察呈球形或短棒状颗粒, 大小约为80-350 nm.
结论: 在胆囊结石患者的胆汁中存在纳米细菌感染, "过滤法"是一种简单有效的预处理胆汁的方法.
引文著录: 王利民, 沈文律, 张士莲, 曹立赢, 王宝强. 胆汁纳米细菌的培养. 世界华人消化杂志 2005; 13(22): 2663-2666
Revised: August 15, 2005
Accepted: August 26, 2005
Published online: November 28, 2005
AIM: To introduce a method for culturing nanobacteria from human gallbladder bile.
METHODS: The bile samples were collected from 30 patients with gallbladder-stone. After pretreatment with dilution-centrifuge-filtration (DCF) and filtration method, respectively, those samples were cultured under the ro-utine cell culture condition for nanobacteria. The morp-hological features of the obtained nanobacteria were observed under light and electron microscope. Indirect immunofluorescence staining was used to identify the nanobacteria.
RESULTS: Of the 30 bile samples, the positive rate of nanobacteria was 40% when the samples were pre-treated by DCF method, and the positive rate was 57% when they were pretreated by filtration method. There was no significant difference between those two methods (χ2 = 1.669, P >0.05). Brown movement of the tiny nanobacteria was observed at 2 wk. At 4 wk, nanobacteria started to attach on the bottom of the cul-ture bottles. Specific combination of the obtained nan-obacteria with 8D10 antibodies was observed. The nanobacteria were ball- or stick-like with a length of 80-350 nm under electron microscope.
CONCLUSION: The infection of nanobacteria exists in the bile of gallbladder-stone patients. Filtration is a si-mple and effective method for the preparation of the gallbladder bile.
- Citation: Wang LM, Shen WL, Zhang SL, Cao LY, Wang BQ. Culture of nanobacteria from human gallbladder bile. Shijie Huaren Xiaohua Zazhi 2005; 13(22): 2663-2666
- URL: https://www.wjgnet.com/1009-3079/full/v13/i22/2663.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i22.2663
芬兰科学家Kajander et al[1]进行哺乳动物细胞培养时, 发现细胞内存在一种原核微生物, 能通过100 nm的滤菌器, 遂将此种微生物命名为纳米细菌(nanobacteria, Nb). 研究发现, 在人卵巢癌组织[2]、肾囊肿的囊液[3]、钙化的主动脉瓣膜和心脏瓣膜[4-6]以及胆囊结石患者的胆Ö和胆囊壁中都发现了纳米细菌[7]. 已3/4证实, 纳米细菌可以作为结石形成的核心引起肾结石的形成[8,9]. 本课题组已3/4成功地制作出纳米细菌感染所引起的胆囊黑色结石的动物模型, 研究过程中发现胆汁中纳米细菌的培养是研究的关键之一, 在此简介有关方法与体会.
电视腹腔镜: WOLF, 德国; 倒置相差显微镜: COIC-XSI-D型, 中国; 冷冻离心机: Hettich UNIVERSAL 16R型, 德国; 二氧化碳培养箱: Forma Scientific-3164型, 美国; 超净工作台: SZX-ZPA型, 中国; 细胞培养瓶: 北京中山生物试剂公司, 中国; 25 mm针头式滤器(0.1 mm, 0.22 mm, 0.45 mm孔径): MILLEX-GP, 爱尔兰; 高糖DMEM培养基(pH 7.4, 含L-谷安酰胺): GIBCO, 美国; 胎牛血清(g-FBS): Sigma, 美国; Mouse anti-nanobacteria mAb 8D10: Nanobac Oy, 芬兰; Rabbit anti-mouse IgG-FITC: Sigma, 美国.
1.2.1 病例选择以及胆汁标本收集: 选择手术前无急性胆囊炎发作病史, 本次住院未进行抗菌治疗, 并且拟接受腹腔镜胆囊切除的胆囊结石患者30例, 男性12例, 女性18例, 年龄30-69岁, 平均47岁. 手术前争得患者同意留取胆汁标本. 术中由腹腔中完整取出胆囊后, 立即用无菌注射器穿刺胆囊, 无菌操作抽取胆汁5 mL.
1.2.2 胆汁的预处理: 方法一: 取胆汁1 mL, 生理盐水稀释5倍, 经0.45 μm一次性正压滤器过滤, 12 000 g离心45 min, 小心吸除上清液4 mL, 生理盐水稀释5倍, 经0.22 μm一次性正压滤器过滤, 12 000 g离心45 min, 小心吸除上清液4 mL, 剩余胆汁震荡混匀, 取0.5 mL滤液进行纳米细菌培养. 方法二: 取胆汁1 mL, 生理盐水稀释5倍, 通过一次性输液器滤膜过滤两次后, 依次经0.45 μm和0.22 μm一次性正压滤器过滤, 取0.1 mL滤液进行纳米细菌培养.
1.2.3 纳米细菌培养: 上述胆汁滤液分别加入含100 mL/L γ-FBS的细胞培养基中(DMEM), 在37℃、50 mL/L CO2条件下培养. 以生理盐水代替胆汁, 重复上述操作作为阴性对照. 每周在倒置相差显微镜下观察并记录一次纳米细菌的生长情况.
1.2.4 纳米细菌鉴定: 间接免疫荧光染色在纳米细菌滴片上进行. 首先用含100 mL/LFBS(经培养证实不含纳米细菌)的PBS封闭20 min, 一抗(100 mg/L, mouse monoclonal antibody against nanobacteria 8D10, Nanobac Oy)室温孵育60 min, PBS洗涤5 min×4次, 二抗(1∶40 dilution, Rabbit anti-mouse IgG FITC, Sigma-Aldrich)室温孵育45 min, PBS洗涤5 min×4次, 双蒸水洗涤1 min, 500 mL/L甘油封片, 置荧光显微镜下观察. 以PBS代替8D10抗体作阴性对照.
吸取含纳米细菌的培养液, 12 000 g离心20 min, 弃上清, PBS洗涤沉淀, 25 mL/L戊二醛4℃固定24 h, 双蒸水洗涤5 min×3次, 12 000 g离心后加入0.5 mL双蒸水制成混悬液. 用同样方法制成羟基磷灰石的混悬液, 作为实验对照. 进行负染色时, 将附有碳支持膜的200目Í网浮于上述悬液的液滴上5 min, 用滤纸小心吸除液体, 再置于10 mL/L磷钨酸悬液的液滴上90 s, 用滤纸小心吸除液体、晾干, 在JEM 2010透射电镜下观察, 工作电压80 kV.
30份胆汁标本在细胞培养的条件下, 部分标本可以培养出纳米细菌, 而阴性对照培养液中无纳米细菌生长. 胆汁样本在37℃和50 mL/L CO2存在的条件下, 经过2 wk的培养, 在倒置相差显微镜下可见做布朗运动的微小的颗粒状纳米细菌. 4 wk时, 可见纳米细菌开始贴附于培养瓶底部形成细菌被膜(图1), 此时, 肉眼即可看到在培养瓶的底部附着一层白色颗粒状沉淀.
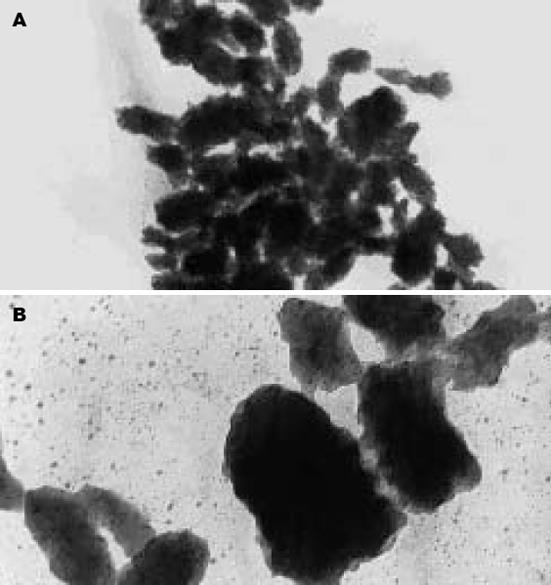
经间接免疫荧光染色, 培养所得纳米细菌与8D10抗体产生特异性结合, 图2中可见发出绿色荧光的纳米细菌. 在以PBS代替8D10抗体的阴性对照中, 未观察到绿色荧光. 纳米细菌经负染后于透射电镜下观察, 呈球形或短棒状颗粒, 大小约为80-350 nm, 聚集成簇状(图3A), 其表面被覆泥样的细菌被膜(biofilm)(图3B).
其中, 按方法一处理后的胆汁, 纳米细菌培养的阳性率为40%(12/30), 而按方法二处理后的胆汁, 纳米细菌培养的阳性率为57%(17/30)(图4). 两种方法进行比较, 纳米细菌阳性率无显著性差异(χ2 = 1.669, P>0.05).
纳米生物(nanobe)指直径(横径)在0.10-100 nm的极微小自由生物, 或直径(横径)在100 nm以下的微生物. 纳米细菌(nanobacteria, 或nannobacteria)一词作为纳米生物的同义词, 现在似乎已成了体积小于正常细菌的微生物的专用名称. 纳米细菌具有独特的生物学特性, 难以用传统的微生物理论诠释. 由于他们体形微小, 难以被常规的细菌学检测方法检出, 而且侵入生物体内的纳米细菌具有独特的生物矿化作用(bio-mineralization), 很难被彻底清除, 因此纳米细菌一经发现, 即在医学界引起了广泛关注, 已成为当前研究的一个热点问题[10-16].
我们选取30位无其他伴发疾病, 并且无胆囊炎症状的单纯胆囊结石患者, 在腹腔镜胆囊切除手术(laparoscopic cholecystectomy, LC)过程中, 于无菌、厌氧条件下留取胆囊结石患者的胆囊胆汁, 进行纳米细菌培养. 结果显示30例胆汁标本在细胞培养条件下, 经过4 wk的培养, 有17份标本可以观察到大量100-350 nm的颗粒物聚集在培养瓶底部.
正常胆汁中存在大量的黏蛋白以及胆砂、胆固醇结晶等多种有形成分. 这些成分的存在, 为从胆汁中分离纳米细菌造成了不小的麻烦, 如何从成分复杂的胆汁中迅速而高效地提取纳米细菌, 成为胆汁纳米细菌研究中一个技术难点. 在本实验中, 我们采用"稀释-离心-过滤法"(方法一)和"过滤法"(方法二), 对相同的30份胆汁样本分别进行纳米细菌的培养. 虽然经方法二处理后的胆汁, 纳米细菌培养阳性率高于方法一处理的胆汁阳性率(图4), 但这种差异无统计学意义, 可以认为两种方法所得结果是一致的. 而方法二的全部处理过程可以在超净工作台内一次完成, 减少了实验过程中的污染机率, 并且方法二不需要超速离心机, 使操作更加简洁, 值得在今后的研究中加以推广和完善.
纳米细菌体积微小, 可通过0.1 μm的滤菌膜, 但不能通过0.05 μm的滤菌膜, 并且常规高压蒸汽灭菌法不能将其灭活, 只有在180℃下烤4 h才可以将其灭活[17]. 因为我们未能得到0.05 μm的滤菌膜, 故而在实验时我们用3层0.1 μm的滤菌膜代替, 以便尽可能减少纳米细菌对试剂的污染, 但这一措施并不能完全避免培养过程中纳米细菌的污染, 从而造成胆汁纳米细菌感染的假阳性结果. 为此, 在开始纳米细菌培养之前, 我们对上述细胞培养基以及在鉴定纳米细菌实验过程中将要使用的各种试剂(包括PBS、FBS、蒸馏水等), 在细胞培养条件下进行长达2 mo的培养, 证实无任何颗粒物生长后才在正式实验中使用; 在实验中所用的玻璃及金属器械、器皿, 均采用干烤灭菌法灭菌(180℃, 4 h), 同时在胆原处理及纳米细菌培养过程中设立阴性对照, 因此胆汁纳米细菌培养的阳性结果是确实、可靠的.
本研究显示, 在胆囊结石患者的胆原中确实存在纳米细菌. 由人胆汁中培养出的纳米细菌极其微小, 其横径仅50-100 nm, 长径90-350 nm, 在普通光学显微镜下几乎无法观测, 但在相差显微镜下却可以比较容易的观测到, 而对其细微结构的观察则只能通过分辨率更高的电子显微镜才能实现.
电编: 张敏 编辑: 潘伯荣 审读: 张海宁
| 1. | Kajander EO, Ciftcioglu N. Nanobacteria: an alternative mechanism for pathogenic intra- and extracellular calcification and stone formation. Proc Natl Acad Sci USA. 1998;95:8274-8279. [PubMed] [DOI] |
| 2. | Sedivy R, Battistutti WB. Nanobacteria promote crystallization of psammoma bodies in ovarian cancer. APMIS. 2003;111:951-954. [PubMed] [DOI] |
| 3. | Hjelle JT, Miller-Hjelle MA, Poxton IR, Kajander EO, Ciftcioglu N, Jones ML, Caughey RC, Brown R, Millikin PD, Darras FS. Endotoxin and nanobacteria in polycystic kidney disease. Kidney Int. 2000;57:2360-2374. [PubMed] [DOI] |
| 4. | Maniscalco BS, Taylor KA. Calcification in coronary artery disease can be reversed by EDTA-tetracycline long-term chemotherapy. Pathophysiology. 2004;11:95-101. [PubMed] [DOI] |
| 5. | Miller VM, Rodgers G, Charlesworth JA, Kirkland B, Severson SR, Rasmussen TE, Yagubyan M, Rodgers JC, Cockerill FR 3rd, Folk RL, Rzewuska-Lech E, Kumar V, Farell-Baril G, Lieske JC. Evidence of nanobacterial-like structures in calcified human arteries and cardiac valves. Am J Physiol Heart Circ Physiol. 2004;287:H1115-H1124. [PubMed] [DOI] |
| 6. | Sommer AP, Oron U, Pretorius AM, McKay DS, Ciftcioglu N, Mester AR, Kajander EO, Whelan HT. A preliminary inves-tigation into light-modulated replication of nanobacteria and heart disease. J Clin Laser Med Surg. 2003;21:231-235. [PubMed] [DOI] |
| 7. | Wang XJ, Liu W, Yang ZL, Wei H, Wen Y, Li YG. The detection of nanobacteria infection in serum of healthy Chinese people. Zhonghua Liuxingbingxue Zazhi. 2004;25:492-494. [PubMed] |
| 8. | Ciftcioglu N, Bjorklund M, Kuorikoski K, Bergstrom K, Kajander EO. Nanobacteria: an infectious cause for kidney stone formation. Kidney Int. 1999;56:1893-1898. [PubMed] [DOI] |
| 9. | Garcia Cuerpo E, Olavi Kajander E, Ciftcioglu N, Lovaco Castellano F, Correa C, Gonzalez J, Mampaso F, Liano F, Garcia de Gabiola E, Escudero Barrilero A. Nanobacteria. An experimental neo-lithogenesis model. Arch Esp Urol. 2000;53:291-303. [PubMed] |
| 10. | Puskas LG, Tiszlavicz L, Razga Z, Torday LL, Krenacs T, Papp JG. Detection of nanobacteria-like particles in human atheroscl-erotic plaques. Acta Biol Hung. 2005;56:233-245. [PubMed] [DOI] |
| 11. | Sommer AP. Primordial proteins and HIV-Part II. J Proteome Res. 2005;4:1022-1024. [PubMed] [DOI] |
| 13. | Silay YS, Altundag K, Altundag O, Atik MA, Ozen M. Bispho-sphonates may inhibit development of atherosclerosis formati-on through its bactericidal effect on nanobacteria. Med Hypotheses. 2005;64:1239-1240. [DOI] |
| 14. | Sommer AP, Pavlath AE. Primordial proteins and HIV. J Proteome Res. 2005;4:633-636. [PubMed] [DOI] |
| 15. | Sommer AP, Wickramasinghe NC. Functions and possible provenance of primordial proteins-Part II: microorganism aggregation in clouds triggered by climate change. J Proteome Res. 2005;4:180-184. [PubMed] [DOI] |
| 16. | Ciftcioglu N, Haddad RS, Golden DC, Morrison DR, McKay DS. A potential cause for kidney stone formation during space flights: enhanced growth of nanobacteria in microgravity. Kidney Int. 2005;67:483-491. [PubMed] [DOI] |
| 17. | Ciftcioglu N, Miller-Hjelle MA, Hjelle JT, Kajander EO. Inhibition of nanobacteria by antimicrobial drugs as measured by a modified microdilution method. Antimicrob Agents Chemother. 2002;46:2077-2086. [PubMed] [DOI] |