修回日期: 2005-05-15
接受日期: 2005-05-21
在线出版日期: 2005-11-15
目的: 探讨麻醉药乌拉坦的副作用及手术造模后需长期饲养的动物麻醉用药的选择.
方法: 将大鼠用乌拉坦(n = 90)及戊巴比妥钠(n = 48)分别进行麻醉, 观察较长期的生存及死亡状态, 并对乌拉坦对动物脏器的影响做了肉眼观察, 度量比较, 扫描电子显微镜下观察肠内壁绒毛, 腺体以及微绒毛的形态特征.
结果: 使用乌拉坦的动物死亡率非常高, 达33.3-40.0%, 死亡动物的内脏严重受损. 使用戊巴比妥钠的大鼠死亡率在假手术组为8.3%,在手术组为6.25%. 假手术组以及手术组与正常组比较, 脾系数极度减小(0.78±0.38, 0.77±0.21 vs 3.44±1.16, P<0.01), 盲肠与回肠直径极度增加(3.20±0.79, 2.23±0.34 vs 1.26±0.24, P<0.01; 1.68±0.44, 1.46±0.36 vs 0.46±0.07, P<0.01), 细胞变性严重. 透射电镜下观察到用乌拉坦19 wk的大鼠, 小肠黏膜上皮细胞明显水肿, 表面有的微绒毛已脱落, 整体数量减少.
结论: 乌拉坦不适用于对手术后需长期饲养的动物进行麻醉, 而戊巴比妥钠可作为术后需长期饲养动物的手术麻醉用药.
引文著录: 王春晓, 曹荣月, 蔡曼玲, 杜鹏, 刘承初, 刘景晶. 乌拉坦和戊巴比妥钠对手术后长期饲养动物的影响. 世界华人消化杂志 2005; 13(21): 2559-2564
Revised: May 15, 2005
Accepted: May 21, 2005
Published online: November 15, 2005
AIM: To explore the side effects of urethane and the anesthetic selection for animals which demand long-term breeding.
METHODS: Sprague Dawley rats were anesthetized by urethane (n = 90) or pentobarbital sodium (n = 48), and the relatively long-term existence and mortality were compared between the two groups. The effects of these two anesthetics on the animal's viscera were observed by naked eyes, and the morphological characteristics of the intestinal villus were observed under electron microscope.
RESULTS: The mortality rate of the rats after urethane administration was extraordinarily high (33.3-40.0%), while the mortality rate of the pentobarbital sodium treated rats was comparatively lower (8.3%). The viscera of these died rats were seriously damaged. In the sham-operation and operation groups, the spleen coefficient was markedly decreased (0.78 ± 0.38, 0.77 ± 0.21 vs 3.44 ± 1.16, P <0.01), and the diameters of the caecum and ileum were notably increased (3.20 ± 0.79, 2.23 ± 0.34 vs 1.26 ± 0.24, P <0.01; 1.68 ± 0.44, 1.46 ± 0.36 vs 0.46 ± 0.07, P <0.01) as compared with those in the normal controls. The denaturalization of the cells was severe. There was obvious edema in the intestinal mucous membrane epithelium of urethane treated rats (19 wk). The overall number of the villi was decreased, and some on the surface were desquamated.
CONCLUSION: Urethane is not suitable in anaesthesia for the animals which demand long-term breeding after operation, while the pentobarbital sodium is a better option.
- Citation: Wang CX, Cao RY, Cai ML, Du P, Liu CC, Liu JJ. Comparison between effects of urethane and pentobarbital sodium on animals demanding long-term breeding. Shijie Huaren Xiaohua Zazhi 2005; 13(21): 2559-2564
- URL: https://www.wjgnet.com/1009-3079/full/v13/i21/2559.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i21.2559
新药进行药理活性研究[1-2]需要动物造模. 手术造模后的动物有的须长期饲养[3-7], 例如骨质疏松症的模型, 按FDA的标准是去除卵巢的雌性大鼠, 需要长期饲养[8-10]. 为使大鼠骨质疏松的状态更加完全, 充分体现药物的治疗作用, 给药安排在去除卵巢后14 wk; 而且给药本身即需要16-24 wk, 即手术后须动物安全存活8-10 mo, 而且此存活期间动物不应产生由麻醉药引起的生理生化异常[11]. 有些麻醉药可引起动物组织﹑细胞的生理生化变化, 在饲养一段时间后才会出现明显的症状, 甚至死亡[12-13]. 探讨如何经济实用, 又能保证数据可靠地选择麻醉用药, 从而避免错误选择麻醉用药而造成结果的不可靠性, 可以使药理工作者站在更高的起点上统筹安排实验, 得到满意的结果.
SD♀大鼠, 体质量180-220 g, 购自上海BK实验动物中心.实验前置动物于室内适应环境1 wk, 室温21-25℃. 乌来糖(乌拉坦, Urethane)和戊巴比妥钠, 均购自中国医药集团上海化学试剂公司, 后者为进口分装.上海精密科学仪器有限公司天平仪器厂生产的JA2003型上皿电子天平, 德国LEICA包埋机, 法国MICROM半自动转移系统切片机, 日本樱花全自动脱水机, 樱花全自动染色仪, 图象分析系统工作站, 美国NIKON五人共览显微镜, NIKON DS-5M-L1一体化数码相机系统, 日本明石制作所生产的ISI-SX-40扫描电子显微镜, 日本产日立600型透射电子显微镜.
SD大鼠110只, 饲养1 wk后, 随机分20只为假手术组, 其余90只在200 g/L乌拉坦ip麻醉(1.0 g/kg)下, 腹位固定, 行双侧卵巢摘除术, 常规无菌手术, 术后缝合, 肌注青霉素﹑链霉素抗感染[14]. 另外60只大鼠随机分取12只为假手术组, 其余48只均在戊巴比妥钠(33-40mg/kg)ip麻醉下, 腹位固定, 行双侧卵巢摘除术[15,16]. 观察外观体态(毛﹑色﹑形); 解剖内脏肉眼检视(颜色﹑外观)-解剖死亡大鼠, 观察内脏各器官形态变化; 光学显微镜下观察细胞形态-将病变组织放入40 g/L甲醛溶液中, 脱水、包埋、常规切片, HE染色, 光镜观察; 扫描电子显微镜下观察肠内壁绒毛﹑腺体以及微绒毛的形态特征-将病变组织放入40 g/L戊二醛溶液中固定, PBS清洗, 10 g/L锇酸固定, 清洗, 乙醇梯度脱水, 丙酮﹑醋酸异戊酯置换, 液态CO2临界点干燥, 镀金, ISI-SX-40扫描电子显微镜下观察, 加速电压20KV; 透射电子显微镜下观察细胞形态以及各种细胞器的形态改变-将病变组织放入4%戊二醛溶液中固定, PBS清洗, 1%锇酸固定, 清洗, 丙酮梯度脱水, 半浸透, 纯浸透, 包埋, 聚合, 半薄切片定位, 超薄切片定位及电子染色, 电子显微镜下观察, 加速电压75 KV. 称取大鼠体重﹑脾脏重以及测量肠直径. 算出脾指数及肠膨胀率, 将各组的脾指数及肠膨胀率做统计学分析. 计算用乌拉坦及戊巴比妥钠麻醉的大鼠在各阶段的死亡率. 计算用乌拉坦及戊巴比妥钠麻醉的大鼠各自的腹部膨胀百分率, 计算有腹部膨胀现象的大鼠在2-12 wk内的死亡率.
手术后各阶段用乌拉坦麻醉的大鼠的死亡率均高于用戊巴比妥钠麻醉的大鼠的相应值. 用乌拉坦麻醉的大鼠腹部膨胀百分率显著高于用戊巴比妥钠麻醉的相应值(35.3% vs 0%). 而且用乌拉坦麻醉的腹部膨胀大鼠的死亡率极高. 用乌拉坦麻醉的手术组90只大鼠1 wk后尚存72只, 其中13只在术后1-2 wk出现明显腹部膨胀现象, 至2 wk时这13只中已有2只死亡. 假手术组20只大鼠在1 wk后尚存者为17只, 其中有6只出现腹部膨胀现象, 至2 wk时死亡例数并未增加. 2 wk后可见病鼠多发生腹部膨胀后继发死亡. 在用戊巴比妥钠麻醉的手术组45只大鼠及假手术组11只大鼠中均未出现腹部膨胀现象. 另外手术组3只, 假手术组1只在手术后几小时内即因麻醉过量死亡(表1).
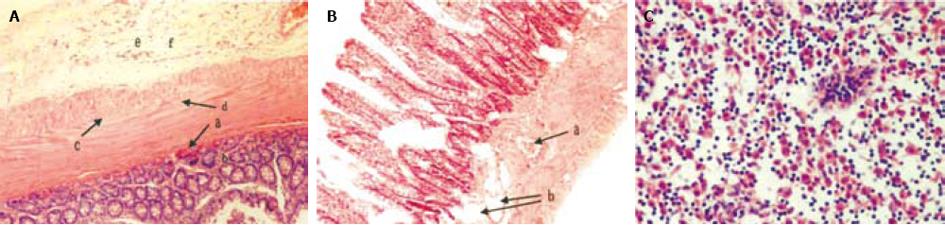
将一腹部膨胀大鼠(图1A, 照片中所用大鼠为用乌拉坦15 wk后尚存活的腹部膨胀大鼠)处死后解剖, 与另一正常大鼠(图1B)的肠部位做一比较, 显示前者的肠(回肠及盲肠)直径是后者的2-4倍(图1C). 光镜照片显示肠黏膜上皮尤其基底部上皮显著嗜酸性变, 间质大量炎细胞浸润, 并见少量嗜酸性细胞浸润. 肌层平滑肌细胞水样变性, 神经节细胞变性, 浆膜层水肿, 血管扩张, 充血, 少量炎细胞浸润. 系膜淋巴结的窦组织细胞增生(图2ABC).
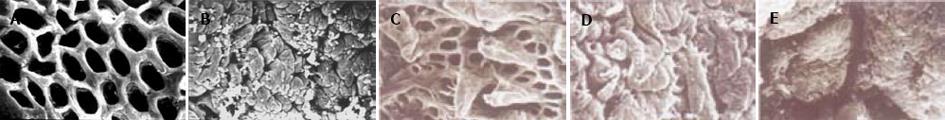
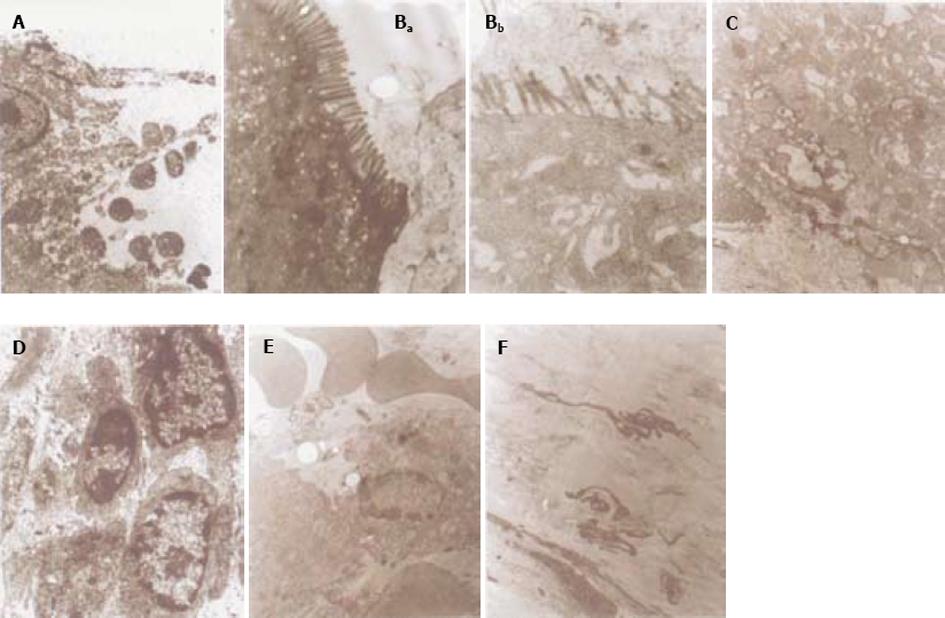
扫描电子显微镜下观察回肠远端及盲肠部位(所用大鼠为用乌拉坦19 wk后尚存活的腹部膨胀大鼠)见肠壁分泌腺的外周细胞有肿胀增生现象, 而回肠最远端的绒毛则有肿胀及破损现象(图3A-E). 透射电镜下小肠黏膜上皮细胞明显水肿, 有些细胞已崩解, 胞膜破裂, 部分胞质成分已流失. 柱状上皮细胞中, 胞内线粒体肿胀, 内质网扩张, 有的地方显示空泡, 已不呈内质网的特定构型; 表面有的微绒毛已脱落, 整体来看数量减少, 分布稀疏, 并有倒伏, 断裂现象. 间质中间有的细胞变性, 并有凋亡趋势; 细胞线粒体肿胀, 空化; 有炎细胞侵润, 可见较多的淋巴细胞; 有出血现象, 血管内皮有肿胀; 细胞有崩解, 有红血球散布到个别细胞中. 浆膜层水肿, 水肿区可见少量成纤维细胞及其突起(图4A-F).
注射过乌拉坦后腹部膨胀大鼠中脾脏严重萎缩说明了其免疫系统被严重破坏[16], 肌层平滑肌细胞及神经节细胞都有变性现象, 小肠各层的细胞有不同程度的变性、崩解, 各种细胞器也有不同程度的恶性改变. 这与乌拉坦具有细胞毒作用相一致[18-21]. 乌拉坦的麻醉作用施加于神经节细胞, 估计是乌拉坦麻醉引起巨肠的原因[22-24]. 乌拉坦的离子通道作用谱与其它麻醉剂是有区别的. 气态的, 可挥发的或可注射的麻醉剂作为一个原发作用(primary action)或者对GABA能神经有兴奋作用, 或者对谷氨酸能神经的神经传递(glutamatergic neurotransmission)有抑制作用; 而乌拉坦对抑制及激动系统都有影响, 在10-300 mmol/L浓度范围是可逆的, 浓度依赖地显著加强GABAA受体和甘氨酸受体的电流反应(增加激动剂的表观亲和力), 加强nACh受体的功能, 可逆地非竞争性地抑制NMDA受体及AMPA受体的反应. 而乌拉坦(上至300 mmol/L)自身对任何研究过的受体都不能产生电流. 与那些只对一种系统有选择性的麻醉剂(如氯胺酮与NMDA受体, 异丙酚与GABAA受体)相比, 乌拉坦引起的变化幅度较小. 乌拉坦的离子通道作用谱较广, 唯一与乌拉坦有类似作用谱的化合物是乙醇[25]. 推测乌拉坦的副作用与其离子通道作用的广谱性存在一定关联.
乙醚是一种较常用的麻醉剂[26-27]. 但用乙醚麻醉持续时间短, 需要在手术过程中不断补充给药; 其剂量不易控制, 并需要特殊装置进行监控[28]及给药. 这使操作者不能全力以赴地进行手术.
水合氯醛也是一种动物实验较常用的麻醉剂. 水合氯醛在通常情况下对血压, 心率及呼吸均无影响, 口服对胃有刺激作用, 皮下给药能导致内脏的炎症反应及无力性肠闭塞. 还有味感差, 腹上部损害(epigastric distress), 恶心, 呕吐, 肠胃气胀的副作用及轻微头痛, 抑郁, 运动失调, 噩梦, 喉痉挛, 悖理的震颤性谵妄等中枢神经系统的危害[29].
国外学者在做卵巢切除手术时是用氯醛酮/赛拉嗪(Ketamine/Xylazine)组合肌内麻醉[30], 但提到了需在整个手术过程随时监控动物的呼吸. 氯醛酮通过对在中脑及下丘脑区域中非特异途径的选择性解体(selective disorganization), 产生痛感丧失﹑健忘症及无意识, 产生中枢交感刺激(central sympathetic stimulation), 伴有体动脉﹑肺动脉压升高, 心率增加, 心输出量增加. 具有催涎及引发痉挛的副作用, 对心律﹑血压有增效(协同)作用[29].
本文采用的另一种麻醉用药戊巴比妥钠起效快, 麻醉持续时间为3-5 h, 给药后对动物循环和呼吸系统无显著抑制. 其价格跟乌拉坦相比似乎相对较贵(中国医药集团上海化学试剂公司: 乌来糖58元/500 g, 戊巴比妥钠490元/25 g), 但由于单位体质量用量少(33-40 mg/kg), 不到乌拉坦(1.0 g/kg)用量的1/20, 因此换算下来麻醉100只体重为250 g的大鼠所需的戊巴比妥钠只需花费人民币约20元[(490元/25 g)×(0.040 g/kg)×(0.25 kg/只)×(100只)=(19.6元)], 与一只大鼠的价钱大体相当.
综合分析比较乌拉坦及戊巴比妥钠麻醉后各自的动物死亡率, 表明戊巴比妥钠更适宜作为术后需长期饲养的动物的手术麻醉用药, 而且是最经济可靠的选择.
此外, 乌拉坦尚可作为发酵的副产物自然产生. 人类对乌拉坦的摄入(无意识地)主要来自发酵食物以及各种酒精饮料. 因此, 相信本文结果对过量饮酒之人以及发酵过程的工艺合理改进亦有一定提示作用[20,31].
电编: 李琪 编辑: 潘伯荣 审读: 张海宁
| 1. | 江 泽民. 《中华人民共和国药品管理法》中华人民共和国主席令第四十五号 2001.2.28. . |
| 2. | 郑 筱萸. 《药品注册管理办法》(局令第17号)国家食品药品监督管理局令第17号 2005.2.28. . |
| 3. | Sun X, Kimura T, Kobayashi T, Noriki S, Imamura Y, Fukuda M, Yamaguchi A. Viability of liver grafts from fasted donor rats: relationship to sinusoidal endothelial cell apoptosis. J Hepatobiliary Pancreat Surg. 2001;8:268-273. [PubMed] [DOI] |
| 4. | Saudek F, Cihalova E, Karasova L, Kobylka P, Lomsky R. Increased glucagon-stimulated insulin secretion of cryopreserved rat islets transplanted into nude mice. J Mol Med. 1999;77:107-110. [PubMed] [DOI] |
| 5. | O'Bichere A, Shurey S, Sibbons P, Green C, Phillips RK. Experimental model of anorectal transplantation. Br J Surg. 2000;87:1534-1539. [PubMed] [DOI] |
| 6. | Gutierrez Gutierrez A, Vargas Aguirre MA, Corona Martha A, Becerra E, Gonzalez Ortega C, Mendoza Hurtado S, Monroy Avendano E, Tovar Caballero G. [Gestation in sheep after autotransplantation with cryopreserved ovarian tissue: evidence for oocyte viability after the freezing and transplantation procedures]. Ginecol Obstet Mex. 2003;71:5-11. [PubMed] |
| 7. | Brodner RA, Markowitz RS, Lantner HJ. Feasibility of intracranial surgery in the primate fetus. Model and surgical principles. J Neurosurg. 1987;66:276-282. [PubMed] [DOI] |
| 8. | Kalu DN. Evaluation of the pathogenesis of skeletal changes in ovariectomized rats. Endocrinology. 1984;115:507-512. [PubMed] [DOI] |
| 9. | FitzPatrick DP, McCormack BAO, Dickson GR. Proceedings of the 8th Annual Conference of the Section of Bioengineering of the Royal Academy of Medicine in Ireland and the 16th Meeting of the Northern Ireland Biomedical Engineering Society, Joint Conference, Sligo, 26th & 27th January, 2002. Published by the Department of Mechanical Engineering, University College Dublin, Belfield, Dublin 4, Ireland, Copyright. 2002;. |
| 10. | Carvalho DCLD, Jr AC. Low intensity ultrasound effects over osteopenic female rats bones. Acta ortop. bras. 2003;11:17-24. [DOI] |
| 11. | Sφgaard CH, Mosekilde L, Thomsen JS, Richards A, McOsker JE. A comparison of the effects of two anabolic agents (Fluoride and PTH) on ash density and bone strength assessed in an osteopenic rat model. Bone. 1997;20:439-449. [PubMed] [DOI] |
| 12. | Kaufman MH, Chang HH. Influence of anaesthetic agent on limb abnormalities observed following amniotic sac puncture. Eur J Morphol. 1998;36:217-226. [PubMed] [DOI] |
| 13. | Brodsky JB. Anesthesia and surgery during early pregnancy and fetal outcome. Clin Obstet Gynecol. 1983;26:449-457. [PubMed] [DOI] |
| 15. | 徐 叔云, 卞 如濂, 陈 修主编. 药理实验方法学. 第3版. 北京: 人民卫生出版社 2001; 1530-1568. |
| 16. | Ima-Nirwana S, Jamaludin M, Khalid BAK, FRACP, Z Merican, and Baharom S. Serum lipids of castrated rats given hormonal replacement and fed diets with added soybean oil or palm oil. Asia Pacific J Clin Nutr. 1995;4:244-248. [PubMed] |
| 17. | Maeda T, Eto M, Nishimura Y, Nomoto K, Kong YY, Nomoto K. Direct evidence for clonal destruction of allo-reactive T cells in the mice treated with cyclophosphamide after allo-priming. Immunology. 1993;78:113-121. [PubMed] |
| 18. | Guidelines for the Use of Anesthesia, Analgesia and Tranquilizers Modified from the CCAC, Guide Vol. 1(2nd Ed.)1993 Chapter XI - Anesthesia. cited 2005-10-21. Available from http: //www.bgsu.edu/offices/spar/orc/iacuc/Guidelines%20for% 2 0Anes,%20Anal,%20Tran.doc. |
| 19. | Appendix F. Appendix F. Guidelines for anesthesia and analgesia in laboratory animals. Portions extracted and modified from University of California, Berkeley Animal Care and Use Training Handbook and Anesthesia and Analgesia in Laboratory Animals, Academic Press 1997; cited 2005-10-21. Available from: http://www.unmc.edu/Education/Animal/guide/appenF1.html. |
| 20. | Toxicology and carcinogensis. Studies of urethane, ethanol, and urethane/ethanol (urethane, CAS No. 51-79-6; ethanol, CAS No. 64-17-5) in B6C3F1 mice (drinking water studies). Natl Toxicol Program Tech Rep Ser. 2004;1-346. [PubMed] |
| 21. | Gorelik E, Herberman RB. Inhibition of the activity of mouse natural killer cells by urethan. J Natl Cancer Inst. 1981;66:543-548. [PubMed] |
| 22. | Sternberg SS, 回允中主译. 诊断外科病理学. 第三版. 北京: 北京大学医学出版社 2003; 1390-1391. |
| 23. | 王 子栋, 徐 有恒. 植物性神经系统生理学-基础与临床. 第一版. 北京: 科学出版社 1994; 234-257. |
| 24. | 张 镜如. 生理学. 第四版. 北京: 人民卫生出版社 1996; 187-188, 210. |
| 25. | Hara K, Harris RA. The Anesthetic Mechanism of Urethane: The Effects on Neurotransmitter-Gated Ion Channels. Anesthetic Pharmacology. 2002;94:313-318. [PubMed] [DOI] |
| 26. | 陈 小野, 邹 世洁, 王 震, 吕 爱平, 艾 景录. 大鼠肾上腺次全切除肾阳虚模型胃、舌病理观察. 中国中医基础医学杂志. 1999;5:20-22. |
| 27. | Kaech S, Brinkhaus H, Matus A. Volatile anesthetics block actin-based motility in dendritic spines. Proc Natl Acad Sci USA. 1999;96:10433-10437. [PubMed] [DOI] |
| 28. | Flegal MC, Kuhlman SM. Anesthesia monitoring equipment for laboratory animals. Lab Anim (NY). 2004;33:31-36. [PubMed] [DOI] |
| 29. | Meade FTGG. Sedation/analgesia patient monitor course. 2001. cited 2005-10-21. Available from: http: //www.narmc.amedd.army.mil/kacc/Employees/Education/monitor.pdf. |
| 30. | Verstegen J, Fargetton X, Donnay I, Ectors F. Comparison of the clinical utility of medetomidine/ketamine and xylazine/ketamine combinations for the ovariectomy of cats. Vet Rec. 1990;127:424-426. [PubMed] |
| 31. | Beland FA, Benson RW, Mellick PW, Kovatch RM, Roberts DW, Fang JL, Doerge DR. Effect of ethanol on the tumorigenicity of urethane (ethyl carbamate) in B6C3F1 mice. Food Chem Toxicol. 2005;43:1-19. [PubMed] [DOI] |