修回日期: 2005-08-20
接受日期: 2005-08-26
在线出版日期: 2005-11-15
目的: 应用载体介导的RNAi技术特异地干扰TGF-β1在人胃癌细胞株SGC-7901和腹膜间皮细胞中的表达.
方法: 使用线性化的pcPUR β iCassette质粒构建针对TGF-β1基因的siRNA表达载体; hU6载体启动子下游插入含TGF-β1基因特异性序列的62 mer寡核苷酸片段; 采用胰蛋白酶-EDTA消化法, 从人的腹膜组织中分离腹膜间皮细胞. 采用形态学和链霉菌抗生物素蛋白-过氧化物酶连接法对培养细胞进行鉴定. 将TGF-β1-siRNA载体转染人的上述两种细胞, 以半定量RT-PCR和Western印迹方法检测转染后两种细胞中TGF-β1的表达水平的变化.
结果: 电泳、DNA测序证实合成的siRNA基因序列正确并已准确克隆入pcPUR β iCassette载体. 免疫组化染色结果显示腹膜间皮细胞角蛋白, 波形蛋白表达阳性, 而白细胞共同抗原(CD45), 第Ⅷ因子相关抗原阴性. 与各自未处理组比较, 两种细胞TGF-β1-siRNA载体组的mRNA和蛋白均明显下降, 并以蛋白下降更为明显. 人胃癌细胞株SGC-7901 TGF-β1蛋白下降约65.8%, 人腹膜间皮细胞TGF-β1蛋白下降约61.8%.
结论: 载体介导的RNAi技术可成功地干扰TGF-β1在人胃癌细胞株SGC-7901和腹膜间皮细胞中的表达, 为今后胃癌腹膜转移的基因靶向治疗奠定了基础.
引文著录: 吴涛, 徐惠绵, 吴晓华, 姜成钢, 于淼. 应用载体介导的 RNAi 技术抑制人胃癌和腹膜间皮细胞中TGF-β1 的表达. 世界华人消化杂志 2005; 13(21): 2530-2534
Revised: August 20, 2005
Accepted: August 26, 2005
Published online: November 15, 2005
AIM: To silence the expression of transforming growth factor-β1 (TGF-β1) gene in human gastric cancer cell line SGC-7901 and peritoneal mesothelial cells using vector based RNA interference (RNAi) technique.
METHODS: A vector, which was used to transcribe functional short interfering RNA (siRNA), was construc-ted, and 62 mer oligonucleotide fragment was inserted into the downstream of the hU6 promoter. Mesothelial cells were isolated from human omenta by trypsin-EDTA disaggregation, and identified by morphology and streptomyces anti-biotin protein-peroxidase meth-od. The plasmids containing TGF-β1 target sequences were transfected into the two kinds of cells menti-oned above, and then the expression level of TGF-β1 was detected by semiquantitive RT-PCR and Western blot technique.
RESULTS: Electrophoresis and DNA sequencing con-firmed that the TGF-β1-specific siRNA was synthesized and cloned into the expression vector pcPUR β iCassette successfully. Immunohistochemistry showed positive staining for cytokeratin and vimentin, but negative staining for leukocyte common antigen and factor VIII-related antigen in cultured mesothelial cells. As compared with their respective untreated group, the TGF-β1 mRNA and protein expression in the two kinds of transfected cells were remarkably decreased, especially TGF-β1 protein. TGF-β1 protein was reduced by a perce-nt of 65.8% and 61.8% in human gastric cancer cell line SGC-7901 and mesothelial cells, respectively.
CONCLUSION: TGF-β1 expression can be notably inh-ibited in human gastric cancer cell line SGC-7901 and peritoneal mesothelial cells using plasmid-based TGF-β1-RNAi technique.
- Citation: Wu T, Xu HM, Wu XH, Jiang CG, Yu M. RNAi-mediated gene silencing of transforming growth factor-β1 expression in human gastric cancer cell line SGC-7901 and peritoneal mesothelial cells. Shijie Huaren Xiaohua Zazhi 2005; 13(21): 2530-2534
- URL: https://www.wjgnet.com/1009-3079/full/v13/i21/2530.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i21.2530
转化生长因子(transforming growth factor)因其功能的多样性而受到广泛的关注. TGF-β1可上调肿瘤细胞的粘附分子表达, 抑制机体免疫细胞活性, 促进肿瘤血管生成等, 与多种肿瘤转移关系密切.[1]同时, TGF-β1不仅刺激细胞或基质的合成,也能抑制细胞外基质的降解,是纤维化过程的中心环节[2], 在腹膜纤维化的病理过程中起重要作用.而胃癌腹膜转移是特殊的肿瘤细胞和腹膜适宜环境相互作用的结果.RNA 干扰(RNA interference,RNAi) 是由双链RNA(double-stranded RNA,DsRNA) 诱导与之同源的mRNA 降解,从而引发的转录后基因沉默机制(post-transcriptional gene silencing ,PTGS). 目前已成功用于基因功能和信号传递系统上下游分子相互关系的研究,有可能成为继反义核酸, 核酶之后的又一新手段[3]. 我们自行构建能在细胞内转录出功能性siRNA 的载体,并将其用于干扰人胃癌细胞株SGC-7901和人腹膜间皮细胞细胞TGF-β1的表达,为胃癌腹膜转移的防治研究奠定基础.
线性化的pcPURβicassette载体, Takara DNA Ligation Kit, EndoFree® Plasmid MAXI Kit, E.coli DH5α Competent Cells, PCR引物, RT-PCR试剂盒购于日本Takara公司.Trizol, FCS, RPMI1640购于Gibco公司.梭华- Sofast基因转染试剂购于厦门太阳马公司.TGF-β1兔抗人多克隆抗体购Santa Cruz公司.抗细胞角蛋白抗体, 抗波形蛋白抗体, 抗白细胞CD45抗体, 抗第VIII因子相关抗原抗体购于福州迈新公司.人胃癌细胞株SGC-7901由中国医科大学细胞生物教研室提供.取择期手术良性病变患者的大网膜,大小约6 cm×6 cm, 严格按无菌要求操作, 摘除血管及脂肪组织.PBS 洗数次后置于2 g/L胰蛋白酶- EDTA 消化液中,37 ℃温箱孵育10 min,取出大网膜置于含200mL/L体积分数的胎牛血清的RPMI-1640培养液中, 用吸管反复吹打15 min, 吸取培养液接种在1 g/L明胶包被的25 cm2 培养瓶中, 37 ℃,体积分数为50 mL/L CO2 培养箱中培养.6 h后轻轻将培养液置于另一个1 g/L明胶包被的25 cm2 培养瓶中继续培养.以后每3 d 换1次培养液, 大约5-7 d可传代, 传至2代, 细胞行免疫组织化学染色鉴定.免疫组织化学染色采用SP 法,行抗人角蛋白, 抗人波形蛋白, 抗人白细胞CD45 , 抗Ⅷ因子相关抗原抗体组化染色.第2, 3 代细胞可用于试验. 刚从大网膜消化下来的间皮细胞在倒置显微镜检镜下为葡萄串状, 大约24 h左右贴壁, 呈多形性, 边缘不整, 以后细胞生长融合呈多角形, 似铺路鹅卵石样外观.免疫组化鉴定细胞角蛋白, 波形蛋白抗原阳性, 白细胞CD45, 第VIII因子相关抗原阴性.
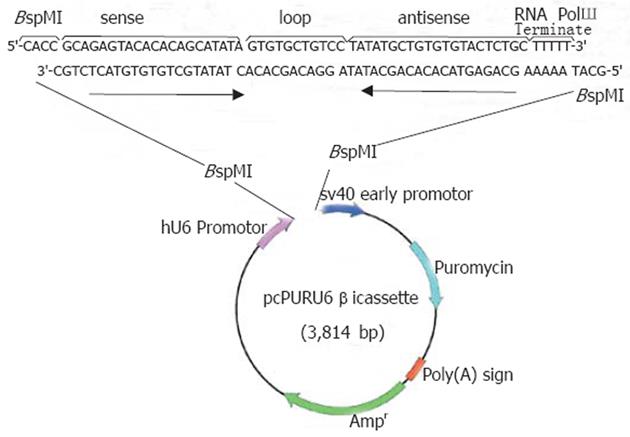
1.2.1 TGF-β1的siRNA表达载体构建: 根据TGF-β1的基因序列, 使用siRNA Design Support System 设计出合适的靶序列5'-GCAGAGTACACACAGCATA-3',NCBI GenBank提供的BLAST软件, 对选择的靶序列进行同源分析, 排除siRNA非特异性抑制其它基因片断的可能.合成编码发夹结构siRNA的正义链(5'-CACCGCAGAGTACACACAGCATATAGTGTG CTGTCCTATATGCTGTGTGTACTCTGCTTTTT-3')和反义链(5'-GCATAAAAAGCAGAGTACACACAGCATATAGGACAGCACACTATATGTCGTGTGTACTCTGT-3'), 正、反义链均为62mer的寡核苷酸片段, 退火, 形成双链DNA.反应体系: 取正、反义链(浓度均为100 mg 1 g/L)5.0 μL; 条件: 99℃ 2 min, 72℃ 90 min, 缓慢降温到30℃, 4℃保存.退火产物用dH2O 稀释 20倍, 取1 μL 进行401 g/L 琼脂糖凝胶电泳.使用TaKaRa DNA Ligation Kit中的SolutionⅠ, 将目的片段与pcPUR β icassette载体连接后, 热转化至E.coli DH5α Competent Cells中, 涂布平板后, 37℃过夜培养.检菌、挑选阳性菌落植菌, 提取质粒后进行测序, 结果符合要求.再挑取菌落植菌, 过夜培养.使用 EndoFree® Plasmid MAXI Kit, 进行去掉内毒素的质粒提取.使用100 μL Endotoxin-free TE buffer充分溶解, 取1 μL 稀释 10 倍后, 取1 μL 进行10 g/L 琼脂糖凝胶电泳.本实验同时设计G: C: A: T同样为4: 5: 8: 2的非特异性序列5'-GACTAGGTAGCCAAACCAA-3'为阴性对照组, 经BLAST软件排除非特异性抑制其它基因片段的可能, 通过上述相同方法构建非特异性片段的siRNA表达载体. 见图为TGF-β1特异性表达载体构建示意图(图1).
1.2.2 人胃癌细胞株SGC-7901和人腹膜间皮细胞细胞转染: 转染前1d, 将对数生长期的人胃癌细胞株SGC-7901和人腹膜间皮细胞分别以4×105和6×105个/孔接种于6孔板上, d2当细胞融合达60%左右时进行转染.实验分4组: (1)对照组: 加入RPMI1640培养液200 μL; (2)TGF-β1 - siRNA表达载体组: 2 μg特异性质粒及4 μL so-fast转染试剂复合物, 稀释液总体积200 μL; (3)非特异性片段表达载体组: 2 μg非特异性质粒及4 μL so-fast转染试剂复合物, 稀释液总体积200 μL; (4)空白载体组: 加入4 μL so-fast转染试剂和196 μL RPMI1640培养液.具体操作步骤按说明书执行.于转染后72 h弃培养液, PBS冲洗2次, 加入Trizol提取各实验组细胞的总RNA. 实验步骤按试剂说明进行, 将沉淀的RNA进行干燥处理, 用无RNase 污染的水将RNA溶解, 在260-280 nm测吸光度A值, 要求A260/A280≥2.0, 并计算出RNA含量, 并用其合成cDNA, 反应体系: 30℃ 10 min,45℃ 30 min,99℃ 5 min,99℃5 min.人TGF-β1引物上游从基因的第894个碱基开始5'-CAACAATTCCTGGCGATACCTCA-3',下游引物从基因的第1279个碱基开始, 5'-ATCCACTTCCAGCCGAGGTCCTT-3', 扩增长度为386bp.内参照(人β-actin)上游引物为5'-AAATCGTGCGTGACATTAA-3',下游引物5'-CTCGTCATACTCCTGCTTG-3', 扩增片段长度为381bp.反应体系: 94℃ 3 min,57.5℃30 s,72℃ 1 min,循环30次. PCR产物在15 g/L的琼脂糖凝胶中电泳(电泳仪为: DYY-III 33A型), 于自动电泳凝胶成像分析系统(Chemi Imager 5500, AlPha InnCh, USA)下成像, FluorChen V.2.0系统采集扩增条带的整合吸光度A值,作为电泳条带的强度指标, 以β-actin为内对照, 并以β-actin表达条带的强度为标准, 采用各条带A值与相应β-actinA值的比值作为指标进行比较, 重复试验3次.转染72h后, 胰蛋白酶消化细胞, PBS冲洗2次, 加细胞裂解液(50 mmol/L Tris.cl, 1mmol/L EDTA, 20 g/L SDS, 5 mmol/L DTT, 10 mmol/LPMSF)裂解, 超声破碎, Bradford方法测定细胞蛋白浓度.细胞蛋白样品于100℃水浴5 min.将各组细胞样品的蛋白浓度调整一致后, 各取20 μL上样进行SDS-PAGE, 电泳完毕后, 将凝胶中的蛋白转移至PVDF膜上, PVDF膜以含2%脱脂奶粉的TTBS室温封闭2 h, 加TGF-β1多克隆抗体(工作浓度1: 200), 4℃孵育过夜, 鼠抗兔二抗(1: 2000)室温孵育2 h, ECL试剂于暗室自显影.于自动电泳凝胶成像分析系统(Chemi Imager 5500, AlPha InnCh, USA)下成像, FluorChen V.2.0系统采集扩增条带的整合光密度值,作为条带的强度指标.重复试验3次.
统计学处理 采用SPSS11.5软件对各实验数据进行统计分.
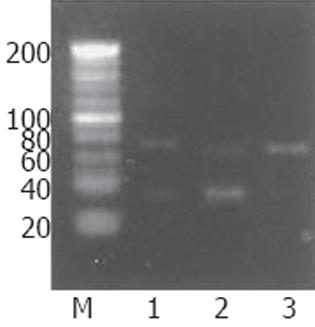
退火产物各用dH2O 稀释20倍, 取1 μL 进行40 g/L 琼脂糖凝胶电泳, 电压150V(图2).
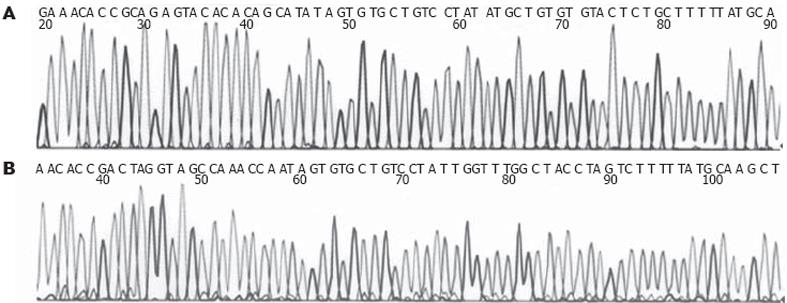
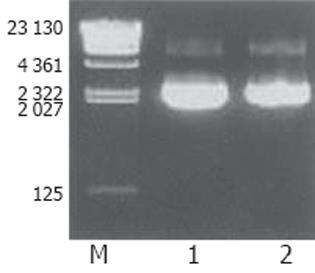
基因测序证实合成的siRNA基因序列正确, 并已准确克隆入线性化的pcPURβicassette载体中, 质粒符合要求(图3). 表达载体构建成功后为环形结构, 去掉内毒素的质粒经100 μL Endotoxin-free TE buffer充分溶解, 取1 μL 稀释10 倍后, 再取1 μL 进行10 g/L 琼脂糖凝胶电泳(图4).
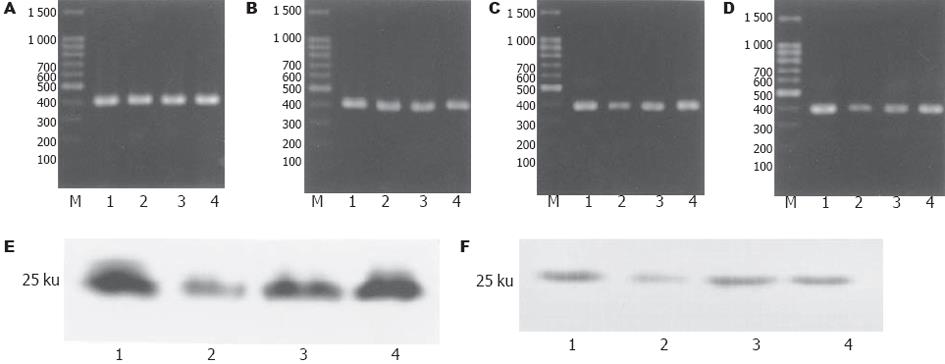
人胃癌细胞株SGC-7901和腹膜间皮细胞的内参照β-actin扩增产物, 均在381bp处出现基因条带(图5AB).两种细胞的各处理组之间条带亮度基本相同; 人胃癌细胞株SGC-7901和人腹膜间皮细胞TGF-β1扩增产物, 均在386bp处出现基因条带(图5CD).蛋白印记显示人胃癌细胞株SGC-7901和腹膜间皮细胞均表达25kd的产物. 人胃癌细胞株SGC-7901和腹膜间皮细胞的TGF-β1-siRNA表达载体组和各自对照组相比较, TGF-β1 mRNA和蛋白均下降显著, 有统计学意义.其中蛋白下降水平更为明显, 分别下降65.8%和61.8%(图5EF).
在胃癌转移复发因素中, 腹膜种植性转移最为多见, 导致以顽固性腹水为特征的癌性腹膜炎, 是胃癌患者最主要的死亡原因.腹膜转移是特殊的肿瘤细胞和腹膜适宜环境相互作用的结果.TGF-β1是一种多功能生长调节因子,可能成为胃癌腹膜转移治疗的重要靶点. TGF-b1可使间皮细胞变形,腹膜纤维化; TGF-b1可使胃癌细胞表达的粘附分子如CD44表达增多; 抑制腹腔内淋巴细胞活性使其无法有效的杀伤腹腔内游离癌细胞以及血管生成等[4-6]. 我们证实人胃癌细胞株SGC-7901及原代培养的人腹膜间皮细胞均有TGF-b1表达.RNAi (RNA interference)技术通过导入一段与内源基因同源的dsRNA序列,可以高效、特异地降解有关基因的mRNA ,诱使细胞表现出特定基因缺失的表型[7]. Spankuch-Schmitt et al[8]在乳腺癌细胞系, 子宫颈癌细胞系, 结肠癌细胞系等细胞中进行了成功的RNA 干扰实验,并观察到癌细胞增殖明显减少, 凋亡显著增加.而直接向细胞内导入siRNA 存在基因沉默维持时间短, 体内运载难和转染效果不稳定等问题,因此限制了该技术的应用,而利用载体介导的RNAi技术将有望克服上述困难[9]. 鉴于此,我们以人胃癌细胞和腹膜间皮细胞这一对相互作用的细胞作为研究对象, 以TGF-b1基因作为靶分子, 通过自行构建能在细胞内转录出功能性siRNA 的载体,探讨其对TGF-b1表达的影响.本研究应用siRNA Design Support System, 主要参照了Elbashir[10]的经验,对其中反向互补的19 mer目的基因序列的选择按照以下原则: siRNA序列的长度设计为21个碱基(Target 19个碱基+Overhang 2个碱基)较为有效; GC含量为50%左右时最佳, 过高的G%+C%会带来操作上的困难,如退火、测序鉴定等,并且由于其在62 mer 插入片段中呈反向互补排列,可能会影响其在细胞内转录.通常在编码区域(Coding Region: CDS)内进行设计, 但为了避开转录翻译因子的结合位置, 应在起始密码子后的50-100个碱基后进行设计.使用Pol III Promoter进行转录时, 如遇上4个碱基的T或A的连续结构(即TTTT或AAAA)时, 其转录反应会被终止.因此, 具有4个碱基的T或A的连续结构的序列不适用于使用Pol III Promoter的表达载体. 具有G或C的4个碱基以上的连续结构(即: GGGG或CCCC), 容易形成复杂的立体结构, 最好不要使用.注意设计特异性较好的序列, 不要设计和其它基因具有较高同源性的siRNA序列. 包含这段双链DNA的质粒载体转染到细胞之后, 在RNA聚合酶Ⅲ的作用下, 以负链为模板, 从起始位点开始转录, 转录出的RNA由于具有回文序列, 会形成一个发卡样结构, 从而得到了双链RNA.片段后面加了5个胸腺嘧啶, RNA转录到这个位置时就会终止.而且转录出的RNA形成发卡样结构后, 会在3'端形成2个突出的尿嘧啶, 这类似于天然的siRNA,因而有利于双链RNA诱发RNAi. 最有效的siRNA 双链长度为21个核甘酸, 包括19bp 的双链序列. 通过电泳及质粒测序证实合成的siRNA基因序列正确, 并已准确克隆入pcPURβicassette载体, 符合要求.最后通过对人胃癌细胞株SGC-7901和人腹膜间皮细胞细胞进行干扰, TR-PCR和Western蛋白印迹结果显示TGF-b1-siRNA载体可以显著特异性地在基因转录和蛋白表达两个水平上抑制上述两种细胞TGF-b1的表达, 这就为今后胃癌腹膜转移的阻断治疗提供了新的思路及依据.
电编: 张敏 编辑: 潘伯荣 审读: 张海宁
| 1. | Ye SC, Foster JM, Li W, Liang J, Zborowska E, Venkateswarlu S, Gong J, Brattain MG, Willson JK. Contextual effects of transforming growth factor beta on the tumorigenicity of human colon carcinoma cells. Cancer Res. 1999;59:4725-4731. [PubMed] |
| 2. | Border WA, Noble NA. Transforming growth factor beta in tissue fibrosis. N Engl J Med. 1994;331:1286-1292. [PubMed] [DOI] |
| 3. | Hammond SM, Caudy AA, Hannon GJ. Post-transcriptional gene silencing by double-stranded RNA. Nat Rev Genet. 2001;2:110-119. [PubMed] [DOI] |
| 4. | Nakashio T, Narita T, Akiyama S, Kasai Y, Kondo K, Ito K, Takagi H, Kannagi R. Adhesion molecules and TGF-beta1 are involved in the peritoneal dissemination of NUGC-4 human gastric cancer cells. Int J Cancer. 1997;70:612-618. [PubMed] [DOI] |
| 5. | Choi YH, Choi KC, Park YE. Relationship of transforming growth factor beta 1 to angiogenesis in gastric carcinoma. J Korean Med Sci. 1997;12:427-432. [PubMed] [DOI] |
| 6. | Yoon SJ, Heo DS, Kang SH, Lee KH, Kim WS, Kim GP, Lee JA, Lee KS, Bang YJ, Kim NK. Natural killer cell activity depression in peripheral blood and ascites from gastric cancer patients with high TGF-beta 1 expression. Anticancer Res. 1998;18:1591-1596. [PubMed] |
| 7. | Bernstein E, Caudy AA, Hammond SM, Hannon GJ. Role for a bidentate ribonuclease in the initiation step of RNA interferen- ce. Nature. 2001;409:363-366. [PubMed] [DOI] |
| 8. | Spankuch-Schmitt B, Bereiter-Hahn J, Kaufmann M, Strebhardt K. Effect of RNA silencing of polo-like kinase-1 (PLK1) on apoptosis and spindle formation in human cancer cells. J Natl Cancer Inst. 2002;94:1863-1877. [PubMed] [DOI] |