修回日期: 2005-09-29
接受日期: 2005-09-30
在线出版日期: 2005-10-28
目的: 观察磷酸化黏着斑激酶(phosphorylated focal adhesion kinase, phospho-FAK)在结肠癌组织和对应癌旁组织中的表达, 探讨其在结肠癌发病的可能机制.
方法: 采用Western bloting方法检测20例新鲜结肠癌及相对应的癌旁组织FAK表达水平, 并在调平每对组织FAK的含量后再进行FAK Tyr397磷酸化蛋白的检测.
结果: 20例结肠癌组织FAK阳性表达率为95%, 对应癌旁组织FAK阳性表达率为60%(χ2 = 5.16, P<0.05); 癌组织表达平均值为0.482±0.150, 癌旁表达平均值为0.269±0.015(t = 6.39, P<0.01). 20例结肠癌组织18例有FAK Tyr397磷酸化蛋白表达, 表达率为90%, 而对应癌旁组织仅有4例有FAK Tyr397磷酸化蛋白表达, 表达率为20%(χ2 = 17.1, P<0.01); 癌组织表达平均值为0.385±0.021, 癌旁表达平均值为0.110±0.005(t = 54.23, P<0.01).
结论: FAK特别是FAK Tyr397磷酸化蛋白的表达水平增加在结肠癌的发生、发展中可能起重要作用.
引文著录: 刘启胜, 于红刚, 齐元玲, 曹俊, 罗和生, 于皆平. 磷酸化黏着斑激酶在结肠癌中表达及意义. 世界华人消化杂志 2005; 13(20): 2490-2493
Revised: September 29, 2005
Accepted: September 30, 2005
Published online: October 28, 2005
AIM: To investigate the expression of phosphorylated focal adhesion kinase (phospho-FAK) and its signific-ance in human colon carcinoma.
METHODS: The phospho-FAK (including FAK) expre-ssion was detected by Western bloting in 20 cases of colon carcinoma and their corresponding para-cancer tissues.
RESULTS: The positive rate of FAK expression in the cancer tissues was significantly higher than that in the corresponding normal tissues (95% vs 60%, χ2 = 5.16, P <0.05). The mean level of FAK expression in the cancer tissues was 0.482±0.150, while the mean level of expression in the normal tissue was 0.269±0.015 (t = 6.39, P <0.01). The positive rate of Tyr-397 FAK protein expression in the cancer tissues was 90%, while the positive rate in the corresponding normal tissues was only 20% (χ2 = 17.1, P <0.01). The mean level of Tyr-397 FAK protein expression in the cancer tissue was notably higher than that in the corresponding para-cancer tissues (0.385±0.021 vs 0.110±0.005, t = 54.23, P <0.01).
CONCLUSION: The up-regulation of FAK expression, especially Tyr-397 FAK protein expression, may play an important role in the tumorigenesis and progression of colon carcinoma.
- Citation: Liu QS, Yu HG, Qi YL, Cao J, Luo HS, Yu JP. Expression and significance of phosphorylated focal adhesion kinase in colon carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(20): 2490-2493
- URL: https://www.wjgnet.com/1009-3079/full/v13/i20/2490.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i20.2490
结肠癌是常见的消化系统恶性肿瘤, 随着生活条件的改善, 饮食西化, 我国结肠癌发病率上升趋势非常明显, 但其发病机制尚未完全明确. 黏着斑激酶(focal adhesion kinase, FAK)是一种非受体蛋白酪氨酸激酶, 分布在细胞黏着斑部位, 相对分子质量为Mr 125 000, 是整合素介导的细胞与细胞外基质之间信号事件的关键性调节分子, 参与调节细胞的多种生物学功能[1]. 研究表明, 在多种肿瘤组织中都有FAK特别是磷酸化FAK表达显著增加, 且磷酸化FAK的表达与肿瘤的发生及生物学行为(如增殖、凋亡、黏附、迁移等)有一定的相关性. 为此我们采用western bloting方法在组织水平上进一步证实FAK在结肠癌组织及对应癌旁组织中的表达, 特别是对于对肿瘤侵袭和转移密切相关的磷酸化形式的FAK, 以探讨它们的表达与结肠癌发病的关系.
1.1.1 组织标本: 收集武汉大学人民医院及中南医院2005-02/2005-07手术切除的结肠癌新鲜标本20例. 每例手术切除的标本均取癌组织、对应癌旁组织(距癌组织>5 cm)各1份, 液氮冷冻后置-70℃冰箱保存. 所有标本均经HE染色病理证实, 其中男12例, 女8例, 年龄25-79岁(平均56.2岁), 所有患者术前均未接受放、化疗.
1.1.2 主要试剂: 兔抗FAK多克隆抗体(cell signaling), 兔抗磷酸化FAK Tyr397多克隆抗体(upstate biotechnology). 羊抗兔IgG-HRP, 预染蛋白Mark-er(pierce signaling). ECL试剂盒(Santa Cruz Biotechnology). 硝酸纤维素膜(Amersham). Aprotinin、Leupeptin、Pepstalin、PMSF等(武汉天源生物技术公司).
1.2.1 总蛋白的提取: 取约100 mg组织标本, 加入1 mL组织裂解液(50 mmol/L Tris-HCl, 150 mmol/L NaCl, 10 g/L脱氧胆酸钠, 10 mL/L NP40, 10 g/L SDS, Aprotinin、Leupeptin、Pepstalin均为1 g/L, PMSF 1 mmol/L), 匀浆, 操作均在冰上进行. 13 000 g, 4℃离心10 min. 取上清置于Ep管. 用Bradford法测定蛋白浓度.
1.2.2 Western bloting: 参照《分子克隆》中的实验方法, 以β-actin的水平作为等量蛋白质上样对照, 每个标本至少重复3次进行SDS-PAGE电泳, 并转至硝酸纤维素膜上, 室温封闭2 h后, 用TBST缓冲液漂洗3次, 再加入兔抗人FAK抗体(1∶1 000), 4℃孵育过夜, TBST缓冲液漂洗3次后加入辣根过氧化物酶标记的羊抗兔IgG二抗(1∶2 000), 室温摇床孵育2 h, 增强化学发光系统显色, 暗室内X光底片感光成像.
采用法国Bio-profil图像分析系统对western印迹结果进行图像分析, 并根据条带的积分吸光度值对FAK进行蛋白量的调平, 使每对组织中所含FAK的蛋白量相等, 再用同样方法对FAK Tyr397磷酸化蛋白行western印迹检测(方法同上), 以比较调平后每对组织FAK Tyr397磷酸化蛋白的表达差异. 将每个样本FAK的积分光密度值与β-actin的积分光密度值相比, FAK Tyr397磷酸化蛋白的积分光密度值与相应调平后FAK的积分光密度值相比, 分别得出积分光密度比值. 以比值代表它们的蛋白质含量.
统计学处理 计数资料采用卡方检验和四格表的精确概率法, 计量资料采用t检验, 均以P<0.05为有统计学差异.
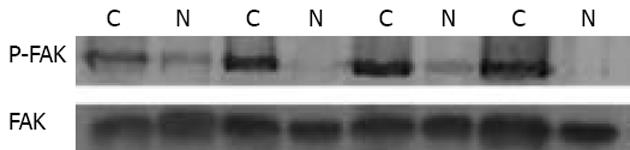
20例结肠癌组织中有19例可见不同浓度的FAK阳性带(图1), 其在结肠癌组织的阳性表达率为95%, 而对应癌旁组织有12例出现不同浓度的FAK阳性带, 阳性表达率为60%(χ2 = 5.16, P<0.05, 表1), 在与β-actin的积分光密度值相比中癌组织表达平均值为0.482±0.150, 癌旁表达平均值为0.269±0.015, FAK在结肠癌组织的表达水平高于癌旁组织(t = 6.39, P<0.01, 表1).
2.2 在把每对组织的FAK含量调为一致后, 20例结肠癌组织中有18例可见不同浓度的FAK Tyr397磷酸化蛋白阳性带(图2), 表达率为90%, 而对应癌旁组织仅有4例出现较低浓度的FAK Tyr397磷酸化蛋白阳性带, 表达率为20%(χ2 = 17.1, P<0.01, 表1), 在与对应的FAK积分光密度值相比中, 癌组织表达平均值为0.385±0.021, 癌旁表达平均值为0.110±0.005(t = 54.23, P<0.01, 表2).
FAK是Schaller et al 1992年发现的能使Src内源性蛋白酪氨酸激酶激活的主要底物, 是一种重要的非受体蛋白酪氨酸激酶(non-receptor protein tyrosine kinases)[1]. FAK并不是癌基因, 但其在肿瘤中表达明显增高. 国内外众多学者报道了FAK在不同来源的肿瘤中均表达上调[2-5], 并与肿瘤的浸润转移存在密切关系. FAK有6个可以被磷酸化的酪氨酸位点, 其中Tyr397为自主磷酸化位点, 是一个极其重要的磷酸化位点. 当黏着斑形成后, Tyr397首先发生自身磷酸化, 同时Tyr397磷酸化后可以直接与含SH2结构区域的信号分子如Src、PI-3K等结合. Src与FAK两者结合形成FAK/Src复合物后能够彼此激活, 活化的Src可催化FAK的其他酪氨酸磷酸化位点使其发生磷酸化, 从而使FAK完全激活[6], 亦使FAK信号传导通路活化, 启动下游相应的重要事件发生. Tyr397作为整个事件的启动点, 其作用显得尤为突出[7], 因此Tyr397的磷酸化水平可反映胞内FAK的活化状况. 最近也发现在结肠腺瘤向结肠癌的转化过程中, FAK特别是FAK Tyr397磷酸化蛋白的表达逐渐升高[8].
目前关于临床肿瘤标本中FAK磷酸化状态的报道尚少, 在本实验中, 我们采用免疫印迹方法测定FAK和Tyr397-FAK, 它比单纯测定FAK更能反应肿瘤的演变过程、侵袭和转移等生物学行为. 本实验结果也显示Tyr397-FAK磷酸化蛋白在癌及癌旁组织中的表达率及表达水平均有明显差异.
FAK介导多条信号传导通路, 是细胞内多条信号传导通路的交汇点. 许多因子都可激活FAK使其磷酸化, 而磷酸化FAK表达的上调被认为在肿瘤发生、发展多个方面中起着重要作用, 诸如增殖、扰乱细胞-细胞接触、运动、侵袭、抗凋亡以及血管生成等[9]. 我们通过敏感性很高的western bloting方法直接比较结肠癌组织和相对应癌旁组织的FAK蛋白表达, 而且为了更好的说明FAK Tyr397磷酸化蛋白的重要性, 特意调平每对组织的FAK蛋白后再次比较FAK Tyr397磷酸化蛋白表达, 而不是在总蛋白量相同下进行比较, 这样就使研究在相同的遗传背景下进行, 从而提高结果的可信度. 本实验结果表明结肠癌组织中FAK蛋白和FAK Tyr397磷酸化蛋白的表达均高于对应的癌旁组织. 特别是在FAK蛋白表达相同的情况下, 癌组织与癌旁组织中的FAK Tyr397磷酸化蛋白表达仍然有明显差异性, 这可能说明在肿瘤的发生、发展中起关键作用的是活化的FAK蛋白, Yu et al[10]和Glover et al[11]从细胞水平也分别证实FAK Tyr397磷酸化蛋白随刺激因素的时间和剂量增加而增加, 且有明显的因果关系, 刺激的作用是引起FAK Tyr397磷酸化, 而不是促进FAK蛋白的表达, 在许多癌旁组织中也有中低度表达的FAK, 这可能是因为FAK本身并不是癌基因的缘故, FAK在成熟组织和许多细胞株中均可能有表达, 但只是表达强度较弱, 而FAK Tyr397磷酸化蛋白在癌旁组织中几乎无表达, 这更加说明了磷酸化的FAK在肿瘤的多个方面所起到的重要作用. 细胞实验中增加FAK的磷酸化可促进细胞运动、增加细胞侵袭力等细胞生物学改变[12,13], 这说明了磷酸化的FAK在肿瘤的发生、浸润、转移中起重要的作用. 我们同样认为结肠癌由于磷酸化FAK表达的增加, 导致肿瘤发生并加速恶性细胞的增殖、浸润和转移. 因此测定FAK Tyr397磷酸化蛋白的表达比单纯测定FAK更能有效预示肿瘤的发生、发展和预后, 可以作为一个肿瘤标记物.
有基于此, 通过应用FAK磷酸化抗体、抑制剂[14]及其过表达FAK的显性负抑制子(FAK-related non-kinase, FRNK)[15]等可抑制FAK的磷酸化, 来达到抑制癌细胞增殖、降低侵袭力、运动及转移等, 这有望成为结肠癌治疗的新领域.
电编: 张敏 编辑: 菅鑫妍 审读: 张海宁
| 1. | Parsons JT. Focal adhesion kinase: the first ten years. J Cell Sci. 2003;116:1409-1416. [PubMed] [DOI] |
| 2. | Weiner TM, Liu ET, Craven RJ, Cance WG. Expression of focal adhesion kinase gene and invasive cancer. Lancet. 1993;342:1024-1025. [PubMed] [DOI] |
| 3. | Parsons JT, Martin KH, Slack JK, Taylor JM, Weed SA. Focal adhesion kinase: a regulator of focal adhesion dynamics and cell movement. Oncogene. 2000;19:5606-5613. [PubMed] [DOI] |
| 4. | Lark AL, Livasy CA, Calvo B, Caskey L, Moore DT, Yang X, Cance WG. Overexpression of focal adhesion kinase in primary colorectal carcinomas and colorectal liver metastases: imm-unohistochemistry and real-time PCR analyses. Clin Cancer Res. 2003;9:215-222. [PubMed] |
| 5. | Schneider GB, Kurago Z, Zaharias R, Gruman LM, Schaller MD, Hendrix MJ. Elevated focal adhesion kinase expression facilitates oral tumor cell invasion. Cancer. 2002;95:2508-2515. [PubMed] [DOI] |
| 6. | Ruest PJ, Roy S, Shi E, Mernaugh RL, Hanks SK. Phospho-specific antibodies reveal focal adhesion kinase activation loop phosphorylation in nascent and mature focal adhesions and requirement for the autophosphorylation site. Cell Growth Differ. 2000;11:41-48. [PubMed] |
| 7. | Fu YM, Zhang H, Ding M, Li YQ, Fu X, Yu ZX, Meadows GG. Specific amino acid restriction inhibits attachment and spreading of human melanoma via modulation of the integrin/focal adhesion kinase pathway and actin cytoskeleton remodeling. Clin Exp Metastasis. 2004;21:587-598. [PubMed] [DOI] |
| 8. | Cance WG, Harris JE, Iacocca MV, Roche E, Yang X, Chang J, Simkins S, Xu L. Immunohistochemical analyses of focal adhesion kinase expression in benign and malignant human breast and colon tissues: correlation with preinvasive and invasive phenotypes. Clin Cancer Res. 2000;6:2417-2423. [PubMed] |
| 9. | Schlaepfer DD, Mitra SK. Multiple connections link FAK to cell motility and invasion. Curr Opin Genet Dev. 2004;14:92-101. [PubMed] [DOI] |
| 10. | Yu HG, Schrader H, Otte JM, Schmidt WE, Schmitz F. Rapid tyrosine phosphorylation of focal adhesion kinase, paxillin, and p130Cas by gastrin in human colon cancer cells. Biochem Pharmacol. 2004;67:135-146. [PubMed] [DOI] |
| 11. | Glover S, Delaney M, Dematte C, Kornberg L, Frasco M, Tran-Son-Tay R, Benya RV. Phosphorylation of focal adhesion kinase tyrosine 397 critically mediates gastrin-releasing peptide's morphogenic properties. J Cell Physiol. 2004;199:77-88. [PubMed] [DOI] |
| 12. | Mukai M, Iwasaki T, Tatsuta M, Togawa A, Nakamura H, Murakami-Murofushi K, Kobayashi S, Imamura F, Inoue M. Cyclic phosphatidic acid inhibits RhoA-mediated autopho-sphorylation of FAK at Tyr-397 and subsequent tumor-cell invasion. Int J Oncol. 2003;22:1247-1256. [PubMed] |
| 13. | Hauck CR, Sieg DJ, Hsia DA, Loftus JC, Gaarde WA, Monia BP, Schlaepfer DD. Inhibition of focal adhesion kinase expression or activity disrupts epidermal growth factor-stimu-lated signaling promoting the migration of invasive human carcinoma cells. Cancer Res. 2001;61:7079-7090. [PubMed] |
| 14. | Nolan K, Lacoste J, Parsons JT. Regulated expression of focal adhesion kinase-related nonkinase, the autonomously expressed C-terminal domain of focal adhesion kinase. Mol Cell Biol. 1999;19:6120-6129. [PubMed] [DOI] |