修回日期: 2005-09-01
接受日期: 2005-09-06
在线出版日期: 2005-10-28
目的: 探讨熊胆粉对二甲基亚硝胺(dimethylnitrosamine, DMN)诱发大鼠肝纤维化的抑制作用.
方法: 将30只大鼠随机分为正常组、模型组及熊胆组, 每组各10只. 用10 g/L DMN腹腔注射诱发大鼠肝纤维化模型, 用400 mg/kg熊胆粉灌胃共4 wk, 检测血清AST、ALT值和总蛋白(TP)含量. 肝组织做HE、直接红染色, 观察肝组织的病理变化, 并检测肝组织内胶原纤维的面密度. 免疫组化采用SP法, 利用单克隆抗体ED1和α-SMA观察库普弗细胞(Kupffer cell, KC)和肝星状细胞(hepatic satellite cell, HSC)的数量及分布.
结果: 熊胆组与模型组比较血清ALT值下降, AST值明显下降(4 370.87±1 338.60 nkat/L vs 5 741.15±1 000.20 nkat/L, P<0.05), TP升高, 肝/体质量比增加, 胶原纤维的面密度明显下降(6.73±1.31 vs 9.90±1.93, P<0.01). 熊胆组肝组织病理变化较模型组轻, 纤维间隔变细、或消失, 形成弥漫性肝硬化的少. KC和HSC在增生的纤维组织及间隔内分布, 熊胆组两种细胞的数量明显减少.
结论: 熊胆粉具有较好的抑制DMN诱发大鼠肝纤维化的作用, 其机制可能与抑制KC, 减少细胞因子的分泌, 从而抑制HSC的激活和转化, 减少胶原纤维合成和分泌有关.
引文著录: 权明吉, 金仁顺, 朴龙, 朴东明. 熊胆粉对二甲基亚硝胺诱发大鼠肝纤维化的抑制作用. 世界华人消化杂志 2005; 13(20): 2487-2490
Revised: September 1, 2005
Accepted: September 6, 2005
Published online: October 28, 2005
AIM: To investigate the inhibitory effect of bear bile powder on rat liver fibrosis induced by dimethylnitrosamine (DMN).
METHODS: A total of 30 rats were randomly divided into 3 groups: normal control group, model group, and bear bile group (10 in every group). The rat liver fibro-sis model was induced by peritoneal injection of DMN (10 g/L) for 4 wk. At the same time, the rats in the bear bile group received bear bile powder (400 mg/kg) orally once a day for 4 wk. Then the activities of serum alanine transaminase (ALT), aspartate transaminase (AST), and the contents of total protein (TP) were detected. Meanwhile, the pathological changes of liver tissues were observed under light microscope after HE staining, and the area density of collagenous fiber were examined. The amount and distribution of Kupffer cell (KC) and hepatic stellate cell (HSC) were detected by immunohistochemical SP method through the distribution of ED1 and α-smooth muscle actin (α-SMA).
RESULTS: Compared with that in the model group, the level of serum ALT was decreased, and AST was significantly decreased (4 370.87±1 338.60 nkat/L vs 5 741.15±1 000.20 nkat/L, P <0.05) in the bear bile group. The TP content and the ratio of liver to body weigh were increased. The area density of collagenous fiber was notably decreased (6.73±1.31 vs 9.90±1.93, P <0.01). The pathological changes were lighter, and the occurrence rate of diffused liver fibrosis was lower in the bear bile group than those in the model group. The fibrous septa became thin or disappeared, and the expressions of ED1 and α-SMA were markedly reduced in the bear bile group.
CONCLUSION: The bear bile powder can prevent DMN-induced rat liver fibrosis, and the mechanism may relate to its inhibition on the activation of the HSC and KC.
- Citation: Quan MJ, Jin RS, Piao L, Piao DM. Inhibitory effects of bear bile powder on dimethylnitrosamine-induced liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2005; 13(20): 2487-2490
- URL: https://www.wjgnet.com/1009-3079/full/v13/i20/2487.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i20.2487
近十多年来我国学者利用中医中药的优势, 进行了大量抗肝纤维化的动物实验和临床研究, 取得了可喜的成就, 但利用动物胆汁进行抗肝纤维化的研究尚少, 我们用二甲基亚硝胺(DMN)诱发大鼠肝纤维化模型, 探讨熊胆粉抑制肝纤维化的作用.
1.1.1 实验动物: SD♂大鼠(清洁级), 体质量160-180 g, 由延边大学医学院动物科提供.
1.1.2 试剂及药物: DMN购自美国Sigma公司, 直接红(Direct Red 80)购自美国Aldrich Chem公司, 免疫组化单克隆抗体ED1购自英国Serotec公司, α-SMA购自Denmak Dako公司, 熊胆粉(明月山牌)由吉林省延边熊厂提供.
1.2.1 动物模型制作: 参照Matsuda et al[1]的方法制备动物模型, 将30只动物随机分为3组, 正常组(10只): 注射用生理盐水1 mL/kg连续3 d/wk, 腹腔内注射共4 wk, 同时用生理盐水2 mL/d灌胃共4 wk. 模型组(10只): 10 g/L DMN(生理盐水稀释)1 mL/kg连续3 d/wk, 腹腔内注射共4 wk, 同时用生理盐水2 mL/d灌胃共4 wk. 熊胆组(10只): 10 g/L DMN腹腔内注射的同时用熊胆粉400 mg/(kg·d)灌胃共4 wk. 实验第4周末检测大鼠体质量后用乙醚麻醉, 心脏采血离心处理.
1.2.2 血清生化指标的检测: 血清ALT、AST活性检测采用Reiman氏方法, 总蛋白含量采用Biuret法, 全部Kit购自Eiken Chemical(Tyoko, Japan)公司, 严格按Kit说明书进行操作, 利用分光光度计(Ultraspec 4050, LKB, Switzerland)测定吸光度, 对照标准曲线计算AST、ALT值和总蛋白含量.
1.2.3. 病理学检查: 肝/体质量百分比: 采血后立即取肝脏称质量, 计算肝/体质量百分比.病理学检查: 取肝组织二块, 经40 g/L中性甲醛固定, 常规石蜡包埋, 切片行HE和直接红染色(1 g/L直接红picric acid饱和液), 光镜下观察肝组织的病理变化及纤维组织增生程度. 直接红染色的切片利用CMIAS真彩色病理图像分析系统(北京航空航天大学)进行胶原纤维的定量分析, 观察条件: 物镜10倍, 每张切片随机选4个视野, 图像采集、分割处理, 参数统计分析, 得出目标总面积/统计场总面积之比值. 免疫组织化学染色: 切片厚4-5 μm, 常规脱蜡至水, 用SP法进行免疫组化染色, ED1工作浓度为1∶500, a-SMA工作浓度为1∶50; 观察肝组织内KC和HSC数量及分布.
统计学处理 采用SPSS 10.0软件进行统计学分析.
实验过程中模型组、熊胆组大鼠各死亡1只.
2.1 熊胆组与模型组比较血清ALT活性下降, AST活性明显下降(P<0.05); 总蛋白含量和肝/体质量比升高, 胶原纤维面密度明显下降(P<0.01, 表1).
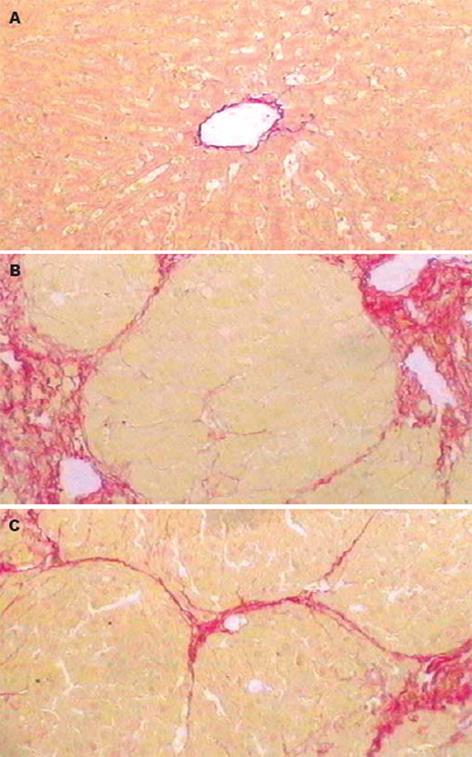
正常组肝小叶结构正常, 肝细胞无变性、坏死, 肝小叶中央静脉壁和汇管区有少量胶原纤维(图1A). 模型组肝小叶结构紊乱, 肝细胞变性、灶状或片状坏死, 汇管区大量纤维组织增生, 并形成较粗的纤维间隔伸入肝组织内, 大部分形成弥漫性肝硬化(8/9只)(图1B). 熊胆组肝细胞变性、坏死较模型组轻, 汇管区纤维组织减少, 纤维间隔变细或消失, 纤细的纤维间隔伸入肝组织内, 部分形成弥漫性肝硬化(4/9只)(图1C).
正常组α-SMA在肝小叶中央静脉壁有少量阳性表达, 汇管区的各种血管壁阳性表达, 肝细胞间无阳性细胞, ED1在肝小叶中央静脉周围、汇管区和肝实质内有少量阳性细胞分布. 模型组大量肝KC(ED1+)和HSC(α-SMA+)在增生的纤维组织及间隔内弥漫分布, 肝实质内散在分布. 熊胆组肝KC和HSC的分布与模型组相似, 但两种细胞的数量明显减少.
熊胆是珍贵的中药材之一, 熊胆特有的成分是熊去氧胆酸(UDCA), 引流熊胆粉和天然熊胆的化学成分和各种胆汁酸的含量接近. 国内外的研究已证实熊胆有抗炎、利胆、保肝、降血脂等多方面药理作用, 最近的研究表明熊胆粉对培养的瘤细胞有抑制作用, 对受照小鼠有明显的防辐射作用, 熊胆牛黄胶囊对柯萨奇病毒B4型和副流感病毒Ⅰ型有显著的抑制作用[2-4]. 熊胆粉能明显对抗四氯化碳CCl4引起的小鼠血清谷丙转氨酶升高, 对CCl4所致的肝病理组织改变有一定保护作用, 熊胆粉有效缓解高脂高热量饮食引起的肝脂肪变性[5], 熊胆粉治疗急慢性、黄疸型肝炎和肝硬化有较好的疗效[6-9], 利用UDCA治疗急、慢性肝炎和肝硬化均收到较好的疗效[10-12]. 本实验血清检测结果表明, 熊胆粉有较好的降酶作用, 其中AST活性下降较明显(P<0.05), 血清总蛋白含量和肝/体质量比升高, 肝组织胶原纤维面密度明显减少(P<0.01). 病理学观察表明模型组肝细胞排列紊乱、肝细胞弥漫性变性, 可见较多灶状、片状坏死, 汇管区纤维组织明显增生、纤维间隔较粗、伸入肝组织内, 大多数形成弥漫性假小叶(8/9), 熊胆组肝细胞变性、坏死较模型组轻, 汇管区纤维组织增生较轻, 纤维间隔变细或消失, 纤细的纤维间隔部伸入肝组织内, 部分形成弥漫性假小叶(4/9), 表明熊胆粉具有较好的抑制DMN诱发大鼠肝纤维化的作用.
肝细胞损伤或坏死刺激、激活KC, KC活化后分泌多种细胞因子再激活HSC, HSC转化为成纤维样细胞或肌纤维细胞, 表达α-SMA. 单克隆抗体ED1可识别全部单核巨噬细胞系统的细胞, 包括几乎全部的肝KC. 最近的研究提示KC分泌的转化生长因子α(TGF-α)活化HSC, 加速向肌成纤维细胞转化. 肿瘤坏死因子α(TNF-α)也是KC合成的主要的蛋白质, 是参与肝纤维化的主要的细胞因子之一, 在肝纤维化始动激活和调控中具有重要的作用[13]. 实验研究证实CCl4、猪血清诱发的大鼠肝纤维化中ED1阳性的KC显著增加, 主要位于增生的纤维间隔部位[14,15]. 本实验免疫组化染色的结果, 模型组在增生的纤维组织及间隔内大量KC(ED1+)和HSC(α-SMA+)分布, 表明KC与激活、活化HSC密切相关. 熊胆组KC和HSC也分布在纤维组织及间隔内, 但两种细胞的数量明显减少, 提示熊胆粉通过抗炎等作用, 抑制肝KC的增生和活化, 减少各种细胞因子的释放, 抑制HSC的激活和转化, 减少细胞外基质的产生, 抑制肝纤维化的形成.
电编: 张敏 编辑: 菅鑫妍 审读: 张海宁
| 1. | Matsuda Y, Matsumoto K, Yamada A, Ichida T, Asakura H, Komoriya Y, Nishiyama E, Nakamura T. Preventive and th- erapeutic effects in rats of hepatocyte growth factor infusion on liver fibrosis/cirrhosis. Hepatology. 1997;26:81-89. [PubMed] [DOI] |
| 5. | 姜 皓, 施 维锦, 李 可为, 傅 勇. 熊胆粉对豚鼠肝脂肪变性的预防. 上海第二医科大学学报. 2000;20:313-314. |
| 8. | Li YW, Zhu XY, But PP, Yeung HW. Ethnopharmacology of bear gall bladder: I. J Ethnopharmacol. 1995;47:27-31. [PubMed] [DOI] |
| 9. | Matsumoto N, Nakashima T, Kashima K. Effectiveness of bov-ine gallstone (Goou) and bear gall powder (Yutan) on chronic liver diseases: a preliminary report. Tokai J Exp Clin Med. 1995;20:9-16. [PubMed] |
| 10. | Podda M, Ghezzi C, Battezzati PM, Crosignani A, Zuin M, Roda A. Effects of ursodeoxycholic acid and taurine on serum liver enzymes and bile acids in chronic hepatitis. Gastroenterology. 1990;98:1044-1050. [PubMed] [DOI] |
| 11. | Galsky J, Bansky G, Holubova T, Konig J. Effect of ursodeoxycholic acid in acute viral hepatitis. J Clin Gastroenterol. 1999;28:249-253. [PubMed] [DOI] |
| 12. | Nakamura K, Yoneda M, Takamoto S, Nakade Y, Yokohama S, Tamori K, Aso K, Matui T, Sato Y, Aoshima M. Effect of ursodeoxycholic acid on autoimmune-associated chronic hepatitis C. J Gastroenterol Hepatol. 1999;14:413-418. [PubMed] [DOI] |
| 13. | Armbrust T, Ramadori G. Functional characterization of two different Kupffer cell populations of normal rat liver. J Hepatol. 1996;25:518-528. [PubMed] [DOI] |
| 14. | Orfila C, Lepert JC, Alric L, Carrera G, Beraud M, Vinel JP, Pipy B. Expression of TNF-alpha and immunohistochemical distribution of hepatic macrophage surface markers in carbon tetrachloride-induced chronic liver injury in rats. Histochem J. 1999;31:677-685. [PubMed] [DOI] |
| 15. | Bhunchet E, Eishi Y, Wake K. Contribution of immune response to the hepatic fibrosis induced by porcine serum. Hepatology. 1996;23:811-817. [PubMed] [DOI] |