修回日期: 2005-09-20
接受日期: 2005-09-30
在线出版日期: 2005-10-28
目的: 探讨胃癌细胞PTEN基因启动子区域甲基化与其mRNA表达的关系.
方法: 采用甲基化特异性PCR法(MSP)检测四种胃癌细胞系SGC-7901(中度分化)、BGC-823(低度分化细胞)、MGC-803(低度分化细胞)、HGC-27中PTEN基因甲基化状态, RT-PCR检测四种胃癌细胞系PTEN表达水平(未分化).
结果: HGC-27、MGC-803、BGC-823细胞系可检测到PTEN基因启动子的甲基化, SGC-7901细胞未检测到甲基化, 甲基化水平的顺序依次为: HGC-27最高(138.217±7.898, P<0.01), MGC-803、BGC-823次之(P>0.05). PTEN mRNA表达水平的依次顺序为: SGC-7901最高(0.336±0.079, P<0.01), BGC-823、MGC-803次之(P>0.05), HGC-27表达水平最低(0.113±0.047, P<0.05), 其表达水平随着其启动子区甲基化水平增高而降低. PTEN mRNA表达及其启动子甲基化水平还与胃癌细胞分化程度相关.
结论: 胃癌细胞PTEN基因启动子区域出现异常甲基化, 可能是导致其mRNA表达异常的主要原因, 也可能是导致胃癌发生、发展的重要机制之一.
引文著录: 邓全军, 于皆平, 刘芬, 齐元玲, 刘诗权, 于红刚. 胃癌细胞PTEN甲基化与其表达的相关性. 世界华人消化杂志 2005; 13(20): 2476-2480
Revised: September 20, 2005
Accepted: September 30, 2005
Published online: October 28, 2005
AIM: To investigate the relationship between the meth-ylation status of the 5'CpG island of PTEN promoter region and the mRNA expression of PTEN gene in gastric cancer cell lines in vitro.
METHODS: The methylation status of PTEN promoter region and expression of PTEN mRNA in gastric cancer cell lines SGC-7901 (moderately differentiated), BGC-823 (lowly differentiated), MGC-803 (lowly differentiated), HGC-27 (non-differentiated) were measured by methylation-specific polymerase chain reaction (MSP) and semi-quantitative reverse transc-ription PCR, respectively.
RESULTS: The methylation of PTEN gene in promoter region was found in HGC-27, MGC-803, and BGC-823 cells, but not in SGC-7901 ones. HGC-27 cells had the highest methylation level of PTEN gene (138.217 ± 7.898, P < 0.01), then MGC-803 and BGC-823 cells, and no significant difference was found between MGC and BGC (P > 0.05). SGC-7901 cells had the highest expression of PTEN mRNA (0.336 ± 0.079, P < 0.01), then BGC-823, MGC-803 and HGC-27 (lowest, 0.113 ± 0.047, P < 0.05), and there was no significant difference between BGC and MGC (P > 0.05). The expression of PTEN mRNA decreased gradually following the increase of the level of PTEN methylation. In addition, PTEN methylation status and the expression of PTEN mRNA were correlated with the differentiation level of the cancer cells.
CONCLUSION: Hypermethylation may be the main cause that leads to the decrease of the PTEN mRNA expression in gastric cancer, and also it may be the major mechanism that contributes to tumorigenesis and the progression of gastric carcinoma.
- Citation: Deng QJ, Yu JP, Liu F, Qi YL, Liu SQ, Yu HG. Relationship between PTEN methylation and its mRNA expression in human gastric cancer cells in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(20): 2476-2480
- URL: https://www.wjgnet.com/1009-3079/full/v13/i20/2476.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i20.2476
10号染色体缺失的磷酸酶及张力蛋白同源物基因(PTEN)是近年来发现的一种新的抑癌基因, 定位于染色体10q23.3[1-3], 具有双重特异性磷酸酶活性, 在细胞的生长发育、凋亡、移动、信号传递等方面起着重要的调控作用. 该基因功能的缺失导致其磷酸酶活性剧降, 细胞恶性增殖能力增强、细胞游走性增加并抑制细胞凋亡. 胃癌的发生、发展是一个多步骤、多阶段且有序的过程, 主要是癌基因功能增强、抑癌基因及DNA修复基因突变或功能缺失所致. 许多研究证实, PTEN基因在胃癌中失活及表达异常, 并与其发生发展密切相关. DNA甲基化是基因表达的一个重要调节者, PTEN基因由于高甲基化而失活在人类的大肠癌、成胶质细胞瘤、子宫内膜癌、乳腺癌、非小细胞肺癌、星形细胞瘤、卵巢癌等病中都有报道[4-10]. 因此, 目前认为除了编码区突变外, 启动子区发生甲基化也是导致抑癌基因功能缺失的机制之一. 我们采用敏感的甲基化特异性PCR法(MSP)和RT-PCR检测胃癌细胞PTEN启动子区域CpG岛甲基化状态及其表达水平, 以探讨PTEN甲基化改变、PTEN表达异常与胃癌发生、发展的关系, 为胃癌的发生、发展机制提供分子生物学依据, 并为胃癌防治提供新的思路.
1.1.1 细胞系: SGC-7901、BGC-823、MGC-803、HGC-27细胞由本室保存. 其中, SGC-7901为中度分化细胞, BGC-823、MGC-803为低度分化细胞, HGC-27为未分化细胞.
1.1.2 主要试剂: RPMI 1640培养基购自Gibco公司, MMLV逆转录酶购自Promega公司, Taq酶购自Biostar公司. PTEN甲基化和未甲基化二套引物和内参引物由上海生物工程技术有限公司合成. 亚硫酸氢钠、氢醌均购自Sigama公司, Wizard DNA clean up systerm购自Promega公司, Sss-1酶购自New England Biolabs公司, 蛋白酶K、Rnase A、平衡酚、异丙醇、乙酸钠、碘化钠等均购自武汉生命技术有限公司.
1.2.1 细胞培养: SGC-7901、BGC-823、MGC-803、HGC-27细胞接种于含10 mL/L小牛血清(56℃灭活30 min)、100×103 U/L青霉素及100×103 U/L链霉素的pH7.2的RPMI 1640培养液中, 在37℃、50 mL/L的CO2培养箱中培养.
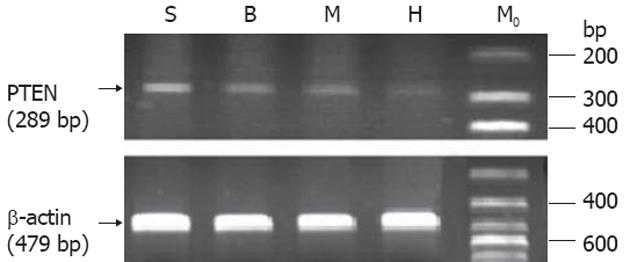
1.2.2 RT-PCR检测胃癌细胞PTEN mRNA表达水平: Trizol试剂提取细胞总RNA, 用紫外可见分光光度仪检测RNA的纯度及浓度, 每种取总RNA 1 μg用MMLV逆转录酶进行逆转录, PCR扩增PTEN, 同时扩增β-actin作为内参. PTEN引物序列: 上游引物: 5'ACCAGTGGCACTGTTGTTTCAC3'; 下游引物: 5'TTCCTCTGGTCCTGGTATGAAG3'; 产物长度289 bp. 内参照β-actin引物系列: 上游引物: 5'CGAGCGGGAAATCGTGCGTGACATTAAGGAGA3'; 下游引物: 5'CGTCATACTCCTGCTTGCTGATCCACATCTGC3'; 产物长度479 bp. PTEN PCR反应条件: 94℃ 3 min预变性后开始20个循环: 94℃ 30 s、54℃ 30 s, 72℃ 45 s, 最后于72℃延伸7 min, β-actin PCR反应条件: 94℃ 3 min预变性后开始循环: 94℃ 40 s、56℃ 45 s, 72 ℃ 60 s. 共20个循环, 最后于72℃延伸7 min. 扩增完毕在15 g/L琼脂糖凝胶上电泳分离, 使用凝胶成像系统检测积分吸光度值, 将PTEN与β-actin吸光度比值作为其mRNA水平的相对值. 每种细胞每个基因至少重复实验3次, PTEN基因mRNA表达水平取每次实验的平均值.
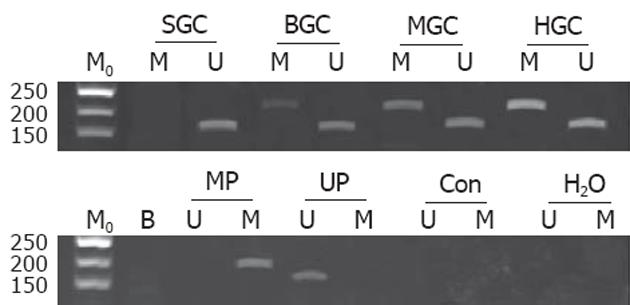
1.2.3 MSP法检测四种细胞PTEN甲基化状态: 蛋白酶K-苯酚抽取法从细胞中抽取总DNA[11], 紫外分光光度计检测DNA含量和纯度, 琼脂糖凝胶电泳检测DNA完整性. 稀释2 μg DNA于50 μL水中, 加入NaOH, 42℃变性30 min后, 加入新鲜配置的亚硫酸氢钠和氢醌及石蜡油覆盖均匀, 55℃水浴16 h. 用DNA纯化试剂盒纯化(按说明书步骤)后将DNA重悬于50 μL水中, 再加入NaOH, 37℃水浴15 min, 然后用NaAc、无水乙醇沉淀回收DNA, 干燥, 并重悬于50 μL水中, -20℃用箔包裹保存. 未甲基化阳性对照采用正常人外周血淋巴细胞抽取的DNA进行亚硫酸氢盐处理. 而将正常人外周淋巴细胞经Sss-1酶处理后再经亚硫酸氢盐修饰作为甲基化的阳性对照. 阴性对照用水代替DNA进行PCR. 聚合酶链反应: 引物设计根据PTEN基因序列(Genbank accession number AF143312), 并参照Salvesen et al[8]和Kang et al[12]合成. PTEN甲基化引物序列: 上游引物: 5'TTCGTTCGTCGTCGTCGTATTT3'; 下游引物: 5'GCCGCTTAACTCTAAACCGCAACCG3'; 产物长度206 bp. 未甲基化引物序列: 上游引物: 5'GTGTTGGTGGAGGTAGTTGTTT3'; 下游引物: 5'ACCACTTAACTCTAA ACCACAACCA3'; 产物长度162 bp. 25 μL的PCR反应体系为: 10×Buffer 2.5 μL, dNTP 2.0 μL, TaqE 0.5 μL, ddH2O 17.5 μL, Prix 1 μL, MgSO4 0.5 μL, DNA 1 μL, 于94℃ 3 min预变性后开始35个循坏: 94℃ 30 s、54(56)℃ 1 min, 72℃ 45 s, 最后于72℃延伸7 min. PCR产物经60 g/L聚丙烯酰胺凝胶电泳后检测积分吸光度值. 每种细胞每个基因至少重复实验3次, PTEN基因甲基化表达水平取每次实验的平均值.
采用美国Image PC alpha 9图像分析系统对PCR结果进行图像分析, 计算条带的积分吸光度.
统计学处理 所得数据以mean±SD表示, 应用方差分析和q检验对实验结果进行分析. P<0.05认为有统计学意义.
细胞SGC-7901 mRNA的水平最高(0.336±0.079, P<0.01), BGC-823、MGC-803次之(0.232±0.063 vs 0.228±0.056, P>0.05), HGC-27最低(0.113±0.047, P<0.05)(图1). 低分化胃癌细胞mRNA表达水平要低于较高分化程度胃癌细胞(P<0.05). 可见胃癌细胞PTEN mRNA表达与细胞分化程度相关. 阴性对照进行PCR扩增结果为阴性, 证实不存在试剂污染.
2.2.1 启动子区CpG岛的甲基化与未甲基化: 甲基化阳性对照引物扩增出71 bp的条带, 未甲基化阳性对照引物扩增出一条162 bp的条带. U引物未扩增出条带, 而M引物扩增出71 bp的条带, 说明PTEN基因启动子区CpG岛全部发生甲基化; 如果M引物未扩增出条带, U引物扩增出162 bp的条带, 说明PTEN基因未发生甲基化; 若M、U均扩增出相应大小的条带, 说明PTEN基因启动子区部分CpG岛发生甲基化(图2).
2.2.2 胃癌细胞PTEN基因CpG岛甲基化状态: HGC-27、MGC-803、BGC-823细胞系PTEN基因启动子区CpG岛可检测到甲基化, 其甲基化水平的依次顺序为: HGC-27最高(138.217±7.898, P<0.01), MGC-803、BGC-823次之(82.918±4.026 vs 79.541±4.824, P>0.05), SGC-7901细胞则未检测到甲基化. 低分化胃癌细胞PTEN基因甲基化水平要高于较高分化程度细胞(P<0.05), 可见胃癌细胞PTEN基因CpG岛甲基化水平与细胞分化程度相关(图2).
结果显示, 胃癌细胞PTEN甲基化水平越高, 其mRNA表达水平越低; 可见, PTEN基因mRNA表达随着其PTEN启动子区CpG岛甲基化水平增高而降低.
胃癌的发生、发展是机体内因和环境外因共同作用的结果. 其中癌基因功能增强、抑癌基因功能缺失发挥着重要作用. PTEN基因是一种广泛的肿瘤抑制基因, 其适度的表达可通过使3, 4, 5-三磷酸磷脂酰肌醇(PIP3)去磷酸化, 达到抑制细胞生长及促进细胞凋亡的目的; 并通过使黏着斑激酶(FAK)去磷酸化抑制细胞转移及侵袭; 另外, 还通过抑制MARK信号传导通路抑制细胞生长分化[13-16]. 研究证实, 在人类的胃癌中也普遍存在PTEN失活现象及表达的异常[17-20], 并且其失活与胃癌的发生、发展密切相关[21,22]. 目前认为, 突变、缺失及异常甲基化是导致PTEN基因失活的主要机制[21,23-27]. 但研究表明, PTEN基因的突变、缺失在胃癌的发生、发展中不起主要作用[28,29], 因此其启动子CpG岛区域甲基化状况与胃癌发生、发展的关系就成为瞩目的焦点. 在本实验中四种胃癌细胞系中有三种可检测到PTEN启动子区CpG岛的甲基化状态, 并且胃癌细胞PTEN基因CpG岛甲基化水平与细胞分化程度相关, 说明PTEN发生甲基化参与了胃癌的进展, 这也表明启动子甲基化与胃癌的发生、发展关系密切.
PTEN蛋白没有SH2结构, 也没有跨膜信号, 它是定位于细胞质的一种磷酸酶, 其5'端非翻译区含有多个CpG岛, 因此有学者推测, 细胞可以通过甲基化而下调PTEN的mRNA表达量, 从而在RNA水平调控PTEN蛋白表达量. 本实验结果显示, 在三种胃癌细胞系中都检测到PTEN启动子区CpG岛的甲基化状态, 且细胞甲基化水平越高, 其mRNA表达水平越低, 后者的表达水平随着前者甲基化的增高而降低, 这表明PTEN启动子甲基化与其mRNA表达量密切相关. 据此我们推测, 在胃癌细胞中, PTEN启动子区CpG岛发生甲基化将直接导致其mRNA表达减少或无表达, 进而使其蛋白表达异常, 以致该基因失活, 这也与国外学者Kang et al[21]的报道相一致; PTEN因甲基化而失活后将导致与肿瘤发生、发展相关的一系列生物学行为的改变, 例如细胞增殖与凋亡失调, 肿瘤侵袭转移能力增强等, 从而也说明PTEN基因甲基化在胃癌的发生、发展中同样起着至关重要的作用. 但Sato et al[29]也对胃癌PTEN基因甲基化状态进行了检测, 结果显示: PTEN作为抑制基因, 并未参与胃癌的发生、发展, 这可能是由于PTEN基因启动子区富含的CpG岛并未全部发生甲基化, 且所设计的引物并未能针对已发生甲基化的区域扩增, 故仅仅只扩增出未甲基化产物.
另外我们发现, PTEN甲基化及其mRNA表达与细胞分化程度相关, 即PTEN甲基化水平高且其mRNA表达水平低的细胞分化程度低. 一般来说, 细胞分化程度越低, 其恶性程度就越高, 病人预后越差, 因此我们可以通过对上述两个指标的检测来达到预测肿瘤恶性程度及预后的目的. 还有研究提示[12], 胃癌中PTEN基因异常甲基化可能与EB病毒感染有关, 因EB病毒感染阳性胃癌中PTEN启动子甲基化率为76.2%(16/21), 而EB病毒阴性胃癌者仅为25%(14/56). 故此我们展望能够通过清除EB病毒的策略来防止PTEN基因发生异常甲基化, 从而达到预防与治疗肿瘤的目的.
我们通过对PTEN基因甲基化状态及其表达的研究, 表明PTEN基因启动子区域出现异常甲基化, 可能是导致PTEN基因mRNA表达异常的主要原因, 也可能是导致该基因失活的重要机制之一, 这将有助于揭示胃癌的发生、发展机制, 也为肿瘤的防治提供了新的思路. 另外对PTEN表达及其甲基化状态的检测也将有助于判断肿瘤的恶性程度和预后. 以上结果仅从基因水平分析PTEN在胃癌发生发展中的异常改变, 其参与肿瘤发生发展的机制还有待于进一步研究.
电编: 张敏 编辑: 菅鑫妍 审读: 张海宁
| 1. | Steck PA, Pershouse MA, Jasser SA, Yung WK, Lin H, Ligon AH, Langford LA, Baumgard ML, Hattier T, Davis T. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet. 1997;15:356-362. [PubMed] [DOI] |
| 2. | Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science. 1997;275:1943-1947. [PubMed] [DOI] |
| 3. | Li DM, Sun H. TEP1, encoded by a candidate tumor suppressor locus, is a novel protein tyrosine phosphatase regulated by transforming growth factor beta. Cancer Res. 1997;57:2124-2129. [PubMed] |
| 4. | Garcia JM, Silva J, Pena C, Garcia V, Rodriguez R, Cruz MA, Cantos B, Provencio M, Espana P, Bonilla F. Promoter methylation of the PTEN gene is a common molecular change in breast cancer. Genes Chromosomes Cancer. 2004;41:117-124. [PubMed] [DOI] |
| 5. | Yu J, Zhang H, Gu J, Lin S, Li J, Lu W, Wang Y, Zhu J. Methylation profiles of thirty four promoter-CpG islands and concordant methylation behaviours of sixteen genes that may contribute to carcinogenesis of astrocytoma. BMC Cancer. 2004;4:65. [PubMed] [DOI] |
| 6. | Schondorf T, Ebert MP, Hoffmann J, Becker M, Moser N, Pur S, Gohring UJ, Weisshaar MP. Hypermethylation of the PTEN gene in ovarian cancer cell lines. Cancer Lett. 2004;207:215-220. [PubMed] [DOI] |
| 7. | Baeza N, Weller M, Yonekawa Y, Kleihues P, Ohgaki H. PTEN methylation and expression in glioblastomas. Acta Neuropathol. 2003;106:479-485. [PubMed] [DOI] |
| 8. | Salvesen HB, Stefansson I, Kretzschmar EI, Gruber P, MacDonald ND, Ryan A, Jacobs IJ, Akslen LA, Das S. Significance of PTEN alterations in endometrial carcinoma: a population-based study of mutations, promoter methylation and PTEN protein expression. Int J Oncol. 2004;25:1615-1623. [PubMed] [DOI] |
| 9. | Soria JC, Lee HY, Lee JI, Wang L, Issa JP, Kemp BL, Liu DD, Kurie JM, Mao L, Khuri FR. Lack of PTEN expression in non- small cell lung cancer could be related to promoter methy-lation. Clin Cancer Res. 2002;8:1178-1184. [PubMed] |
| 10. | Goel A, Arnold CN, Niedzwiecki D, Carethers JM, Dowell JM, Wasserman L, Compton C, Mayer RJ, Bertagnolli MM, Boland CR. Frequent inactivation of PTEN by promoter hypermethylation in microsatellite instability-high sporadic colorectal cancers. Cancer Res. 2004;64:3014-3021. [PubMed] [DOI] |
| 11. | Herman JG, Graff JR, Myohanen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci USA. 1996;93:9821-9826. [PubMed] [DOI] |
| 12. | Kang GH, Lee S, Kim WH, Lee HW, Kim JC, Rhyu MG, Ro JY. Epstein-barr virus-positive gastric carcinoma demonstrates frequent aberrant methylation of multiple genes and constitutes CpG island methylator phenotype-positive gastric carcinoma. Am J Pathol. 2002;160:787-794. [PubMed] [DOI] |
| 13. | Gu J, Tamura M, Pankov R, Danen EH, Takino T, Matsumoto K, Yamada KM. Shc and FAK differentially regulate cell motility and directionality modulated by PTEN. J Cell Biol. 1999;146:389-403. [PubMed] [DOI] |
| 14. | Leslie NR, Downes CP. PTEN: The down side of PI 3-kinase signalling. Cell Signal. 2002;14:285-295. [PubMed] [DOI] |
| 15. | Gu J, Tamura M, Yamada KM. Tumor suppressor PTEN inhibits integrin- and growth factor-mediated mitogen-activated protein (MAP) kinase signaling pathways. J Cell Biol. 1998;143:1375-1383. [PubMed] [DOI] |
| 16. | Cantley LC, Neel BG. New insights into tumor suppression: PTEN suppresses tumor formation by restraining the phosphoinositide 3-kinase/AKT pathway. Proc Natl Acad Sci USA. 1999;96:4240-4245. [PubMed] [DOI] |
| 17. | Li JY, Zheng HC, Yang L, Xu L, Yang XF, Gao H, Zhang YC, Xin Y. Altered expression of PTEN gene and LOH of its epige- netic microsatellite in gastric carcinoma. Zhonghua Zhongliu Zazhi. 2004;26:389-392. [PubMed] |
| 19. | Sun H, Zheng H, Yang X, Wu D, Zhang S, Kuang L, Xin Y. Expression of PTEN and Caspase-3 and their clinicopathological significance in primary gastric malignant lymphoma. Chin Med Sci J. 2004;19:19-24. [PubMed] |
| 20. | Fei G, Ebert MP, Mawrin C, Leodolter A, Schmidt N, Dietzmann K, Malfertheiner P. Reduced PTEN expression in gastric cancer and in the gastric mucosa of gastric cancer relatives. Eur J Gastroenterol Hepatol. 2002;14:297-303. [PubMed] [DOI] |
| 21. | Kang YH, Lee HS, Kim WH. Promoter methylation and silen-cing of PTEN in gastric carcinoma. Lab Invest. 2002;82:285-291. [PubMed] [DOI] |
| 22. | Zheng HC, Chen Y, Kuang LG, Yang L, Li JY, Wu DY, Zhang SM, Xin Y. Expression of PTEN-encoding product in different stages of carcinogenesis and progression of gastric carcinoma. Zhonghua Zhongliu Zazhi. 2003;25:13-16. [PubMed] |
| 23. | Toyota M, Ahuja N, Suzuki H, Itoh F, Ohe-Toyota M, Imai K, Baylin SB, Issa JP. Aberrant methylation in gastric cancer associated with the CpG island methylator phenotype. Cancer Res. 1999;59:5438-5442. [PubMed] |
| 24. | Li YL, Tian Z, Wu DY, Fu BY, Xin Y. Loss of heterozygosity on 10q23.3 and mutation of tumor suppressor gene PTEN in gastric cancer and precancerous lesions. World J Gastroenterol. 2005;11:285-288. [PubMed] [DOI] |
| 25. | Byun DS, Cho K, Ryu BK, Lee MG, Park JI, Chae KS, Kim HJ, Chi SG. Frequent monoallelic deletion of PTEN and its reciprocal associatioin with PIK3CA amplification in gastric carcinoma. Int J Cancer. 2003;104:318-327. [PubMed] [DOI] |
| 26. | Lu QJ, Zhao XD, Song JY, Li XH, Ma Y, Meng H, Jiang WG. Research on the mechanisms of PTEN gene inactivation in ovarian cancer. Zhonghua Binglixue Zazhi. 2005;34:266-269. [PubMed] |
| 27. | Wang JY, Huang TJ, Chen FM, Hsieh MC, Lin SR, Hou MF, Hsieh JS. Mutation analysis of the putative tumor suppressor gene PTEN/MMAC1 in advanced gastric carcinomas. Virchows Arch. 2003;442:437-443. [PubMed] |
| 28. | Chang JG, Chen YJ, Perng LI, Wang NM, Kao MC, Yang TY, Chang CP, Tsai CH. Mutation analysis of the PTEN/MMAC1 gene in cancers of the digestive tract. Eur J Cancer. 1999;35:647-651. [PubMed] [DOI] |
| 29. | Sato K, Tamura G, Tsuchiya T, Endoh Y, Sakata K, Motoyama T, Usuba O, Kimura W, Terashima M, Nishizuka S. Analysis of genetic and epigenetic alterations of the PTEN gene in gastric cancer. Virchows Arch. 2002;440:160-165. [PubMed] [DOI] |