Copyright
©The Author(s) 2005. Published by Baishideng Publishing Group Inc. All rights reserved.
甜菜碱对酒精性肝损伤大鼠凋亡基因caspase-12表达的影响
张频, 龚作炯
张频, 龚作炯, 武汉大学人民医院感染科 湖北省武汉市 430060
张频, 女, 1979-09-23生, 湖北省荆州市人, 汉族, 2004年武汉大学医学院硕士研究生, 主要从事肝脏疾病的研究.
ORCID number: $[AuthorORCIDs]
电话: 027-88041911-8385
收稿日期: 2005-09-05
修回日期: 2005-09-10
接受日期: 2005-09-30
在线出版日期: 2005-10-28
目的: 研究甜菜碱对凋亡基因caspase-12表达的影响, 探讨其抗酒精性肝损伤(ALD)大鼠肝细胞凋亡的机制.
方法: 采用酒精加鱼油灌胃配合高脂饮食建立酒精性肝损伤模型, 应用半定量逆转录聚合酶链反应(RT-PCR)法和免疫组化法检测大鼠肝组织凋亡基因caspase-12 mRNA和蛋白水平.
结果: 与正常组比较, 模型组大鼠肝组织caspase-12表达明显增强(mRNA: 1.00 vs 0.18, P<0.01; 蛋白: 0.296 9±0.045 1 vs 0.052 6±0.023 4, P<0.01), 但高、低剂量甜菜碱能抑制其表达(mRNA: 0.10, 0.12 vs 1.00, P<0.01; 蛋白: 0.121 5±0.013 0, 0.185 0±0.008 5 vs 0.296 9±0.045 1, P<0.01). 甜菜碱高、低剂量组之间有显著差异(mRNA: 0.10 vs 0.12, P<0.05; 蛋白: 0.121 5±0.013 0 vs 0.185 0±0.008 5, P<0.05).
结论: 甜菜碱能抑制凋亡基因caspase-12 mRNA和蛋白的表达, 可能是其减少凋亡的机制之一.
关键词: 酒精性肝损伤; 甜菜碱; caspase-12
引文著录: 张频, 龚作炯. 甜菜碱对酒精性肝损伤大鼠凋亡基因caspase-12表达的影响. 世界华人消化杂志 2005; 13(20): 2437-2440
Effects of betaine on expression of caspase-12 in ethanol-induced liver injury in rats
Pin Zhang, Zuo-Jiong Gong
Pin Zhang, Zuo-Jiong Gong, Department of Infectious Diseases, Renmin Hospital of Wuhan University, Wuhan 430060, Hubei Province, China
Correspondence to: Dr. Zuo-Jiong Gong, Department of Infectious Diseases, Renmin Hospital of Wuhan University, Wuhan 430060, Hubei Province, China. zjgong@163.com
Received: September 5, 2005
Revised: September 10, 2005
Accepted: September 30, 2005
Published online: October 28, 2005
AIM: To investigate the effects of betaine on the expression of caspase-12 in the liver of rats with ethanol-induced liver injury.
METHODS: Forty-eight female SD rats were randomly divided into 4 groups: control, model, and low and high dose betaine group. Except the rats in control group, all the rats were fed fat-rich diet plus ethanol plus fish oil gavage for 8 wk. Betaine was administered intragastrically in the rats of betaine groups after 4-wk exposure of ethanol. The expression of caspase-12 was detected in the liver tissues by immunohistomistry and semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Compared with that in control group, the expression of caspase-12 was markedly induced in the liver after chronic ethanol consumption (mRNA: 1.00 vs 0.18, P <0.01; protein: 0.296 9±0.045 1 vs 0.052 6±0.023 4, P < 0.01). However, the level of caspa-se-12 expression was significantly lower in high- and low-dose betaine group than that in model group (mRNA: 0.10, 0.12 vs 1.00, P < 0.01; protein: 0.121 5±0.013 0, 0.185 0±0.008 5 vs 0.296 9±0.045 1, P < 0.01). Significant difference of caspase-12 expression also existed between high- and low-dose betaine group (mRNA: 0.10 vs 0.12, P < 0.05; protein: 0.121 5±0.013 0 vs 0.185 0±0.008 5, P < 0.05).
CONCLUSION: Betaine suppresses the expression of caspase-12 both in mRNA and protein level in the rats with ethanol-induced liver injury, which may be related to its anti-apoptotic mechanism.
Key Words: Ethanol-induced liver; Betaine; Caspase-12
0 引言
肝细胞凋亡在酒精性肝损伤中的作用日益引起重视, 是目前该领域的研究热点之一. 在众多复杂的机制中, 酗酒引起的高同型半胱氨酸血(hyperhomo-cysteinemia, HHcy)诱发的内质网应激(endoplasmic reticulum stress, ER stress), 继而诱导的肝细胞凋亡是其重要机制之一[1,2]. HHcy与多种疾病的发生有关[3-5], 对机体是非常有害的[6,7]. 最终ER应激激发了一个包括caspase-12, 9, 3特异级联反应. ER过强应激时, 激活的caspase-12不通过其它通路能独立诱导肝细胞凋亡. caspase-12是目前较理想的抗凋亡治疗靶位[8]. 以往的研究结果已证实甜菜碱对ALD大鼠肝细胞凋亡具有良好的拮抗作用. 我们研究甜菜碱对凋亡基因caspase-12表达的影响, 以探讨其抗凋亡的可能机制.
1 材料和方法
1.1 材料
盐酸甜菜碱, 纯度99%, 浙江巨化集团进出口有限公司赠予; 硫酸亚铁, 上海化学试剂公司生产; 鱼油和560 mL/L酒精, 自购; TrizoL试剂购自invitrogen公司; 100 bp DNA ladder Marker购自TaKaRa生物技术有限公司; M-MLV逆转录酶及其缓冲液, 10 mmol/L dNTPS, oligo(dT)15随机引物购自Promega公司; Taq DNA聚合酶及其缓冲液, 核糖核酸酶抑制剂(RNasin)购自Biostar公司; caspase-12聚合酶链反应扩增引物由武汉伯杰生物股份有限公司合成; 兔抗鼠caspase-12及多克隆兔抗caspase-12抗体购自Stressgen公司; SP、DAB试剂盒购自北京中山公司. SPF级SD♀大鼠48只, 体质量150±10 g, 由武汉大学动物实验中心提供. 正常喂养1 wk后, 采用随机数字法将大鼠随机分为4组, 每组12只, 分为正常对照组、模型组和甜菜碱高、低剂量组. 模型制备在目前常用的酒精灌胃的造模方法基础上加以改进, 以灌酒精+鱼油制作酒精性肝损伤大鼠模型. 正常组以普通饮食, 并灌胃9 g/L氯化钠溶液. 其余各组每日予酒精+0.5 mL鱼油灌胃, 酒精剂量开始为7 g/kg, 随后每周递增0.2 g/kg, 每日上午一次, 共8 wk; 同时给予自制饲料(配方如下: 普通饲料∶猪油∶全脂奶粉为80∶10∶10, 同时按5 g/kg饲料给予硫酸亚铁[9,10]). 所有大鼠始终均自由饮水. 造模第4周开始, 甜菜碱组按200 mg/kg给予甜菜碱水剂灌胃, 每日下午1次. 实验结束时, 乌拉坦(200 g/L, 100 g/L)麻醉动物, 剖腹部取肝脏, 一部分放-80℃冰箱保存用于做RT-PCR, 另一部分于100 g/L甲醛溶液固定, 用于免疫组织化学染色检测.
1.2 方法
取黄豆大小的肝组织标本于匀浆器内研磨, 用Trizol试剂、氯仿和异丙醇, RNA沉淀后, 用无RNAse缓冲液溶解, 使用紫外分光光度计测定A260和A280, 计算RNA的浓度和纯度. RNA2 μg加oligo(dT)15随机引物0.5 μg及DEPC处理水至总体积15 μL, 70℃孵育5 min, 随后在冰上迅速冷却. 然后依次加入5 μL M-MLV缓冲液, 1.25 μL dNTPS(10 mmol/L), Rnasin 25 U, 200U M-MLV逆转录酶以及DEPC处理水至总体积25 μL. 反应在42℃中进行60 min, 随后85℃ 5 min终止, 并于冰箱中4℃保存. caspase-12正义: 5'ATTCCTGGTCTTTATGTCCC 3', 反义: 5'ATACTCTCTCAATGGTGGGC 3', 扩增片段全长为495 bp; 磷酸甘油脱氢酶基因(reduced glyceraldehydes phosphate dehydrogenase, GAPDH)作为内对照, 正义: 5'TCCCTCAAGATTGTCAGCAA 3', 反义: 5'AGATCCACAACGGATACATT 3, 扩增片段全长为309 bp. PCR反应体系包括: 10×Taq缓冲液5 μL, dNTP(10 mmol/L)1 μL, 基因特异性引物(正义链及反义链, 各25 μmol/L)1 μL, 2.0 U Taq DNA聚合酶及cDNA 1 μL, 加水至总体积50 μL. 反应过程如下: 初始94℃孵育3 min, 随后30个循环, 包括94℃变性45 s, 54℃退火45 s, 72℃廷伸1 min. 最后在72℃廷伸7 min. 为了保证用于PCR反应的cDNA量一致, 采用看家基因GAPDH作为内参照. 将能获得等量的GAPDH PCR扩增产物的cDNA用作扩增目的产物. PCR结束时, 取产物5 μL在20 g/L琼脂糖凝胶(含0.1 g/L溴化乙锭)中电泳, 紫外光下观察. 采用法国VL凝胶成像及分析系统进行PCR产物半定量分析. 将石蜡包埋的肝组织块切成3 μm厚, 常规脱蜡入水. 30 mL/L H2O2去离子水孵育5-10 min, 消除内源性过氧化物酶活性; 正常兔血清工作液孵育10-15 min封闭非特异性结合部位. 然后滴加多克隆兔抗caspase-12(1∶200稀释)一抗4℃过夜, 随后滴加生物素结合的羊抗兔二抗孵育10-15 min. PBS冲冼后, 滴加辣根标记链霉卵白素工作液室温下孵育10-15 min. 最后以DAB显色, 阳性反应呈棕黄色. 阴性对照以PBS代替相应的一抗. 光镜下每张切片随机选取6个不重叠视野, 采用HPIAS-1000全自动医学彩色图像分析系统, 测定平均光密度, 计算每组平均值, 反映阳性强度.
统计学处理 采用单因素多个均数比较的方差分析统计法, 在作方差齐性检验后, 进行各组数据两两之间的均数比较, 使用SPSS 10.0统计学软件处理.
2 结果
在实验期间, 模型组大鼠有4只因酒精灌胃误入气管死亡, 其余组大鼠全部存活.
2.1 甜菜碱对caspase-12 mRNA表达的影响
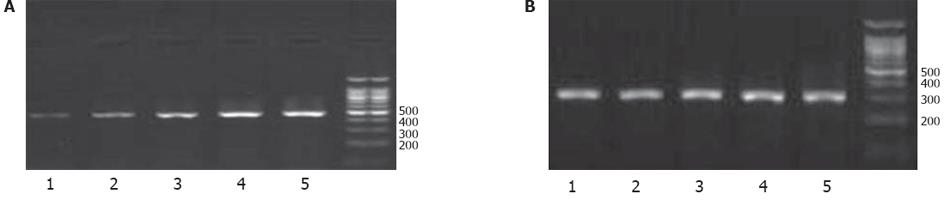
采用quantiscan软件扫描分析吸光度进行定量, 正常对照组大鼠caspase-12 mRNA表达的吸光度为0.18, 模型组为1.00, 甜菜碱高、低剂量组分别为0.10和0.12. 与正常组对比, 模型组caspase-12 mRNA表达显著增加(P<0.01); 与模型组比较, 甜菜碱高、低剂量组caspase-12 mRNA表达显著减少(P<0.01), 且甜菜碱高、低剂量组之间有显著差异(P<0.05, 图1).
图1 caspase-12 mRNA表达情况.
A: caspase-12; B: GAPDH内对照. 1: 正常组; 2: 甜菜碱高剂量组; 3: 甜菜碱低剂量组; 4, 5: 模型组.
2.2 甜菜碱对caspase-12蛋白的影响
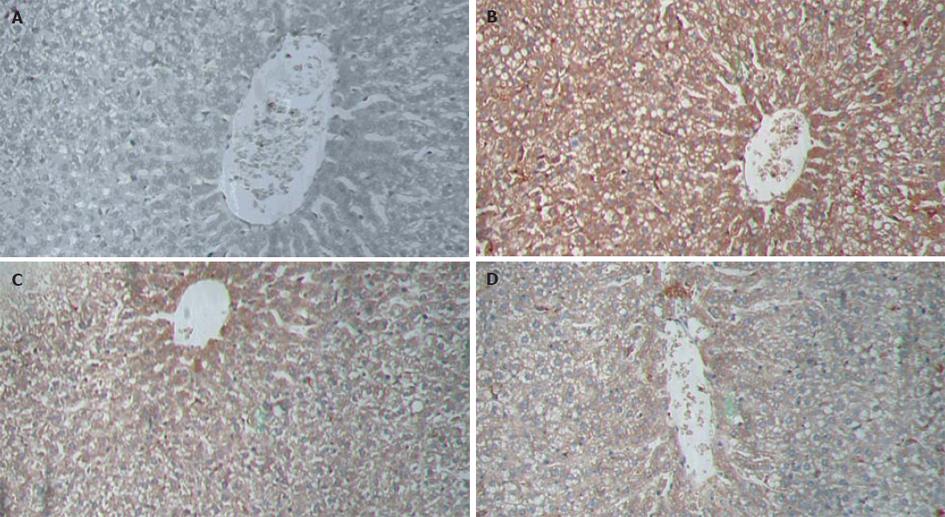
免疫组织化学染色结果显示, caspase-12蛋白染色定位于肝细胞胞质(图2). 模型组caspase-12蛋白表达较正常组显著增加(0.296 9±0.045 1 vs 0.052 6±0.023 4, P<0.01), 甜菜碱高、低剂量组较模型组表达显著减少(0.121 5±0.013 0 vs 0.296 9±0.045 1; 0.185 0±0.008 5 vs 0.296 9±0.045 1, P<0.01), 甜菜碱高、低剂量组之间有显著差异(0.121 5±0.013 0 vs 0.185 0±0.008 5, P<0.05).
图2 大鼠肝组织caspase-12表达 (SP×200).
A: 正常组; B: 模型组; C: 甜菜碱低剂量组; D: 甜菜碱高剂量组.
3 讨论
细胞凋亡(apoptosis)是由基因控制的细胞自主的有序性死亡. 肝细胞凋亡发生于许多肝脏疾病, 酒精性肝病(alcoholic liver disease, ALD)与肝细胞凋亡的关系是目前的研究热点之一[11-13], 鉴于凋亡在ALD中的重要作用的认识, 通过对凋亡机制的干预可能为酒精性肝损伤的防治提供一个新的途径[14,15]. 介导细胞凋亡的两条经典的传导通路是死亡受体活化和线粒体损伤, 但酒精性损伤引起肝细胞凋亡的确切机制尚不清楚, 一般认为ALD的凋亡与肿瘤坏死因子(TNF-α)相关[16], Esfandiari et al[17]研究发现, 慢性酒精摄入和叶酸缺乏可以激活ER应激信号通路. 过度内质网应激启动的细胞凋亡, 是一条新的细胞凋亡信号传导通路[18]. 此信号传导通路包括非折叠蛋白反应和钙离子起始信号等机制[19], 内质网应激可以特异性激活caspase-12, caspase-12裂解caspase-3等下游效应蛋白酶, 最终导致细胞凋亡. 新近研究表明[20,21], ER stress引起凋亡时胞质内的caspase-7转移至ER表面激活caspase-12. 活化的caspase-12在无需细胞色素C(cytochrome C)参与的情况下激活caspase-9和caspase-3引起凋亡[22]. 另外Liu et al[23]的实验, 通过使用caspase-9的抑制剂不能减少顺铂诱导的细胞凋亡, 而用caspase-3的抑制剂仅轻度抑制了细胞凋亡, 但当培养细胞转染抗caspase-12的抗体后能显著减少细胞的凋亡, 从而也得出结论, caspase-12是内质网应激特异性caspase蛋白, 参与内质网应激时的细胞凋亡过程. Jiang et al[24]证实, 抑制caspase-12的表达, 是抗ER stress诱导的凋亡的有潜力的治疗途径.
甜菜碱[25,26]又名三甲基甘氨酸, 为人体内唯一可替代叶酸或S-腺苷蛋氨酸作为甲基供体, 是参与蛋氨酸循环及卵磷脂合成的一种季胺盐可溶性生物碱[27,28]. 在多种植物的根、茎或种子中含有这种生物碱, 在甜菜中含量较多(10-15 g/kg). 甜菜碱已被证明对酒精性肝损伤有防治作用, 能降低酒精摄入小鼠HHcy、内质网应激和肝细胞损伤[29,30]. 我们的前期实验还证实了它可以减少ALD大鼠肝细胞凋亡的发生, 但其拮抗凋亡的机制尚未见报道. 本实验结果显示, 模型组大鼠caspase-12 mRNA和蛋白高表达, 证实caspase-12可能介导了肝细胞凋亡的发生. 同时甜菜碱组大鼠凋亡基因caspase-12 mRNA和蛋白的表达均显著降低(P<0.01), 表明甜菜碱抗肝细胞调亡的机制可能与抑制凋亡基因caspase-12的表达有关, 且与药物剂量有一定关系. 这可能是甜菜碱抗酒精性肝损伤肝细胞凋亡的机制之一, 从而为临床应用甜菜碱治疗酒精性肝损伤提供了依据.