修回日期: 2005-09-01
接受日期: 2005-09-06
在线出版日期: 2005-10-28
目的: 研究大蒜素对人胃癌细胞SGC-7901及BGC-823 G2/M期阻滞作用及其调节机制.
方法: 应用MTT法测定大蒜素对人胃癌细胞株SGC-7901和BGC-823细胞增殖抑制率及72 h的IC50.通过流式细胞仪检测IC50浓度的大蒜素对SGC-7901和BGC-823细胞周期的影响. 应用免疫组化染色检测大蒜素作用前后SGC-7901和BGC-823细胞CDC2和CyclinB蛋白表达.
结果: 不同浓度的大蒜素可以抑制人胃癌细胞株SGC-7901和BGC-823的增殖, 且随着大蒜素浓度的增大, 抑制率逐渐增高. 大蒜素抑制SGC-7901细胞增殖50%的药物浓度(IC50): 72 h为23 mg/L; 大蒜素抑制BGC-823细胞增殖50%的药物浓度(IC50): 72 h为35 mg/L. 大蒜素作用于两种细胞, 其细胞周期均发生了明显的变化, 主要表现为G0/G1期细胞减少, G2/M期细胞增多(SGC-7901细胞24, 48 h vs 对照: 26.47±2.54%, 28.88±2.75% vs 24.30±2.74%, P<0.01; BGC-823细胞24, 48 h vs对照: 22.78±1.45%, 24.87±1.61% vs 20.32±1.34%, P<0.01), S期细胞无明显变化. 未经大蒜素处理的两种细胞, CDC2和CyclinB蛋白表达均为阳性, 大蒜素处理后, CDC2和CyclinB蛋白表达下降. SGC-7901细胞经23 mg/L大蒜素处理后, CDC2蛋白相对阳性表达率为87.2%; CyclinB蛋白相对阳性表达率为59.3%. BGC-823细胞CDC2蛋白在35 mg/L大蒜素作用后, 相对阳性表达率为84.4%; CyclinB蛋白相对阳性表达率为62.8%, 与对照组相比均有显著性差异(P<0.01).
结论: 大蒜素使人胃癌细胞株SGC-7901和BGC-823停滞于G2/M期, 其机制是通过CDC2和CyclinB蛋白表达下降实现的.
引文著录: 柳星, 马锐, 陈威, 白雪蕾, 袁媛. 大蒜素对人胃癌细胞 SGC-7901及BGC-823 G2/M期的阻滞调节机制. 世界华人消化杂志 2005; 13(20): 2409-2412
Revised: September 1, 2005
Accepted: September 6, 2005
Published online: October 28, 2005
AIM: To explore the inhibitory effect of Allicin on the G2/M phase of human gastric cell line SGC-7901 and BGC-823 and its mechanism.
METHODS: The proliferation inhibition rate and IC50 of Allicin (72 h) to SGC-7901 and BGC-823 cells were examined by MTT assay. The cycles of the cells were measured by flow cytometry when IC50 concentration of Allicin was adopted. The expression of CDC2 and CyclinB protein were detected by immunohistochemistry.
RESULTS: Allicin inhibited the proliferation of SGC-7901 (IC50 = 23 mg/L) and BGC-823 (IC50 = 35 mg/L) cells and the inhibition rate was elevated with the increase of Allicin concentration. After treatment with IC50 concentration of Allicin, the percentage of G0/G1 phase cells was decreased, but that of G2/M phase ones was significantly increased for both SGC-7901 (24, 48 h vs control: 26.47±2.54%, 28.88±2.75% vs 24.30±2.74%, P <0.01) and BGC-823 (24, 48 h vs control: 22.78±1.45%, 24.87±1.61% vs 20.32±1.34%, P <0.01). CDC2 and CyclinB proteins were positively expressed in SGC-7901 and BGC-823 cells without Allicin treatment. After treatment, the comparative rates of CDC2 and CyclinB expression were 87.2% and 59.3% in SGC-7901 cells, respectively, and 84.4% and 62.8% in BGC-823 cells, respectively (all P <0.01).
CONCLUSION: Allicin causes arrest of SGC-7901 and BGC-823 cells in G2/M phase, and the mechanism is related to the down-regulation of CDC2 and CyclinB expression.
- Citation: Liu X, Ma R, Chen W, Bai XL, Yuan Y. Inhibition of Allicin on G2/M phase of human gastric cell line SGC-7901 and BGC-823. Shijie Huaren Xiaohua Zazhi 2005; 13(20): 2409-2412
- URL: https://www.wjgnet.com/1009-3079/full/v13/i20/2409.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i20.2409
细胞周期有3个调控点, 分别是G0/G1, G1/S和G2/M, 其中G1/S和G2/M最为重要. G2期向M期的转变涉及到细胞分裂, 完成一个细胞向两个细胞的转化, 故G2/M期阻滞显得更为重要. 目前G2/M期阻滞的机制不完全清楚. 在真核细胞中, 正常细胞G2/M进程由细胞周期蛋白B(CyclinB)-P34CDC2复合物调控. 大蒜素是从大蒜球茎中分离出的一种化合物, 抗肿瘤机制为阻断致癌物的合成、抗突变、抗畸变; 直接杀伤; 抑制肿瘤细胞增殖; 诱导细胞周期特异性阻滞; 诱导凋亡; 调节机体免疫功能; 对抗肿瘤药物的增敏作用和抗耐药等, 是通过多个途径完成的. 国内外对大蒜素抑制肿瘤细胞周期, 使之停滞于G2/M期的报道虽然很多, 但是从机制方面探讨大蒜素如何使肿瘤细胞停滞于G2/M期, 目前罕见报道. 我们应用MTT法及流式细胞仪, 深入研究大蒜素对肿瘤细胞的抑制作用以及对肿瘤细胞周期的影响. 并通过免疫组化等技术, 检测在G2/M期调控中起重要作用的CDC2蛋白和CyclinB蛋白的表达水平, 探讨大蒜素对肿瘤细胞周期阻滞的作用机制.
人胃癌转移淋巴结细胞系SGC-7901, 人胃低分化腺癌细胞系BGC-823由中国医科大学细胞生物学教研室提供. MTT(Sigma公司); 碘化丙啶(PI), Rnase(Fluka公司); 即用型鼠mAb P34CDC2, SP试剂盒, DAB试剂盒, 抗原修复液Ⅱ, 胰酶消化液(福州迈新公司); 即用型鼠mAb CyclinB(武汉博士德公司); 大蒜素注射液(30 mg/支)(上海禾丰制药有限公司); 流式细胞仪型号: FACScan(B.D USA).
将两种细胞用含有100 mL/L小牛血清的RPMI 1640培养液, 于37℃, 50 mL/L CO2培养箱中培养, 每2-3 d传代1次, 取对数生长期细胞用于实验.
1.2.1 MTT法测定细胞增殖抑制率: 将两种细胞密度分别调整至5×107/L, 接种于96孔板. 用不同浓度大蒜素处理细胞, 设立不加任何处理因素的对照组. 每个浓度3个复孔. 用酶标仪在570 nm处测定每孔吸光度. 以大蒜素浓度为横坐标, 以细胞抑制率为纵坐标, 绘制细胞增殖抑制曲线, 并测定药物半数抑制浓度(IC50). 以下式计算实验组细胞增殖抑制率, 细胞增殖抑制率=(1-实验组吸光度值/对照组吸光度值)×100%.
1.2.2 流式细胞仪分析细胞周期: 取生长状态良好的细胞, 接种在大方瓶中, 培养至密度达60-70%时, 加入MTT法测得的72 h IC50浓度大蒜素, 培养24 h后, 收集细胞. 采用cellQuest进行细胞周期各期的百分比分析, 每组实验重复5次.
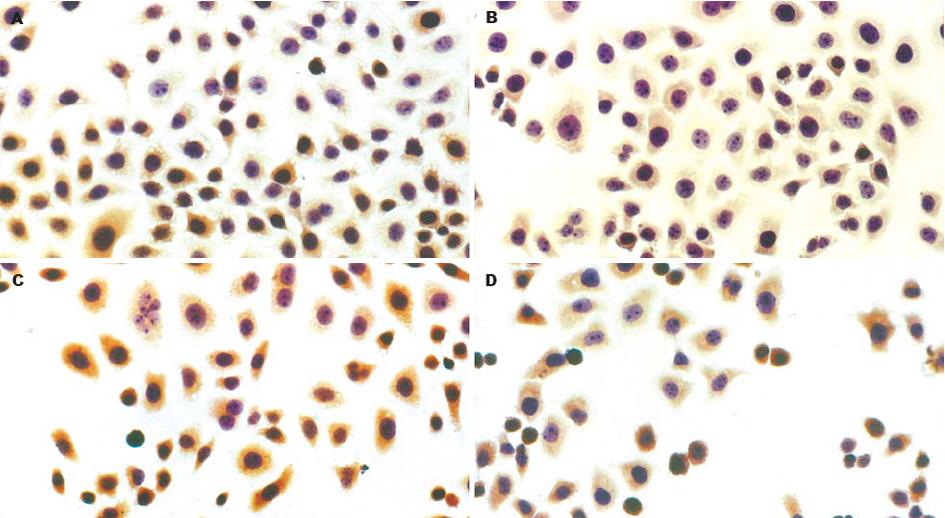
1.2.3 CDC2和CyclinB蛋白表达: 培养细胞分别加入MTT法测得的72 h IC50浓度的大蒜素, 作用24 h后收集细胞, 同时设立不加处理的对照组. 应用细胞爬片方法制成细胞涂片, 行常规SP免疫组化染色, 苏木素复染, 显微镜下观察结果. 判断标准: 以细胞核、细胞质呈清晰棕黄色颗粒为阳性细胞. 高倍视野下查200个细胞, 分别计算阳性细胞百分比, 并换算成治疗组占对照组的阳性细胞的相对百分比.
统计学处理 两样本比较采用χ2检验.
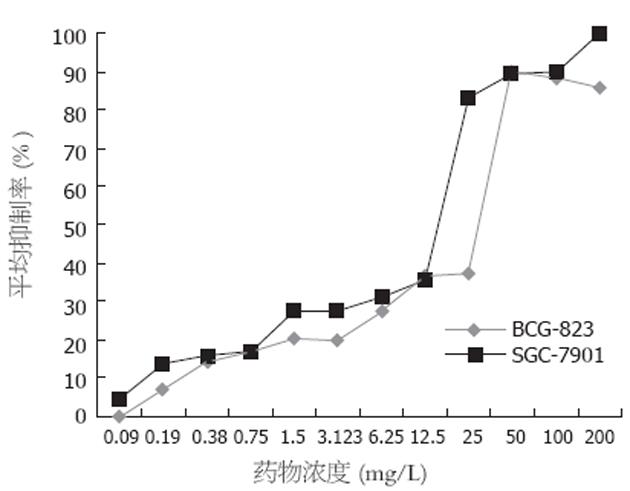
对照组细胞呈正常的对数生长, 大蒜素对SGC-7901和BGC-823两种细胞的生长均有明显的抑制作用, 且呈浓度依赖性(图1). 大蒜素抑制SGC-7901细胞增殖50%的药物浓度(IC50): 72 h为23 mg/L; 大蒜素抑制BGC-823细胞增殖50%的药物浓度(IC50): 72 h为35 mg/L.
2.2 大蒜素对细胞周期的阻滞作用
SGC-7901细胞和BGC-823细胞在IC50浓度大蒜素诱导24, 48 h后收集, 流式细胞仪检测, 结果显示两种细胞的细胞周期均发生了明显的变化, 主要表现为G0/G1期细胞减少, G2/M期细胞增多, S期细胞无明显变化, 提示两种胃癌细胞经大蒜素处理后细胞周期阻滞于G2/M期(P<0.01,表1).
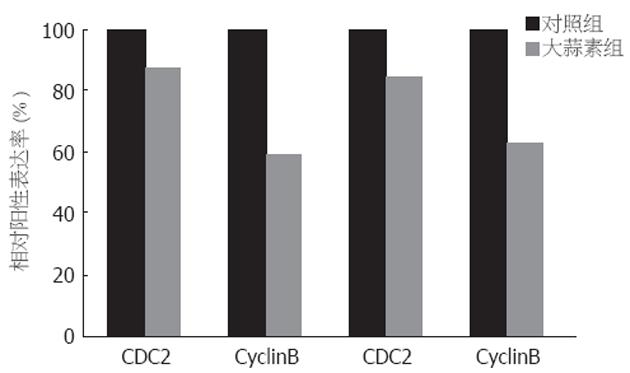
未经大蒜素处理的两种细胞, CDC2和CyclinB蛋白表达均为阳性表达. 经大蒜素处理后, CDC2和CyclinB蛋白表达下降. SGC-7901细胞经23 mg/L大蒜素处理后, CDC2蛋白相对阳性表达率为87.2%; CyclinB蛋白相对阳性表达率为59.3%. BGC-823细胞CDC2蛋白在35 mg/L大蒜素作用后, 相对阳性表达率为84.4%; CyclinB蛋白相对阳性表达率为62.8%(P<0.01,图2-3).
大蒜素是从大蒜球茎中分离出的一种化合物[1]. Filomeni et al[2]发现大蒜素能使神经母细胞SH-SY5Y停滞于G2/M期. Wu et al[3]亦发现大蒜素能使人肝癌细胞(J5)阻滞于G2/M期, 并呈明显的时间、剂量依赖性. Wong et al[4]从大蒜等植物中提取的有机硫化物(OSCs)能阻滞人类白血病细胞于G2/M期. 本结果显示, 不同浓度的大蒜素可以抑制人胃癌细胞株SGC-7901, BGC-823的增殖, 且随着大蒜素浓度的增大, 抑制率逐渐增高, 浓度为0.19 mg/L的大蒜素对SGC-7901的抑制率为12.1%, 当浓度提高到200 mg/L时抑制率则达88.6%. 同样浓度的大蒜素对BGC-823的抑制率分别是6.5%和84.8%, 表现出对胃癌细胞的抑制呈大蒜素浓度依赖性. 通过流式细胞仪的检测, IC50浓度的大蒜素使人胃癌细胞株SGC-7901, BGC-823停滞于G2/M期, 与对照组相比, 两种胃癌细胞株G2/M期比例增高, G0/G1期比例下降, S期比例无明显变化.
细胞周期能否启动进行细胞增殖, 主要的调控点在G1期, 它决定细胞能否通过G1期, 进入S期, 它是细胞周期的驱动机制[5]. G1期检测点能防止DNA受损的细胞进入S期的复制. G2/M期是细胞周期的监控机制[5], 其能确保细胞复制的忠实性[6,7], G2期检测点能防止受损的DNA和未完成复制的DNA进入有丝分裂. G2期向M期的转变涉及到细胞分裂, 包括胞质分裂和核DNA分裂[8], 完成一个细胞向两个细胞的转化. 在肿瘤细胞, 其会以几何倍数增长, 故G2/M期阻滞显得更为重要. 目前G2/M期阻滞的机制不完全清楚.在真核细胞中, 正常细胞G2/M进程由CyclinB-P34CDC2复合物调控. P34CDC2是CDC2基因编码的34 ku的周期蛋白依赖激酶, CyclinB是调节亚基. 在G2后期, 二者结合形成有丝分裂促进因子(MPF), 然后CDC2蛋白N端Thr14和Tyt15脱磷酸化, Thr161磷酸化, 从而被活化而具激酶活性, 进而诱导一系列底物磷酸化, 引导核膜崩解、染色质凝聚等有丝分裂所具有的变化. 目前对G2/M期阻滞的研究主要集中在CyclinB和P34CDC2上. 本结果提示, 未经大蒜素处理的两种细胞, CDC2和CyclinB蛋白表达均为阳性表达.经大蒜素处理后, CDC2和CyclinB蛋白表达下降. SGC-7901细胞经23 mg/L大蒜素处理后, CDC2蛋白相对阳性表达率为87.2%; CyclinB蛋白相对阳性表达率为59.3%. BGC-823细胞CDC2蛋白在35 mg/L大蒜素作用后, 相对阳性表达率为84.4%; CyclinB蛋白相对阳性表达率为62.8%. 结果提示大蒜素作用于胃癌细胞株, 下调CDC2和CyclinB蛋白表达水平, 从而抑制了MPF活性, 阻止细胞进入有丝分裂期, 最终发生G2/M期阻滞. 如果大蒜素协同G2/M期特异性化疗药物治疗肿瘤, 可望更好地抑制和杀死肿瘤细胞.
电编: 张勇 编辑: 潘伯荣 审读: 张海宁
| 1. | Sengupta A, Ghosh S, Bhattacharjee S. Allium vegetables in cancer prevention : an overview. Asian Pac J Cancer Prev. 2004;5:237-245. [PubMed] |
| 2. | Filomeni G, Aquilano K, Rotilio G, Ciriolo MR. Reactive oxygen species-dependent c-Jun NH2-terminal kinase/c-Jun signaling cascade mediates neuroblastoma cell death induced by diallyl disulfide. Cancer Res. 2003;63:5940-5949. [PubMed] |
| 3. | Wu CC, Chung JG, Tsai SJ, Yang JH, Sheen LY. Differential effects of allyl sulfides from garlic essential oil on cell cycle regulation in human liver tumor cells. Food Chem Toxicol. 2004;42:1937-1947. [PubMed] [DOI] |
| 4. | Wong WW, Macdonald S, Langler RF, Penn LZ. Novel synthetic organosulfur compounds induce apoptosis of human leukemic cells. Anticancer Res. 2000;20:1367-1374. [PubMed] |
| 5. | 曾益新主编. 肿瘤学. 第1版. 北京: 人民卫生出版社 1999; 107-112. |
| 6. | Hartwell LH, Kastan MB. Cell cycle control and cancer. Science. 1994;266:1821-1828. [PubMed] [DOI] |
| 7. | Nasmyth K. Viewpoint: putting the cell cycle in order. Science. 1996;274:1643-1645. [PubMed] [DOI] |
| 8. | Heerdt BG, Houston MA, Mariadason JM, Augenlicht LH. Dissociation of staurosporine-induced apoptosis from G2-M arrest in SW620 human colonic carcinoma cells: initiation of the apoptotic cascade is associated with elevation of the mito-chondrial membrane potential(deltapsim). Cancer Res. 2000;60:6704-6713. [PubMed] |