修回日期: 2004-11-10
接受日期: 2004-11-17
在线出版日期: 2005-01-15
目的: 探讨融合表达HBsAg/HBcAg的重组质粒的免疫诱生效果
方法: 从乙肝患者的血清中提取HBV DNA, 采用PCR技术扩增HBV的S和C基因并拼接成SC片段. 构建融合表达质粒pcDNA3.1-SC, 以100 μg肌肉接种BALB/c小鼠, 2, 4 wk后各加强1次. 采用ELISA法检测小鼠血清抗-HBs和抗-HBc, LDH释放法检测体外CTL活性.
结果: 接种后3, 5, 8, 12 wk, 小鼠血清抗-HBs阳性率分别达到50%, 75%, 100%和50%, 抗-HBs滴度在第8 wk达到峰值. 而抗-HBc阳转率低于25%, 抗体最高滴度低于1:5. 小鼠接种后5 wk时的特异性CTL活性为46.9±1.8%(效/靶比100:1).
结论: 融合表达质粒pcDNA3.1-SC能够同时诱生针对HBsAg/HBcAg的特异性细胞免疫和体液免疫应答, 提示研制乙肝的免疫预防和治疗性基因疫苗的可能性.
引文著录: 周陶友, 赵连三, 陈敏, 陈守春, 何芳, 刘丽, 唐红. 融合表达HBsAg/HBcAg的重组质粒诱导的小鼠免疫应答. 世界华人消化杂志 2005; 13(2): 258-260
Revised: November 10, 2004
Accepted: November 17, 2004
Published online: January 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(2): 258-260
- URL: https://www.wjgnet.com/1009-3079/full/v13/i2/258.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i2.258
乙型肝炎病毒(HBV)是引起慢性肝炎的主要病原体之一, 特异性免疫应答水平低下是HBV感染后不能完全清除, 导致病情慢性化的重要原因. 近年研究发现[1-4], 表达乙肝表面抗原(HBsAg)的重组质粒能够诱生特异性的体液免疫应答和细胞免疫应答. 由于乙肝核心抗原(HBcAg)是宿主细胞免疫应答清除HBV的另一重要靶抗原, 含有此二者的疫苗可能更有效地应用于慢性乙肝的免疫预防和免疫治疗. 为此, 我们构建了融合表达HBsAg和HBcAg的重组质粒pcDNA3.1-SC, 经肌肉接种BALB/c小鼠后, 探讨HBcAg和HBsAg联合表达时的免疫诱生效果和相互影响.
哺乳动物表达载体pcDNA3.1购自Invitrogen公司; Pyrobest DNA聚合酶、限制性内切酶、DNA连接试剂购自Takara公司; 质粒DNA纯化试剂盒和DNA胶回收试剂盒购自QIAGEN公司. 乙肝病毒抗-HBs和抗-HBc检测试剂盒购自华美生物工程公司. LDH细胞毒性检测试剂盒购自Roch公司. BALB/c小鼠(H2d)购自上海西浦尔-必凯实验动物有限公司.
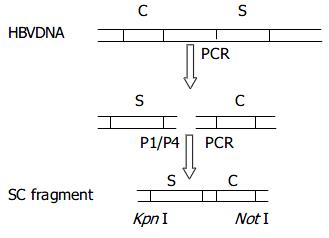
1.2.1 PCR引物设计和合成: 根据中国人群HBV感染流行株主要结构特点, 设计合成下列引物: P1(5'-GCGGGTACCATGGAGAACAC AACATCAGGATTCCTA-3'); P2(5'-GGGGCGGCGCTTAAATGTATACCCAAAGACAAAAGAA-3'); P3(5'-ACCAGAACCACCACCACCAGAACCACCACCACCAATGTATACCCAAAGACAAAAGAA-3'); P4(5'-GATGCGGCCGCTTAACATTGAGATCCCCGAGATTGAGA-3'). 其中, P1、P4分别含有kpn I、Not I酶切位点, P2、P3引物的5'端碱基互补.
1.2.2 HBsAg与HBcAg编码基因的扩增和拼接: 从1例慢性乙肝患者的血清标本中, 通过常规酚/氯仿法提取HBV DNA. 采用引物P1、P2, 通过PCR方法扩增片段S(HBsAg的编码基因); 采用引物P3、P4, 扩增片段C(HBcAg的编码基因). 然后, 以上述2种PCR产物为模板, 采用引物P1、P4, PCR扩增产生融合基因片段SC, 如图1所示.
PCR反应条件设定为94 ℃ 3 min, 56 ℃ 2 min, 72 ℃ 5 min; 94 ℃ 1 min, 56 ℃ 1 min, 72 ℃ 2 min, 循环35次后; 72 ℃ 10 min. PCR产物经10 g/L琼脂糖凝胶电泳, 切胶回收和纯化SC片段.
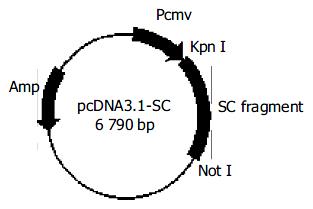
1.2.3 构建融合表达重组质粒pcDNA3.1-SC: 在质粒载体pcDNA3.1的CMV启动子下游, 经Kpn I、Not I酶切位点定向插入融合基因片段SC, 以获得重组质粒pcDNA3.1-SC(图2). 具体操作: 采用Kpn I、Not I双酶切SC片段和质粒载体pcDNA3.1, 酶切后的SC片段与pcDNA3.1按摩尔数之比1:4混合, 然后加入等体积DNA连接试剂, 16 ℃放置过夜. 将连接产物转化感受态大肠杆菌JM109, 筛选阳性重组子. 重组质粒送交上海基康公司测序无误后, 命名为pcDNA3.1-SC; 以pcDNA3.1-SC转染sp2/0细胞后, 能稳定地共表达HBsAg和HBcAg蛋白. 将pcDNA3.1-SC质粒大量扩增、纯化、鉴定后分装, 储存于-80 ℃备用.
1.2.4 免疫接种BALB/c小鼠: 选用6-8 wk龄、清洁级、健康雌性BALB/c小鼠, 随机分为3组, 每组8只. 实验组每只经腓肠肌注射重组质粒pcDNA3.1-SC 100 μg, 对照组接种生理盐水100 μL或pcDNA3.1空载质粒100 μg. 2, 4 wk后各加强接种1次.
1.2.5 血清特异性抗体检测: 分别于初次接种后第3, 5, 8, 12 wk采集小鼠眶静脉血, 血清分离后置-80 ℃保存. 将小鼠血清标本按1:5、1:10、1:25、1:50、1:100、1:250、1:500稀释, 采用乙肝病毒抗-HBs和抗-HBc检测试剂盒(ELISA法), 对上述标本进行统一检测.
1.2.6 体外CTL活性检测: 效应细胞: 全部接种完成后1 wk, 随机抽样实验组和对照组的部分小鼠, 处死后无菌条件下取脾, 制备脾细胞悬液并去除红细胞后, 将脾细胞作为效应细胞, 以进行特异性细胞毒活性(CTL)的体外检测.靶细胞: 以pcDNA3.1-SC转染sp2/0细胞, 将能稳定地共表达HBsAg和HBcAg的细胞克隆作为靶细胞.靶细胞的浓度设定为5107/L. 体外CTL活性检测: 按100:1、50:1、25:1、12.5:1的细胞数比例, 将效应细胞与靶细胞加入96孔培养板, 每种比例3个复孔, 同时设置高限对照(靶细胞最大释放值)、低限对照(靶细胞自然释放值)和本底对照. 将培养板置37 ℃, 50 mL/L CO2条件下孵育4 h; 然后, 在室温下1000 r/min, 离心10 min, 每孔取上清100 μL, 转至96孔酶标板的对应孔; 加入乳酸脱氢酶底物100 μL, 室温避光显色15 min, 自动酶标仪测双峰A值(测量波长490 nm, 参考波长655 nm). 按下述公式计算体外CTL活性:
[(效/靶实验值-效应细胞自然释放值)-靶细胞自然释放值]/(靶细胞最大释放值-靶细胞自然释放值)
统计学处理 采用Intercooled Stata5.0软件, 两均数的t检验进行处理
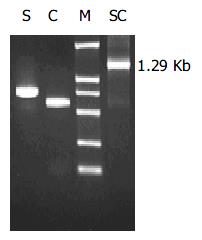
从该乙肝患者的血清中, 分别扩增出约740 bp的S片段和570 bp的C片段. 将S与C片段通过PCR方法拼接, 获得融合基因片段SC(约1.29 kb, 图3).
在质粒载体pcDNA3.1的CMV启动子下游, 定向插入融合基因片段SC, 获得重组质粒pcDNA3.1-SC. 序列分析表明: SC片段全长1287 bp, 其中S片段长678 bp(不含终止密码子), C片段549 bp(不含起始密码子), 中间连接部分为[(GGT)4TCT]4. 上游起始密码子之前3位碱基序列为ACC, 符合真核表达载体的Kozak序列要求. 将S基因序列以Blast格式导入GenBank进行比对分析, 显示其属于基因型C/血清亚型adrq+的HBV病毒株.
抗-HBs: 开始接种后3, 5, 8, 12 wk, 实验组小鼠血清抗-HBs阳转率分别为50%, 75%, 100%和50%. 血清抗-HBs滴度逐渐升高, 在第8 wk达到峰值(最高为1:100). 抗-HBc: 与此同时, 部分小鼠的血清内亦可检出抗-HBc, 不过, 阳转率在3-12 wk均低于25%, 抗体最高滴度低于1:5. 而对照组小鼠血清均未检出上述抗体.
实验组BALB/c小鼠脾细胞对HBsAg和HBcAg抗原表位产生一定水平的特异性CTL活性. 在效/靶比12.5:1、25:1、50:1、100:1时, 体外CTL活性(%)分别为4.2±1.4, 3.1±2.2, 4.2±2.9, 46.9±1.8, 提示其对靶细胞的杀伤作用具有某种阈值效应. 当效/靶比超过50:1后, CTL活性始较对照组急剧增强(P<0.01). 当效/靶比为50:1或更低时, 其CTL活性与对照组(4.4±1.2)无显著差异.
成年人感染HBV后, 大多数表现为急性感染过程, 机体产生针对HBV外膜蛋白(HBsAg)的中和抗体(抗-HBs), 同时产生针对HBV外膜蛋白、核心蛋白(HBcAg)等的特异性细胞免疫应答, 最终导致HBV的完全清除. 当患者的上述免疫应答能力不足时, HBV感染就会慢性化. 传统的乙肝疫苗系HBsAg蛋白抗原, 接种后可以有效地诱生体液免疫应答, 血循环中出现高滴度的抗-HBs, 能够中和入侵的HBV, 达到预防感染的目的, 但不能清除肝细胞内的HBV. 若通过接种"全能化"的疫苗, 在激发机体产生特异性体液免疫应答的同时, 也诱导出强烈的包括CTL在内的细胞免疫应答, 就可以清除业已感染寄生于肝细胞内的HBV. 近年来的研究表明, CTL对病毒的清除包括溶细胞性和非溶细胞性两种机制. 反应适度的细胞免疫应答是安全有效地清除HBV慢性感染的一条可能的途径, 此即研制治疗性疫苗的理论基础[5-10].
我们以中国人群中的HBV流行株基因型C/血清亚型adrq+为蓝本, 构建了重组质粒pcDNA3.1-SC, 能够表达HBcAg和HBsAg融合蛋白抗原, 乙肝病毒核心抗原(HBcAg)不仅可以诱生较强的细胞免疫应答, 同时还能刺激针对HBsAg的Th1型细胞反应[11-12].
本研究旨在观察HBcAg和HBsAg联合表达时的特异性细胞免疫和体液免疫诱生情况, 探讨抗原共表达对免疫诱生效果的影响. 结果显示, 将pcDNA3.1-SC接种正常BALB/c小鼠, 3 wk后血清中即可检出特异性抗-HBs, 并随接种次数的增加而增强; 至第8 wk时, 所有实验组小鼠的抗-HBs均阳转; 同时实验组小鼠脾细胞还可检出较强的体外CTL杀伤活性, Webster et al证实特异性CTL细胞清除肝细胞HBV并不引起明显肝损害[13]. 上述结果表明, 我们所构建的HBsAg和HBcAg融合表达质粒能够同时持续诱生特异性细胞免疫和体液免疫应答, 从而提示研制"全能化"基因疫苗用于预防和治疗乙肝的可能性.
总之, 研制HBcAg和HBsAg复合抗原疫苗具有现实需求的合理性. 但是, 由于涉及到不同基因在同一宿主细胞内表达, 既可能出现不同抗原间的免疫协同优势, 从而增强CD4+Th细胞和CD8+杀伤性T细胞应答; 但亦可能发生一种抗原对另一种抗原的免疫原性形成抑制的现象[14-15]. 我们的实验结果表明, pcDNA3.1-SC可以诱生较强的针对HBcAg和HBsAg的细胞免疫应答, 但诱生体液免疫应答的能力偏低. 虽能使被接种的全部试验鼠血清抗-HBs阳转, 但抗-HBs水平较低, 尤其是诱生抗-HBc的能力较弱, 原因有待于进一步研究. 不过, 由于HBcAg和HBsAg是以融合蛋白的形式表达的, 是否可能因为空间结构的改变, 从而影响到某些抗原表位的显露, 或者影响到抗原肽的递呈处理, 进而削弱了机体的免疫应答效应, 是需要考虑的一些因素.
编辑: 张海宁
| 1. | Zhao LS, Qin S, Zhou TY, Tang H, Liu L, Lei BJ. DNA-based vaccination induces humoral and cellular immune responses against hepatitis B virus surface antigen in mice without activation of C-myc. World J Gastroenterol. 2000;6:239-243. [PubMed] |
| 3. | Rottinghaus ST, Poland GA, Jacobson RM, Barr LJ, Roy MJ. Hepatitis B DNA vaccine induces protective antibody responses in human non-responders to conventional vaccination. Vaccine. 2003;21:4604-4608. [PubMed] |
| 4. | Fissolo N, Riedl P, Reimann J, Schirmbeck R. DNA vaccines prime CD8+ T cell responses to epitopes of viral antigens produced from overlapping reading frames of a single coding sequence. Eur J Immunol. 2005;35:117-127. [PubMed] |
| 6. | Zhou FJ, Hu ZL, Dai JX, Chen RW, Shi K, Lin Y, Sun SH. Protection of tree shrews by pVAX-PS DNA vaccine against HBV infection. DNA Cell Biol. 2003;22:475-478. [PubMed] |
| 7. | Chen L, Shao HJ, Su YB. Coimmunization of Agaricus blazei Murill extract with hepatitis B virus core protein through DNA vaccine enhances cellular and humoral immune responses. Int Immunopharmacol. 2004;4:403-409. [PubMed] |
| 8. | Gerdts V, Tsang C, Griebel PJ, Babiuk LA. DNA vaccination in utero: a new approach to induce protective immunity in the newborn. Vaccine. 2004;22:1717-1727. [PubMed] |
| 9. | Mancini-Bourgine M, Fontaine H, Scott-Algara D, Pol S, Bréchot C, Michel ML. Induction or expansion of T-cell responses by a hepatitis B DNA vaccine administered to chronic HBV carriers. Hepatology. 2004;40:874-882. [PubMed] |
| 10. | Puaux AL, Marsac D, Prost S, Singh MK, Earl P, Moss B, Le Grand R, Riviere Y, Michel ML. Efficient priming of simian/human immunodeficiency virus (SHIV)-specific T-cell responses with DNA encoding hybrid SHIV/hepatitis B surface antigen particles. Vaccine. 2004;22:3535-3545. [PubMed] |
| 11. | Aguilar JC, Lobaina Y, Muzio V, García D, Pentón E, Iglesias E, Pichardo D, Urquiza D, Rodríguez D, Silva D. Development of a nasal vaccine for chronic hepatitis B infection that uses the ability of hepatitis B core antigen to stimulate a strong Th1 response against hepatitis B surface antigen. Immunol Cell Biol. 2004;82:539-546. [PubMed] |
| 12. | Shi TD, Wu YZ, Jia ZC, Zhou W, Zou LY. Therapeutic polypeptides based on HBcAg(18-27) CTL epitope can induce antigen-specific CD(8)(+) CTL-mediated cytotoxicity in HLA-A2 transgenic mice. World J Gastroenterol. 2004;10:1222-1226. [PubMed] |
| 13. | Webster GJ, Reignat S, Maini MK, Whalley SA, Ogg GS, King A, Brown D, Amlot PL, Williams R, Vergani D. Incubation phase of acute hepatitis B in man: dynamic of cellular immune mechanisms. Hepatology. 2000;32:1117-1124. [PubMed] |
| 14. | Kjerrström A, Hinkula J, Engström G, Ovod V, Krohn K, Benthin R, Wahren B. Interactions of single and combined human immunodeficiency virus type 1 (HIV-1) DNA vaccines. Virology. 2001;284:46-61. [PubMed] |
| 15. | Kwon TK, Park JW. Intramuscular co-injection of naked DNA encoding HBV core antigen and Flt3 ligand suppresses anti-HBc antibody response. Immunol Lett. 2002;81:229-234. [PubMed] |