修回日期: 2004-11-22
接受日期: 2004-11-29
在线出版日期: 2005-01-15
用溶于食用油的CCl4来诱导肝硬化是最经典、最确切的实验模型. CCl4进入体内后, 被细胞色素P450代谢产生活性物质, 通过脂质过氧化、共价结合等机制引起选择性肝损伤; 同时许多恢复因子也参与了肝硬化发生. 血管活性物质对肝脏血流的调控在门脉高压的发生中起重要作用.
引文著录: 许永乐, 蔡大勇, 唐朝枢. CCl4导致肝硬化和门脉高压的机制. 世界华人消化杂志 2005; 13(2): 235-238
Revised: November 22, 2004
Accepted: November 29, 2004
Published online: January 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(2): 235-238
- URL: https://www.wjgnet.com/1009-3079/full/v13/i2/235.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i2.235
CCl4诱导肝硬化的特点[1]: (1)肝硬化的发生与给药途径无关: 最经典、最确切的实验模型是用溶于甘油、花生油、橄榄油50%CCl4来诱导肝硬化: 每kg大鼠2次/wk, 0.3 mL/次灌胃, 胃连续6周半; 犬2次/wk, 0.24 mL/次, 腹腔注射连续8 wk、大鼠2次/wk, 0.2 mL/次, 皮下注射连续12 wk等均可引起肝硬化, 早期氨基转移酶升高、晚期出现A/G倒置和胆红素升高, 肝细胞出现脂肪变性、细胞水肿、坏死以及纤维增生. (2)CCl4剂量决定肝病变: CCl4剂量依赖毒性涉及到多种机制. 短时程低剂量CCl4导致Ca2+释放、膜损伤、凋亡、再生以及产生细胞因子等; 中剂量则导致脂变、纤维化、硬化甚至癌变;高剂量则直接造成肝细胞坏死, 出现肝衰竭; 极限量CCl4将会对多种脏器损伤, 出现中枢抑制、呼吸衰竭甚至死亡. (3)CCl4诱导肝损伤的细胞定位: CCl4毒性作用始于非饱和脂肪酸过氧化, 破坏生物膜. CCl4被肝细胞的混合功能氧化酶(细胞色素P450)代谢为有活性的毒性产物; 毒物或直接与DNA、脂类、蛋白质或糖类等靶分子形成共价键, 或通过脂质过氧化、活态氧、氧化型谷胱甘肽等继发反应使靶分子发生改变. 口服给药2 h内CCl4在肝脏内聚集达到高峰, 2 h出现内质网甘油三酯和微粒体酶合成减少, 3 h微粒体内脂类增加, 5 h细胞发生坏死出现组织紊乱, 12 h肝小叶中央区坏死明显, 48 h大面积坏死. 内质网、质膜、线粒体、Golgi复合体为最主要的损害细胞器支持生物膜是CCl4攻击的起始部位. 肝脏的修复过程有可能使肝脏恢复正常的生理功能.
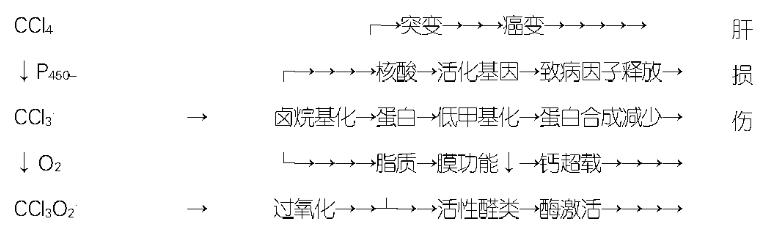
CCl4肝毒性是一个多因素的过程[1], 损伤机制涉及脂质过氧化、共价结合、活性醛类、核酸低甲基化、Ca2+超载以及一些炎性细胞因子.
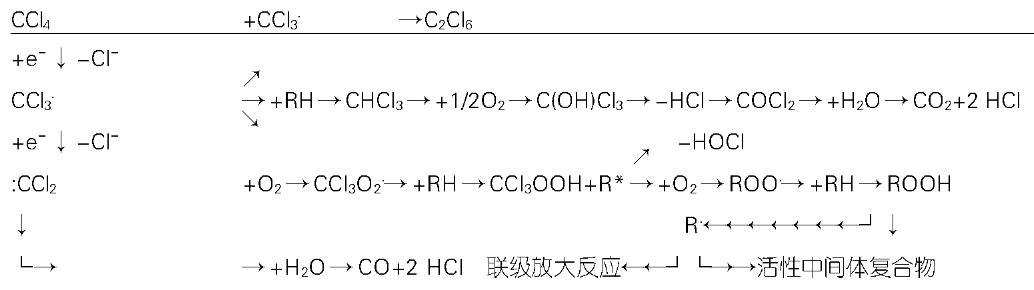
(1)CCl3. 自由基、卤烷化物和P450失活: 肝细胞内质网上P450系统将CCl4转化为CCl3. 自由基(图1), 线粒体内能检测到自由基成分. 存在CCl3. 自由基的证据有: 自由基清除剂对这一损伤过程具有保护作用; 脱氢反应发生后, 可检测到CHCl3; 体内可以检测到CCl3. 二聚化产物(C2Cl6); 用自由电子捕获剂丁基硝基苯后, 肝细胞内能检测到CCl3-丁基硝基苯. 在多种细胞色素同工酶中, 生物转化CCl4的主要是P2E1, 其次为P2B1和P2B2;高剂量CCl4时, P3A等其他酶也会有很大的作用. CCl3. 能够与P2E1的酶活性部位或血红素基团形成共价键, 从而导致其自毁性失活. 该酶对CCl4毒性很敏感, 本身也比其他同工酶的半衰期短, 而且与微粒体泛素结合蛋白形成联合体, 使P2E1容易发生蛋白酶选择性降解, 这些导致了P450失活. CCl3. 能和氨基酸、核苷酸、脂肪酸、蛋白质、核酸、脂类等多种有重要作用的生物分子反应. (2)CCl3OO.、脂质过氧化和膜损伤: 在有氧的条件下, CCl3. 与氧反应可生成过氧化自由基CCl3OO(图1). 这是一个比CCl3. 活性更高、半衰期更短、使不饱和脂肪酸更易发生氧化反应的自由基. 不饱和磷脂最容易被CCl3OO. 过氧化. 结合了一个三氯甲基的脂肪酸比前体少了一个不饱和键, 就能抵抗磷脂酶A2的降解作用. 氧化反应能启动一系列连锁发应, 一直到多不饱和脂肪酸完全饱和为止, 同时生成醛类、其他的羰基化合物和烃类, 即脂质过氧化. 过氧化脂质通过影响膜功能或中间活性产物的共价键形成(见下文)损害细胞功能.
自由基形成引起共价结合(特指卤烷基化)和脂质过氧化, 共同造成细胞损伤, 早期都是可逆的, 晚期可致细胞死亡. 卤烷基化直接与细胞成分形成共价键, 立即导致细胞功能的障碍, 造成的损害早于起主导作用、需要系列链式反应后才发挥继发损伤效应的脂质过氧化. CCl4造模同时加上能够预防脂质过氧化的维生素E, 可区分CCl4肝毒性前期的卤烷基化损害和后期的脂质过氧化损伤(图2).
脂质过氧化过程中所形成的羰基化合物具有损伤细胞的能力, 能对细胞造成进一步的破坏. CCl4肝毒性晚期, 活性醛类在给超过机体能处理剂量的CCl4后6 h才出现, 24 h达到峰值, 36到72 h后消失. 活性醛类大量灭活氨基酸或巯基, 从而抑制酶活性、破坏DNA结构、阻滞蛋白质分泌. 由于活性醛类比CCl3.、CCl3OO. 等自由基的活性小, 所以可以把毒性效应传到更远的组织细胞. 不同的羰基产物之间的活性有很大差别. 如肝细胞内浓度可达0.1-0.5 mol/L的4-OH-2, 3-多壬烯醛仅在0.1 μol/L时就能抑制腺苷酸环化酶、Ca2+-ATP酶、Na+-K+-ATP酶或磷酸酶和蛋白激酶的活性(图2).
CCl4能造成核糖体RNA和DNA出现低甲基化. 体外对CCl4处理过的核糖体进行再甲基化可以恢复其功能, 胞内核糖体RNA低甲基化与Ca2+的失常有关. CCl4处理大鼠3 wk后, 肝DNA全面发生低甲基化, 给以S腺苷蛋氨酸(SAM)可以弥补这种甲基的不足. 体外培养试验肝细胞上, SAM并不能阻止CCl4对蛋白质合成的抑制, 却可以保护细胞免受CCl4的毒害; 同样用药物3-deazaadenosine将甲基化过程阻断, 使磷脂酰胆碱不能由磷脂酰乙醇胺合成, 最终导致了极低密度脂蛋白分泌的减少. CCl4诱导的低甲基化首先影响了脂类和脂蛋白的代谢, 从而使卤烷基化得以发生(图2).
细胞外液Ca2+浓度(1.3 mol/L)比细胞内(0.05-2 μmol/L)要高约4个数量级; 而细胞内的Ca2+存在于胞质(低)、内质网(高)、线粒体(高), 各有专用的离子泵来维持. CCl4毒性产生的活性醛类可使Ca2+-ATP酶等灭活, 而使细胞Ca2+稳态出现紊乱. 不同CCl4剂量可造成早期效应、晚期效应和特异性溶剂效应. (1)早期效应: 0.172 mol/L CCl4作用15 min后就可以观察到内质网、线粒体上Ca2+单向主动转运降低, Ca2+进入胞质而浓度升高; 由于0.172 mol/L时质膜上Ca2+主动转运仍然正常, 还有可能维持胞质内Ca2+的相对稳定, 即早期效应是可逆的. (2)晚期效应: 虽然0.172 mol/L CCl4作用2-4 h后胞内Ca2+可以恢复正常, 但CCl4持续作用8-12 h后会出现更严重的、不可逆的、致细胞死亡的Ca2+超载. CCl4持续作用12 h以上, ATP耗尽、离子泵失活、质膜屏蔽性消失, 导致胞外Ca2+大量进入细胞内, 胞质的Ca2+浓度不可控的急剧升高. (3)特异性溶解效应: CCl4浓度在60-90 nM时能观察到特定的溶解效应. Ca2+超载能激活PKC和钙激活蛋白酶而启动级联反应, 能破坏细胞骨架成分, 还直接激活蛋白酶、核酸内切酶、磷脂酶等分解酶, 共同导致细胞溶解死亡. 但封闭Ca2+内流、抑制蛋白酶和磷脂酶活性、或在无Ca2+环境下培养细胞均都不能阻止细胞死亡; CCl4激活磷酸化酶而耗尽肝糖元、活态氧破坏线粒体功能等机制可造成ATP耗尽, 与Ca2+超载协同作用才引起细胞溶解坏死(图2).
CCl4既引起肝细胞浊肿、脂肪变性、死亡、纤维化、硬化、癌变等加重病情的病变, 也诱导多种恢复机制. 维持或补足细胞ATP和肝细胞有丝分裂活性都是启动细胞恢复的前提; 抗氧化剂或抗胶原纤维沉积剂可逆转肝脂变、纤维化和硬化, 某些中草药可以抵抗肝细胞癌变. 透明质酸和硫酸软骨素具有抗氧化作用, 减少金属蛋白酶组织抑制剂的表达, 葡萄糖胺聚糖可能影响肝脏纤维化过程中金属蛋白酶和金属蛋白酶组织抑制剂的平衡[2]. 在CCl4肝损大鼠肝脏中诱导产生了大量热休克蛋白70、DnaJ家族和热休克蛋白90等细胞溶质的侣伴蛋白, 能保护肝细胞免受损害[3]. 由于P450水平太低和肝细胞分裂活性强, 幼年动物往往对CCl4的毒性敏感度低.
肝细胞、Kupffer细胞和星形(储脂或Ito)细胞所分泌的多种因子调控了细胞恢复机制. 其中Kupffer细胞受CCl4刺激后可以释放TNFα、NO、TGF-β和IL-1、IL-6、IL-10. Ito细胞一旦被CCl4激活后表现出典型的急性期反应, 表型转化为纤维细胞, 释放NO, 大量分泌Ⅰ型胶原蛋白, 促进肝硬化. (1)一氧化氮协助肿瘤坏死因子(TNFα)逆转肝损伤: 正常肝细胞对TNFα不起反应, 但CCl4作用后RNA和蛋白质合成受到抑制时肝细胞对TNFα的敏感性大为增加. TNFα可以进一步诱导肝组织表达核活化蛋白AP-1的组成成分、核因子NFκB和STAT3. TNFα在CCl4诱导的肝细胞病变中的作用有保护和损伤两方面. TNF-α通过TNFαR I和TNFαR II两种不同受体对毒物作出反应. TNFαR I敲除的小鼠无NFκB、IL-6和STAT3的作用, 表明TNFαR I介导肝的再生. 正常时, TNFα通过TNFαR I抑制肝细胞凋亡, 而当蛋白合成受抑制时, 他又成了细胞的致死因素. 同时通过TNFαR II可以抵消TNFαR I所造成的组织损伤. 这一过程涉及到NFκB, 他可以控制细胞因子和其他信号转导子的合成, 并通过激活存活基因来抑制细胞凋亡. NFκB与甘草甜素结合后可以预防CCl4导致的肝损伤和硬化[5]. NO能预防TNFα直接导致的凋亡性损伤, TNFα或TNFαR I敲除的小鼠或补充NO水平时肝损伤都会减少, 而NO合成酶-II敲除小鼠却有增加. 氧应激时产生过氧自由基O2., 会与NO形成有很强攻击力的过氧化氮族化合物, 对肝脏造成严重的损伤. 通过这一信号转导途径, TNFα还可以影响Kupffer细胞和Ito细胞. 再加上IL-6, 影响着肝的恢复. (2)白介素减轻损伤而加重纤维化: IL-6是通过增加金属硫蛋白、NFκB和STAT3合成而对抗TNFα对组织损伤的急性反应因素; CCl4损伤以TNFα介导的机制增加IL-6的合成. 金属硫蛋白具有稳固细胞膜而保护细胞的作用. IL-6敲除小鼠对CCl4导致坏死和纤维化的敏感性增加, 表现DNA合成和有丝分裂的减少以及细胞凋亡的增加. CCl4损伤时IL-8几倍上调, 进而降低细胞生存能力. Kupffer细胞内增加的IL-10具有抗炎作用, 损伤明显减轻但纤维化加重. TGF、IL-6等细胞因子参与了肝硬化的发病, 而IL-10具有抗肝肝硬化的作用[4]. (3)生长转化因子使纤维化加剧: TGFβ促进Ito细胞转化为成纤维细胞; TGFβ增加组织抑制因子-1(基质金属蛋白酶的高效抑制剂), 阻止了新合成的胶原的降解, 导致了纤维化. TGFβ还能抑制肝的再生, 所提供的有丝分裂信号可能肿瘤生成有关. TGFβ在Ito细胞的纤维生成反应中起了关键的作用. 只要Ito细胞保持活性, 就会不断产生细胞基质, 纤维化就不断进行; 通过凋亡和增生来获得修复的作用被TGFβ和(或)TNFα所抑制. TGFβ诱导了血纤溶酶原活性抑制因子-1, 从而拮抗血纤溶酶原降解纤维基质、恢复Ito细胞的作用. 血管内皮(细胞)生长因子能保护CCl4诱导的肝损伤[5]. 肝细胞生长因子c-met信号途径在肝脏再生、肝细胞存活和肝组织重构中起关键作用[6].
以往认为肝硬化发生门静脉高压只是窦前的动静脉吻合、肝血窦的减少和窦后的肝静脉受压等器质性变化, 近年来发现内皮素、血管紧张素II、血管加压素、前列腺素F2/凝血酶、P物质、血小板活化因子、腺苷和溶血磷脂酸等引起肝星状细胞收缩, 而一氧化氮、一氧化碳、心钠素、肾上腺髓质素、生长抑素、前列腺素I2/E2或Rho激酶抑制剂等引起肝星状细胞舒张. 血管活性物质"收缩效应相对增加"导致肝血窦收缩、肝内门脉血流阻力增加和肝窦毛细血管化, 在门脉压力升高机制中起关键作用[7]. 门静脉结扎引起门静高压时, 同时出现门静脉热休克蛋白表达升高、门静脉Ach依赖性舒张降低, 提示热休克蛋白参与门静脉高压形成[8]. (1)一氧化氮逆转门静脉高压: 肝内3种一氧化氮合酶催化合成内源性NO. 外/内源性的NO通过增加cGMP降低细胞内游离Ca2+, 引起肝星状细胞显著舒张; 在肝硬化时, 一氧化氮合酶活性降低, 肝内NO产生减少, 肝星细胞收缩, 肝窦血管阻力增加[9]. CCl4肝硬化大鼠门静脉内转染血管内皮结构性一氧化氮合酶基因5 d后能部分恢复门静脉内基因表达和蛋白含量, 门静脉压力回降; 而体循环和肺循环中无一氧化氮合酶表达、无血流动力学变化; 说明一氧化氮合酶参与了肝硬化门脉高压的发病[10]. 一氧化氮合酶-3基因敲除小鼠肝动脉一氧化氮合酶-1 mRNA5.6倍增加、蛋白质8.8倍增加能部分代偿一氧化氮合酶-3的缺乏, 肝动脉NO产量只有对照小鼠的52%; 胆总管结扎诱导一氧化氮合酶-1在肝动脉mRNA2.4倍增加、蛋白质7.1倍增加也涉及到肝脏血流和门脉压的调节, 肝硬化患者肝动脉一氧化氮合酶-1 mRNA水平增加24.5倍[11]. (2)内皮素加剧门静脉高压: 肝硬化时肝星状细胞和窦内皮细胞等局部组织细胞的内皮素及其受体合成增加而分解减少, 使局部和血液的内皮素浓度和作用显著增加; 内皮素能激活肝星状细胞增生并转变为肌成纤维细胞, 大量分泌细胞外基质加剧纤维化进程; 同时内皮素使肌成纤维细胞收缩降低肝内血流[12]. 使用内皮素受体拮抗剂能显著改善CCl4性肝硬化的门静脉高压, 恢复肝脏功能, 并通过细胞因子而减轻肝硬化病变[13]. 肝硬化患者肝脏内皮素-1水平显著增加, 与病情和门静脉高压的程度一致; 内皮素、内皮素受体、内皮素转化酶主要在纤维化区域、重构血管部位表达, 肝硬化时增加; 虽然内皮素受体mRNA的表达增加与肝细胞内皮素水平呈负相关, 可是内皮素转化酶在蛋白水平上增加而在mRNA水平上降低; 说明肝硬化患者内皮素系统被激活与病情的恶化有关, 但详细的调节机制较为复杂[14]. (3)血管紧张素加剧门脉高压: 临床研究发现血管紧张素II在门静脉高压的发病中起重要作用, 尤其在疾病的后期患者肾素-血管紧张素-醛固酮系统过度激活以补偿外周血管扩张和维持动脉血压, 此时抑制血管紧张素II的有利作用在于降低肝脏内血流阻力(通过舒张活化了的星状细胞/肌纤维母细胞)一定程度上被其体循环的有害作用所抗衡. 抑制血管紧张素II阻止门静脉高压发生和发展, 抑制星状细胞增生[15]. (4)心钠素降低门脉高压: 无环状机构的心钠素类似物质心钠素4-23能选择性作用于肝硬化大鼠心钠素受体2, 从而降低门静脉压15%, 增加血流30%, 但也显著增加门静脉的血流阻力30%, 对体循环无明显影响. 提示心钠素4-23能选择性扩张肝硬化时的门静脉[16]. (5)肾上腺髓质素降低门脉高压: 慢性门脉高压时血浆肾上腺髓质素增高且与病变程度呈正相关, 而肾上腺髓质素也与NO的升高正相关[17]. 一氧化氮合酶3基因敲除小鼠有体循环平均动脉血压的升高, 但不发生门脉高压; 一氧化氮合酶-3基因敲除小鼠和野生型小鼠胆道结扎时却都出现了体循环平均动脉血压的降低和门脉高压, 定量RT-PCR发现肝脏cannabinoid受体, 肾上腺髓质素和一氧化氮合酶-2的mRNA含量升高; 在胆道结扎的一氧化氮合酶-3基因敲除小白鼠一氧化氮合酶-1和肾上腺髓质素受体的mRNA含量升高. 说明肾上腺髓质素系统参与了一氧化氮合酶-3基因敲除小白鼠不发展为门脉高压的代偿过程[18]. (6)血小板活化因子加剧门静脉高压: 肝脏是血小板活化因子合成和发挥作用的主要部位, 血小板活化因子具有收缩肝脏血管和扩张体循环血管功效. CCl4性肝硬化大鼠血小板活化因子及其受体增加, 基础门静脉压力升高, 对血小板活化因子的反应性增加, 对血小板活化因子受体阻断剂门静脉的反应性增加23%而体循环对阻断剂反应性无明显变化. 从肝硬化大鼠分离的肝星状细胞的血小板活化因子受体密度增加, 说明血小板活化因子及其受体上调参与了门静脉高压的发病[19].
基因芯片研究CCl4诱导肝硬化过程中显示有3倍以上差异的基因表达, 2 wk时22个差异基因中17个上调; 4 wk时166个差异基因中156个细胞骨架, 动力蛋白, 激素受体, 蛋白磷酸化酶, ras相关蛋白等基因上调, 而P450相关蛋白, 核糖体蛋白, 脂肪酸结合蛋白, 生长因子受体等基因下调; 6 wk时154个差异基因中84个上调;8 wk时260个差异基因中246个细胞外信号转导, 生长因子, 细胞周期, 凋亡蛋白, 激素受体等基因上调, 而脂肪代谢蛋白, 激素受体, 氨基酸受体等基因下调; 其中新西兰Deaconess转录因子, 盘状球蛋白, α-1抑制因子Ⅲ等是新发现表达增加的基因[20]. 对丙型肝炎病毒肝硬化晚期患者增生结节的基因差异表达显示存在53种基因持续异常表达, 发现caveolin-1, semaphoring-E和酪氨酸激酶3配体等新基因可能与肝细胞癌变有关[21]. 用含8448种基因的芯片对1位肝硬化并发肝细胞癌患者的12个增生结节和5个肝细胞癌结节作基因差异表达; 与肝细胞癌结节比较, 肝硬化结节中有72个基因上调和57个基因下调, 受体型激酶等几种细胞内激酶上调; 在肝细胞癌结节和肝硬化结节中同时有7个基因上调和31个基因下调; 提示2种结节之间的联系[22]. 用含14814种基因的芯片对肝纤维化大鼠肝脏作基因差异表达, 750个基因上调和345个基因下调, 差异表达基因的功能可用于分析肝纤维化的结构重构和机能缺陷; 相关分析显示95种基因与肝硬化程度有关; 为选择治疗靶点和监测病情程度提供了遗传学依据[23]. cDNA微阵列发现在CCl4肝纤维大鼠肝脏中肝纤维差异基因、PTAFR、CYP2D6、FGG等许多与炎症、代谢有关的基因表达均上调, 甘草酸治疗后恢复正常表达, 说明甘草酸调控基因转录可能是其抗肝纤维化作用的机制之一[24].
编辑: 张海宁
| 1. | Weber LW, Boll M, Stampfl A. Hepatotoxicity and mechanism of action of haloalkanes: carbon tetrachloride as a toxicological model. Crit Rev Toxicol. 2003;33:105-136. [PubMed] |
| 2. | Campo GM, Avenoso A, Campo S, D'Ascola A, Ferlazzo AM, Calatroni A. The antioxidant and antifibrogenic effects of the glycosaminoglycans hyaluronic acid and chondroitin-4-sulphate in a subchronic rat model of carbon tetrachloride-induced liver fibrogenesis. Chem Biol Interact. 2004;148:125-138. [PubMed] |
| 3. | Lee KJ, Terada K, Oyadomari S, Inomata Y, Mori M, Gotoh T. Induction of molecular chaperones in carbon tetrachloride-treated rat liver: implications in protection against liver damage. Cell Stress Chaperones. 2004;9:58-68. [PubMed] |
| 4. | Zhang LJ, Yu JP, Li D, Huang YH, Chen ZX, Wang XZ. Effects of cytokines on carbon tetrachloride-induced hepatic fibrogenesis in rats. World J Gastroenterol. 2004;10:77-81. [PubMed] |
| 5. | Marino G, Piazzese E, Gruttadauria S, Nicotra G, Guarnaccia M, Emmanuele G, Di Francesco E, Travali S, Bartoloni G, Messina A. Innovative use of the vascular endothelial growth factor in an experimental model of acute liver failure. G Chir. 2004;25:61-64. [PubMed] |
| 6. | Huh CG, Factor VM, Sánchez A, Uchida K, Conner EA, Thorgeirsson SS. Hepatocyte growth factor/c-met signaling pathway is required for efficient liver regeneration and repair. Proc Natl Acad Sci USA. 2004;101:4477-4482. [PubMed] |
| 7. | Reynaert H, Thompson MG, Thomas T, Geerts A. Hepatic stellate cells: role in microcirculation and pathophysiology of portal hypertension. Gut. 2002;50:571-581. [PubMed] |
| 8. | Ai JH, Yang Z, Qiu FZ. Role of heat shock protein 90 in hyperdynamic circulation of portal hypertensive rats. Zhonghua Yixue Zazhi. 2004;84:9-13. [PubMed] |
| 10. | Van de Casteele M, Omasta A, Janssens S, Roskams T, Desmet V, Nevens F, Fevery J. In vivo gene transfer of endothelial nitric oxide synthase decreases portal pressure in anaesthetised carbon tetrachloride cirrhotic rats. Gut. 2002;51:440-445. [PubMed] |
| 11. | Biecker E, Neef M, Sägesser H, Shaw S, Koshy A, Reichen J. Nitric oxide synthase 1 is partly compensating for nitric oxide synthase 3 deficiency in nitric oxide synthase 3 knock-out mice and is elevated in murine and human cirrhosis. Liver Int. 2004;24:345-353. [PubMed] |
| 13. | Thirunavukkarasu C, Yang Y, Subbotin VM, Harvey SA, Fung J, Gandhi CR. Endothelin receptor antagonist TAK-044 arrests and reverses the development of carbon tetrachloride induced cirrhosis in rats. Gut. 2004;53:1010-1019. [PubMed] |
| 14. | Ikura Y, Ohsawa M, Naruko T, Muraguchi T, Hirayama M, Suekane T, Fukushima H, Sugama Y, Shirai N, Kayo S. Expression of the hepatic endothelin system in human cirrhotic livers. J Pathol. 2004;204:304-310. [PubMed] |
| 15. | Vlachogiannakos J, Tang AK, Patch D, Burroughs AK. Angiotensin converting enzyme inhibitors and angiotensin II antagonists as therapy in chronic liver disease. Gut. 2001;49:303-308. [PubMed] |
| 16. | Moreau R, Tazi KA, Komeichi H, Pussard E, Lebrec D. Haemodynamic responses to a ring-deleted analogue of atrial natriuretic peptide in rats with cirrhosis. Liver. 2000;20:88-92. [PubMed] |
| 17. | Tahan V, Avsar E, Karaca C, Uslu E, Eren F, Aydin S, Uzun H, Hamzaoglu HO, Besisik F, Kalayci C. Adrenomedullin in cirrhotic and non-cirrhotic portal hypertension. World J Gastroenterol. 2003;9:2325-2327. [PubMed] |
| 18. | Biecker E, Sägesser H, Reichen J. Vasodilator mRNA levels are increased in the livers of portal hypertensive NO-synthase 3-deficient mice. Eur J Clin Invest. 2004;34:283-289. [PubMed] |
| 19. | Yang Y, Nemoto EM, Harvey SA, Subbotin VM, Gandhi CR. Increased hepatic platelet activating factor (PAF) and PAF receptors in carbon tetrachloride induced liver cirrhosis. Gut. 2004;53:877-883. [PubMed] |
| 21. | Anders RA, Yerian LM, Tretiakova M, Davison JM, Quigg RJ, Domer PH, Hoberg J, Hart J. cDNA microarray analysis of macroregenerative and dysplastic nodules in end-stage hepatitis C virus-induced cirrhosis. Am J Pathol. 2003;162:991-1000. [PubMed] |
| 22. | Nagai H, Terada Y, Tajiri T, Yabe A, Onda M, Nagahata T, Ezura Y, Minegishi M, Horiguchi M, Baba M. Characterization of liver-cirrhosis nodules by analysis of gene-expression profiles and patterns of allelic loss. J Hum Genet. 2004;49:246-255. [PubMed] |