修回日期: 2005-06-11
接受日期: 2005-06-13
在线出版日期: 2005-10-15
目的: 了解复方甘草甜素调节细胞周期素依赖性激酶1(CDK1)基因启动子的活性, 为甘草甜素的作用机制提供理论依据.
方法: 以我室构建的细胞周期素依赖性激酶1启动子报告基因表达载体pCAT3-CDK1-P瞬时转染HepG2细胞, 并用复方甘草甜素刺激, 同时以转染pCAT3 basic的HepG2细胞为阴性对照, 复方甘草甜素刺激后24 h后收获细胞. 用酶联免疫吸附法(ELISA)检测细胞中氯霉素乙酰转移酶(CAT)的表达活性.
结果: 质粒pCAT3-CDK1-P在HepG2细胞中能够激活CAT的表达, 而用复方甘草甜素刺激后抑制HepG2细胞中CAT的表达. pCAT3-CDK1-P转染HepG2细胞中, CAT表达活性是pCAT3-basic空载体的12.4倍, 是甘草甜素刺激转染pCAT3-CDK1-P的HepG2细胞的9.3倍.
结论: 复方甘草甜素可以下调CDK1基因启动子的活性, 进而下调CDK1基因的表达, 为深入了解甘草甜素在肝纤维化和肝癌中的作用机制提供新的分子生物学依据.
引文著录: 王志凌, 成军, 张连峰, 邵凤娟, 刘蔚, 刘妍, 陶明亮. 复方甘草甜素下调细胞周期素依赖性激酶1启动子表达. 世界华人消化杂志 2005; 13(19): 2381-2385
Revised: June 11, 2005
Accepted: June 13, 2005
Published online: October 15, 2005
AIM: To investigate the regulatory effects of the glycyrrhizin on the expression of cyclin-dependent kinase 1 (CDK1) gene promoter as well as its molecular biological mechanisms.
METHODS: The report gene expression vector pCAT3-CDK1-P was transfected into the HepG2 cell line, and then stimulated with glycyrrhizin. The HepG2 cells transfected with pCAT3-basic was used as a negative control. The expression level of chloramphenicol acetyltransferase (CAT) in the transfected HepG2 cells was detected by enzyme-linked immunoassay (ELISA) after 24 h.
RESULTS: pCAT3-CDK1-P activated the expression of CAT in HepG2 cells, while the glycyrrhizin inhibited it. The activity of CAT in pCAT3-CDK1-P transfected cells without stimulation was 9.3 times as high as that in pCAT3-CDK1-P transfected cells stimulated with glycyrrhizin, and 12.4 times as high as that in pCAT3-basic transfected cells.
CONCLUSION: Glycyrrhizin can down-regulate the expression of CDK1 gene promoter, and further down-regulate the expression of CDK1 gene.
- Citation: Wang ZL, Cheng J, Zhang LF, Shao FJ, Liu W, Liu Y, Tao ML. Down-regulatory effects of glycyrrhizin on expression of cyclin-dependent kinase 1 gene promoter. Shijie Huaren Xiaohua Zazhi 2005; 13(19): 2381-2385
- URL: https://www.wjgnet.com/1009-3079/full/v13/i19/2381.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i19.2381
复方甘草甜素(glycyrrhizin, GL)是从甘草的根茎提取的一种有效药理成分, 是由2分子的葡萄糖醛酸与甘草酸组成的复合物, 具有多种药理作用. 研究表明, 甘草甜素能够抗乙型肝炎和丙型肝炎病毒、保护肝细胞、避免肝损害, 并且具有潜在的抑制肝细胞肿瘤增生的作用[1]. 但是目前对甘草甜素药理作用的分子生物学机制仍不十分了解. 我们用构建的pCAT3-CDK1-P报告基因载体, 转染人肿瘤细胞系HepG2细胞后用甘草甜素刺激, 应用报告基因氯霉素乙酰转移酶(CAT)共转染瞬时表达系统, 测得下游CAT基因的表达减弱. 证明甘草甜素可下调CDK1启动子活性, 进而下调CDK1基因的表达. 这些结果为深入了解甘草甜素的作用及其在肝纤维化中的作用机制提供相应的理论依据.
人肝母细胞瘤细胞系HepG2细胞为本室保存, pCAT3-CDK1-P为本室构建. 报告质粒pCAT3-basic购自Promega公司, 脂质体FuGENE6转染试剂盒、CAT-ELISA检测试剂盒均购自Roche公司. 100 mL/L小牛血清、DMEM购自Sigma公司. 复方甘草甜素由深圳健安医药公司提供.
1.2.1 pCAT3-CDK1-P的构建: 我室刘蔚 et al根据GenBank分析的CDK1基 因组序列, 确定CDK1-P的转录起始位点并设计引物. 以HepG2细胞基因组DNA为模板, 聚合酶链反应扩增CDK1启动子序列, 经过纯化回收DNA片段, 连接、转化及酶切鉴定后, 构建成CDK1启动子的真核报告载体pCAT3-CDK1-P. 磁珠法提取质粒以备转染.
1.2.2 细胞培养及转染: 在35 mm含100 mL/L小牛血清的DMEM培养皿中, 常规培养HepG2细胞. 细胞生长至50-80%融合时, 将pCAT3-CDK1-P采用脂质体转染法转入HepG2细胞, 具体转染方法参照FuGENE6说明书进行. 质粒pCAT3-cdk1-p转染24 h后收集细胞裂解液, 在酶标仪检测415 nm光波标本的吸光度A值.
1.2.3 复方甘草甜素刺激转染: pCAT3-CDK1-P的HepG2细胞 HepG2细胞生长至50-80%融合时, 将pCAT3-CDK1-P转入HepG2细胞, 并将复方甘草甜素加入细胞培养液中, 复方甘草甜素终浓度为1.0 mmol/L, 同时以转染pCAT3-basic的HepG2细胞作阴性对照. 转染24 h后, 收集细胞裂解液, 用于CAT活性检测. 所有实验严格平行操作.
1.2.4 CAT表达量的检测: 实验操作按照CAT ELISA试剂盒说明书进行. 取1.0 mg/L的CAT标准品(试剂盒提供)及细胞裂解液200 mL, 加入已包被抗-CAT抗体的96孔板中, 37 ℃温育2 h. 再依次加入第一抗体(地高辛标记的抗-CAT抗体)、第二抗体(偶联有过氧化物酶的地高辛抗体, 抗-DIG-POD)各200 mL. 分别在37 ℃温育1 h后, 加入过氧化物酶的底物, 室温显色20 min. 用酶标仪检测标本在415 nm检测波长, 490 nm参考波长下的光波的吸光度A值, 其数值反映细胞提取物中的CAT的表达水平. 以未加入细胞裂解液的空白孔作为平行的空白对照.
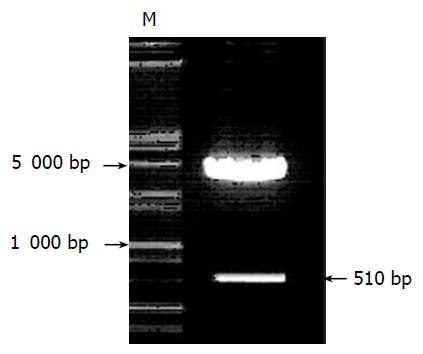
重组质粒pCAT3-CDK1-P分别以KpnⅠ/XholⅠ双酶切及PCR鉴定均显示510 bp正向插入条带. 说明重组质粒pCAT3-CDK1-P构建正确. pCAT3-CDK1-P鉴定电泳图谱如图1所示.
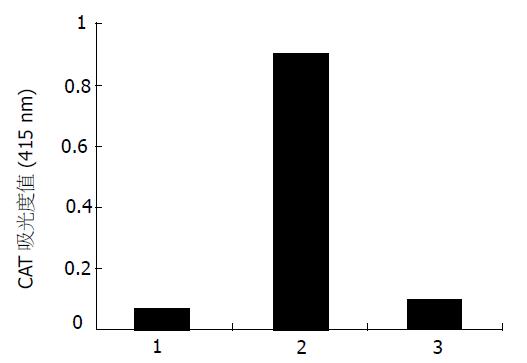
空载体对照组pCAT3 basic的CAT的吸光度值为0.072, pCAT3-CDK1-P的吸光度值为0.892(图2). 此数据表明, 所构建的pCAT3-CDK1-P具有启动子活性.
pCAT3-CDK1-P转染HepG2细胞后加甘草甜素刺激后CAT的吸光值为0.096, pCAT3-CDK1-P+GL的CAT表达水平较对照组质粒显著降低, pCAT3-CDK1-P的CAT吸光值是pCAT3-basic空载体的12.4倍, 是pCAT3-CDK1-P +GL的9.3倍. 如图2所示, 说明GL对pCAT3-CDK1-P启动子的活性具有抑制作用, 使其下游CAT基因的表达明显减弱.
复方甘草甜素具有广泛的药理作用, 在抗炎及治疗溃疡、过敏反应、皮肤病等方面具有肯定的疗效. 研究表明, 复方甘草甜素在治疗慢性乙型、丙型肝炎病毒感染, 预防肝硬化、肝细胞癌方面同样具有明显疗效[2-5]. 近来, 复方甘草甜素在抗肝纤维化的应用中也取得了很好的效果, 它通过多种机制改善肝纤维化. 复方甘草甜素可通过减轻肝细胞变性坏死, 抑制炎症反应, 调节免疫及改善循环等因素而抑制肝内纤维的增生[6]. 它能够降低Ⅰ型、Ⅲ型胶原的合成而减少细胞外基质的产生. 复方甘草甜素对皮质类固醇在肝内代谢失活有竞争性抑制作用, 它能够产生糖皮质激素样作用而降低脯氨酸羟化酶的活性, 使胶原易于分解[7-9]. Ono et al[10]在研究中进一步证实甘草甜素通过抑制肝星状细胞的增殖来降低胶原的产生, 因而改善肝纤维化.
细胞周期分为四个时相: G1期、S期、G2期和M期, 细胞周期的正常运转受到精细、严密的调控, 细胞周期蛋白依赖性激酶(CDK)和细胞周期蛋白(cyclin)是整个调控细胞周期网络中最重要的组成部分. CDK的主要生物学作用是启动DNA的复制和诱发细胞的有丝分裂, 其生物学作用的异常可能导致肿瘤的发生. CDK本身并无激酶活性, 它需和相应的细胞周期蛋白结合而具有蛋白酶活性, 使靶蛋白的丝氨酸和苏氨酸残基磷酸化而起作用[11]. 本实验研究的细胞周期依赖蛋白激酶1又被称为细胞周期分裂基因2(cell division gene 2, cdc2), cdc2是最早发现的细胞周期蛋白依赖性激酶, 被命名为CDK1. 它主要通过抑制视网膜母细胞癌基因产物Rb的活性, 促进细胞周期各时相的转换, Rb蛋白对细胞周期中最关键的调控点G1/S期、G2/M期起着"闸门"的作用, Rb蛋白的磷酸化和非磷酸化最终决定细胞周期的进程[12]. Loyer et al[13]在研究中发现CDK1在静止的大鼠肝细胞不表达, 但在通过细胞周期G1期和G1/S期转换时表达增加, 在S、G2和M期达到最高水平. CDK1是M期的促进因子, 广泛地存在于从酵母到人所有的真核细胞里, 有活性的CDK1触发G2/M期的转换[14]. Krek et al[15]研究证实CDK1的功能是调控G1/S期转换和有丝分裂的起始. CDK1的催化活性主要通过翻译后修饰调整, 包括磷酸化作用和去磷酸化作用, 它与细胞周期蛋白共同作用发挥效应. 许多研究证实cdc2是一种丝氨酸/苏氨酸蛋白激酶, 它是有丝分裂的诱导剂, 被磷酸化作用及结合到细胞周期素B所调整. 它必须与细胞周期素B协同作用才能发挥效能. cdc2调控细胞的有丝分裂, cdc2/cyclin B对有丝分裂的正确起始至关重要. 有丝分裂中G2/M期的转换, 要求cdc2的激活, cdc2被cyclinB1正向调节, 而苏氨酸14和酪氨酸15的磷酸化作用起负向调节, 苏氨酸14和酪氨酸15磷酸化使CDK1的磷酸化位点被抑制, 导致G2/M期阻滞[16-18]. 显然cdc2活性被抑制阻碍细胞进入M期[19]. 细胞的异常增生是肿瘤最基本的表型特性, 诱使细胞持续的增生是肿瘤形成的关键因素[20]. 肝致癌物质WY14 643能使细胞分裂的控制酶CDK1在肝细胞的表达增加, CDK1的增加刺激肝细胞的增生, 很多证据已证实异常的CDK1的表达同肿瘤之间有着相互关系. CDK1在90%的乳腺癌细胞系和所有的胃癌、结肠癌可过度表达[21-24]. Santoni-Rugiu et al[25]证实在肝癌(HCC)中cdc2过度表达, 诱使细胞的有丝分裂增加.
现代研究证实CDK1的调整还包括肿瘤抑制基因p53及和CDK1抑制蛋白p21Waf1的相互作用. 磷酸化的p53通过与靶蛋白及相关调控因子相互作用, 诱导细胞周期阻滞、凋亡或DNA修复. p53诱导的细胞周期阻滞除p21介导的G1期阻滞外, 其余均表现为G2期阻滞[26]. El-Deiry et al[27]认为p53磷酸化还能作为p21Waf1的转录调节蛋白而起作用. 而p21Waf1不仅可以介导p53的功能, 还对细胞的增殖、分化和衰老都起着重要的作用. 它是一个广谱的细胞周期蛋白依赖性激酶的抑制蛋白. p21Waf1能通过对CDK1、CDK2、CDK4和PCNA复杂的调节而抑制增殖[28,29]. Ma et al[30]证实作为对CDK1过分表达的反应, p21Waf1可能扮演双重的角色, 它通过抑制CDKs而阻滞细胞进入S期, 而且可能直接通过抑制PCNA抑制DNA的复制. 他们还认为CDK1在细胞周期活动中是测量DNA合成的一个独立因素. CDK1表达增加能刺激肝细胞增生, 而肝细胞p21Waf1表达增加抑制CDK1, 致使G1/S期阻滞, 细胞周期被抑制. 当前研究充分证实CDK1在细胞生长增殖及肿瘤的发生中扮演一个重要的角色. 总之, CDK1对细胞周期的调控表现为复杂的机制. 我们证实复方甘草甜素抑制CDK1启动子的表达, 从而使CDK1的基因表达下调, 导致细胞周期的阻滞, 使细胞的生长受到抑制. 该实验从分子生物学角度为进一步了解复方甘草甜素在肝纤维化和肝癌治疗中的作用机制提供了理论证据.
电编: 张敏 编辑:张海宁
| 1. | Khaksa G, Zolfaghari ME, Dehpour AR, Samadian T. Anti-inflammatory and anti-nociceptive activity of disodium glycyrrhetinic acid hemiphthalate. Planta Med. 1996;62:326-328. [PubMed] [DOI] |
| 2. | Zhang YH, Isobe K, Nagase F, Lwin T, Kato M, Hamaguchi M, Yokochi T, Nakashima I. Glycyrrhizin as a promoter of the late signal transduction for interleukin-2 production by splenic lymphocytes. Immunology. 1993;79:528-534. [PubMed] |
| 3. | Zhang YH, Kato M, Isobe K, Hamaguchi M, Yokochi T, Nakashima I. Dissociated control by glycyrrhizin of proliferation and IL-2 production of murine thymocytes. Cell Immunol. 1995;162:97-104. [PubMed] [DOI] |
| 4. | Jeong HG, You HJ, Park SJ, Moon AR, Chung YC, Kang SK, Chun HK. Hepatoprotective effects of 18beta-glycyrrhetinic acid on carbon tetrachloride-induced liver injury: inhibition of cytochrome P450 2E1 expression. Pharmacol Res. 2002;46:221-227. [PubMed] [DOI] |
| 5. | Tanahashi T, Mune T, Morita H, Tanahashi H, Isomura Y, Suwa T, Daido H, Gomez-Sanchez CE, Yasuda K. Glycyrrhizic acid suppresses type 2 11 beta-hydroxysteroid dehydrogenase expression in vivo. J Steroid Biochem Mol Biol. 2002;80:441-447. [PubMed] [DOI] |
| 8. | Sekizawa T, Yanagi K, Itoyama Y. Glycyrrhizin increases survival of mice with herpes simplex encephalitis. Acta Virol. 2001;45:51-54. [PubMed] |
| 9. | Kayano K, Sakaida I, Uchida K, Okita K. Inhibitory effects of the herbal medicine Sho-saiko-to (TJ-9) on cell proliferation and procollagen gene expressions in cultured rat hepatic stellate cells. J Hepatol. 1998;29:642-649. [PubMed] [DOI] |
| 10. | Ono M, Miyamura M, Kyotani S, Saibara T, Ohnishi S, Nishioka Y. Effects of Sho-saiko-to extract on liver fibrosis in relation to the changes in hydroxyproline and retinoid levels of the liver in rats. J Pharm Pharmacol. 1999;51:1079-1084. [PubMed] [DOI] |
| 13. | Loyer P, Glaise D, Cariou S, Baffet G, Meijer L, Guguen-Guillouzo C. Expression and activation of cdks (1 and 2) and cyclins in the cell cycle progression during liver regeneration. J Biol Chem. 1994;269:2491-2500. [PubMed] |
| 14. | Draetta G. Cell cycle control in eukaryotes: molecular mechanisms of cdc2 activation. Trends Biochem Sci. 1990;15:378-383. [PubMed] [DOI] |
| 15. | Krek W, Nigg EA. Differential phosphorylation of vertebrate p34cdc2 kinase at the G1/S and G2/M transitions of the cell cycle: identification of major phosphorylation sites. EMBO J. 1991;10:305-316. [PubMed] |
| 16. | Badie C, Itzhaki JE, Sullivan MJ, Carpenter AJ, Porter AC. Repression of CDK1 and other genes with CDE and CHR promoter elements during DNA damage-induced G(2)/M arrest in human cells. Mol Cell Biol. 2000;20:2358-2366. [PubMed] [DOI] |
| 17. | 曹 燕飞, 陈 汉春. Pin1与细胞周期调控及相关人类疾病的关系. 国外医学·生理、病理科学与临床分册. 2003;23:380-382. |
| 18. | Clemens DL, Calisto LE, Sorrell MF, Tuma DJ. Ethanol metabolism results in a G2/M cell-cycle arrest in recombinant Hep G2 cells. Hepatology. 2003;38:385-393. [PubMed] [DOI] |
| 19. | Nakayama K, Nagahama H, Minamishima YA, Miyake S, Ishida N, Hatakeyama S, Kitagawa M, Iemura S, Natsume T, Nakayama KI. Skp2-mediated degradation of p27 regulates progression into mitosis. Dev Cell. 2004;6:661-672. [PubMed] [DOI] |
| 20. | Farber E. Hepatocyte proliferation in stepwise development of experimental liver cell cancer. Dig Dis Sci. 1991;36:973-978. [PubMed] [DOI] |
| 21. | Steinmann KE, Pei XF, Stöppler H, Schlegel R, Schlegel R. Elevated expression and activity of mitotic regulatory proteins in human papillomavirus-immortalized keratinocytes. Oncogene. 1994;9:387-394. [PubMed] |
| 22. | Yasui W, Ayhan A, Kitadai Y, Nishimura K, Yokozaki H, Ito H, Tahara E. Increased expression of p34cdc2 and its kinase activity in human gastric and colonic carcinomas. Int J Cancer. 1993;53:36-41. [PubMed] [DOI] |
| 23. | Keyomarsi K, Pardee AB. Redundant cyclin overexpression and gene amplification in breast cancer cells. Proc Natl Acad Sci USA. 1993;90:1112-1116. [PubMed] [DOI] |
| 24. | Kamb A. Cell-cycle regulators and cancer. Trends Genet. 1995;11:136-140. [PubMed] [DOI] |
| 25. | Santoni-Rugiu E, Jensen MR, Thorgeirsson SS. Disruption of the pRb/E2F pathway and inhibition of apoptosis are major oncogenic events in liver constitutively expressing c-myc and transforming growth factor alpha. Cancer Res. 1998;58:123-134. [PubMed] |
| 26. | Ling YH, Zou Y, Perez-Soler R. Induction of senescence-like phenotype and loss of paclitaxel sensitivity after wild-type p53 gene transfection of p53-null human non-small cell lung cancer H358 cells. Anticancer Res. 2000;20:693-702. [PubMed] |
| 27. | el-Deiry WS, Harper JW, O'Connor PM, Velculescu VE, Canman CE, Jackman J, Pietenpol JA, Burrell M, Hill DE, Wang Y. WAF1/CIP1 is induced in p53-mediated G1 arrest and apoptosis. Cancer Res. 1994;54:1169-1174. [PubMed] |
| 28. | Xiong Y, Hannon GJ, Zhang H, Casso D, Kobayashi R, Beach D. p21 is a universal inhibitor of cyclin kinases. Nature. 1993;366:701-704. [PubMed] [DOI] |
| 29. | Waga S, Hannon GJ, Beach D, Stillman B. The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA. Nature. 1994;369:574-578. [PubMed] [DOI] |
| 30. | Ma X, Stoffregen DA, Wheelock GD, Rininger JA, Babish JG. Discordant hepatic expression of the cell division control enzyme p34cdc2 kinase, proliferating cell nuclear antigen, p53 tumor suppressor protein, and p21Waf1 cyclin-dependent kinase inhibitory protein after WY14,643 ([4-chloro-6-(2,3-xylidino)-2-pyrimidinylthio] acetic acid) dosing to rats. Mol Pharmacol. 1997;51:69-78. [PubMed] |