修回日期: 2005-01-05
接受日期: 2005-01-08
在线出版日期: 2005-09-28
目的: 研究益气活血软坚解毒(YHRJ)含药血清对人肝癌细胞系Bel-7402生长抑制及诱导凋亡作用.
方法: 将YHRJ含药血清作用于人肝癌细胞系Bel-7402细胞, 应用MTT检测对肝癌细胞生长抑制作用, 倒置显微镜、荧光显微镜、激光共聚焦扫描显微镜等影像学方法观察细胞形态学变化, 以及PI染色单染、AnnexinV-PI双染后, 流式细胞术检测对细胞周期影响及诱导细胞凋亡程度.
结果: MTT法检测结果显示: YHRJ含药血清具有抑制Bel-7402肿瘤细胞生长作用(其中20%YHRJ等效剂量抑制率49.1%,与NS比, P<0.01); 荧光显微镜及激光共聚焦显微镜可观察到典型的凋亡形态学变化. 流式细胞术检测结果, 细胞周期出现G0/G1期阻滞, 并出现典型的凋亡峰, AnnexinV- PI双染法检测到早期及中晚期细胞凋亡.
结论: YHRJ含药血清有抑制人肝癌细胞系Bel-7402细胞生长并有诱导细胞凋亡作用.
引文著录: 李东涛, 孙桂芝, 裴迎霞, 祁鑫, 李杰, 林洪生. 益气活血软坚解毒含药血清诱导人肝癌细胞系 Bel-7402 细胞的凋亡. 世界华人消化杂志 2005; 13(18): 2217-2221
Revised: January 5, 2005
Accepted: January 8, 2005
Published online: September 28, 2005
AIM: To investigate the growth inhibitory and apoptosis inducing effects on hepatocellular carcinoma Bel-7402 cell line by serum from rabbit fed with Yiqi Huoxue Ruanjian Jiedu decoction(YHRJ decoction).
METHODS: Serum was collected from New Zealand rabbits fed with YHRJ decoction, and used for Bel-7402 cell culture. Cell growth inhibition was assayed by MTT method. Invert, fluorescence, and laser microscopes were applied to examine cell morphology. Cell cycle and apoptosis were detected by annexinV and propidium iodide (PI) double staining and flow cytometry.
RESULTS: Serum from YHRJ-fed rabbits suppressed Bel-7402 cell growth. The inhibitory rate was 49.1%, when 20% serum was added to the culture. Typical apoptosis of morphological changes were also observed in YHRJ serum treated cells. The G0/G1 arrest and apoptosis peak were shown by flow cytomety.Early, medium/late-term apoptosis was detected by annexinV-PI double staining.
CONCLUSION: YHRJ decoction containing serum can inhibit growth and induce apoptosis of Bel-7402 cells.
- Citation: Li DT, Sun GZ, Pei YX, Qi X, Li J, Ling HS. Growth inhibitory and apoptosis inducing effect on hepatocellular carcinoma Bel-7402 cell line by serum from rabbit fed with Yiqi Huoxue Ruanjian Jiedu decoction. Shijie Huaren Xiaohua Zazhi 2005; 13(18): 2217-2221
- URL: https://www.wjgnet.com/1009-3079/full/v13/i18/2217.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i18.2217
益气活血软坚解毒法是导师孙桂芝教授在临床上治疗原发性肝癌的重要治则治法, 以往相关的研究结果表明, 该法具有抑制荷H22瘤小鼠肿瘤生长及促进人肝癌细胞系Bel-7402细胞凋亡作用[1,2]. 为了深入研究其作用机制, 我们拟从体外培养细胞的血清药理学实验方面, 从细胞分子水平研究其作用特点.
新西兰大白兔12只, ♀, 体重2.45-2.7 kg, 购于中国药品及生物制品检定所, 对数生长期的Bel-7402细胞, 由中国中医研究院广安门医院提供. 益气活血软坚解毒(YHRJ)方水煎剂: 组方为生黄芪、炒白术、田三七、水红花子、藤梨根、凌霄花、炮山甲、白花舌蛇草、半枝莲, 常规水提取, 生药浓度3.4 kg/L, 4 ℃保存备用. YHRJ含药血清的制备. 健康新西兰大耳白兔12只, 随机分为NS、YHRJ等效剂量(约为人用量的5倍)、YHRJ高剂(约为人用量的10倍)3组, 每组4只, 8:00、14:00点各给药1次, 中药每只每次稀释成10 mL灌喂, 重复给药5次, 末次给药前12 h禁食不禁水, 末次给药后1-1.5 h之内分别从耳中央动脉无菌采血10 mL, 室温静置2 h, 冷冻离心机1500 r/min离心10 min, 吸取血清, 56 ℃30 min灭活, 22 μm针式微孔滤膜过滤, -20 ℃冰箱保存备用. 顺氯氨铂(DDP): 山东齐鲁制药厂产品. RPMI1640完全培养液: RPMI培养干粉(GIBCO)内含2 mmol/L谷氨酰胺, 青霉素100 kU/L、链霉素100 mg/L, 应用时加入100 mL/L灭活的小牛血清. 四甲基偶氮唑盐(MTT)、碘化丙啶(PI)、RNAA酶、吖啶橙(AO): 美国Sigma公司产品. AnnexinV-FITC试剂盒: 北京宝赛生物技术有限公司生产. 全自动酶标仪(Microplate AUTO Reader)EL311: 美国BioTek公司产品. BH2-RFC落射式荧光显微镜: Olympus公司产品. 激光共聚焦扫描显微镜(Radiance2000): 美国BioRad公司产品. FACSort流式细胞仪(FCM): 美国Becton-Dicknson公司生产.
1.2.1 YHRJ含药血清对人肝癌细胞系Bel-7402生长抑制作用(MTT法)的表达: 处于对数生长期的人肝癌细胞Bel-7402经2.5 g/L胰酶消化后, 接种于96孔板中, 每孔100 μL(1×108/L), 孵育24 h, 分组为NSD、NSG、YHRJDD、YHRJDG、YHRJGD、YHRJGG、DDP 7组, 分别加入生理盐水兔血清至终浓度为100 mL/L、200 mL/L、RHRJ等效剂量兔血清至终浓度为100 mL/L、200 mL/L、RHRJ高剂量兔血清至终浓度为100 mL/L、200 mL/L、DDP 2 mg/L, 另设对照组单纯加入培养液100 μL、设培养液空白孔, 每组复孔为6个, 置于37 ℃, 50 mL/L湿化的C02培养箱中孵育72 h后, 沿培养孔边缘轻轻吸出上清100 μL, 加入MTT储液10 μL l(5 g/L), 继续培养4 h, 加入二甲基亚砜(DMSO)100 μL, 震荡器轻微震荡后, 用EL311型全自动酶标仪测其A值, 测定波长570 nm, 参考波长630 nm, 计算对细胞的抑制率(%)={(对照组平均A值-空白组平均A值)-(药物平均A值-空白组平均A值)}÷(对照组的平均A值-空白组平均A值)×100%.
1.2.2 影像学观察方法[3,4]: 处于对数生长期的人肝癌细胞Bel-7402细胞, 经2.5 g/L胰酶消化后, 分瓶, 传代细胞处于对数生长期时分组为NSD、NSD+DDP、YHRJDD、YHRJDD+DDP、YHRJGD、YHRJGD+DDP6组, 加血清如1.2.1, 加DDP各组DDP终浓度为4.5 mg/L, 50 mL/L湿化的C02培养箱中孵育. PBS液离心洗涤1次, 取少量细胞涂片, 速入950 mL/L冷乙醇固定10-15 min, 稍干; 10 g/L醋酸酸化30 S, 0.1 g/L AO染色8 min; PBS液(pH4.8)洗涤1 min后, 0.01 mol/L CaCl2分化2 min, 再入3个含PBS液(pH4.8)的染色缸洗3次, 每次数秒; PBS液临时封固, 置荧光显微镜观察, 蓝光激发, 照相. 另染色方法同AO染色, 置激光共聚焦扫描显微镜观察[5], 蓝光激发(B, 488 nm), 阻挡滤片530/30 Bp, 630/30 Bp, 发射波长515 nm(DNA, 绿光)、630 nm(RNA, 红光); 采用该仪器的双染色样品扫描分析软件分析, 照相.
1.2.3 YHRJ含药血清对人肝癌细胞系Bel-7402细胞周期影响及凋亡诱导[6]: 传代细胞处于对数生长期时分组为NSD、NSG、YHRJDD、YHRJDG、YHRJGD、YHRJGG6组, 加血清如1.2.1, 分别于孵育12, 24, 48, 72 h时处理细胞, 0.1 mol/L PBS液离心洗涤(1 000 r/min, 5 min)2次后, 加入700 mL/L冷乙醇4 mL, 40 ℃固定24 h. 检测前弃去乙醇, PBS液离心洗涤2次, 加入RNA A酶(20 mg/L)及PI(50 mg/L)混合染液1 mL, 4 ℃避光染色30 min. 350目尼龙筛网过滤, 调整瘤细胞浓度1×108/L, FACSort流式细胞仪检测, 计算出DNA含量, 得出细胞周期(G0/G1,S,G2+M)的百分比和凋亡细胞的比例. 处理细胞同1.2.2, 于孵育24h时处理细胞. 将培养液倒入5 mL离心管, 加入2.5 g/L的胰酶消化, 加入原培养液, 混合后, 1 000 r/min 4 ℃离心10 min, 弃上清. 加入冷PBS 1 mL, 轻轻震荡使细胞悬浮. 1 000 r/min 4 ℃离心10 min, 弃上清, 重复上述步骤两次. 将细胞重悬于200 μL Binding Buffer. 加入AnnexinV-FITC 10 μL和PI5 μL, 轻轻混匀, 避光室温反应15 min或4 ℃反应30 min. 加入Binding Buffer 300 μL, 立即流式细胞仪分析.
YHRJ含药血清均有不同程度抑制肿瘤生长作用, 以20%YHRJ等效剂量组含药血清作用显著, 与NS组比较, 差异显著(P<0.01), 但与化疗药物DDP相比, 还有一定差距(表1).
| 分组 | 药物剂量 | A值 | 抑制率(%) |
| 空白对照 | 100 mL/L胎牛血清 | 0.0955 ± 0.0072 | |
| 对照 | 100 mL/L 胎牛血清 | 0.4548 ± 0.123 | |
| NSD | 100 mL/L NS兔血清 | 0.3803 ± 0.0848 | 20.73 |
| NSG | 100 mL/L NS兔血清 | 0.3795 ± 0.1276 | 16.56 |
| YHRJDD | 100 mL/L YHRJ等效剂量兔血清 | 0.3510 ± 0.1322 | 22.82 |
| YHRJDG | 200 mL/L YHRJ等效剂量兔血清 | 0.2317 ± 0.0592 | 49.06b |
| YHRJGD | 100 mL/L YHRJ高剂量兔血清 | 0.2028 ± 0.0189 | 19.86 |
| YHRJGG | 200 mL/L YHRJ剂量兔血清 | 0.2270 ± 0.0509 | 28.51 |
| DDP | 100 mL/L胎牛血清+DDP | 0.1402 ± 0.0084 | 69.18b |
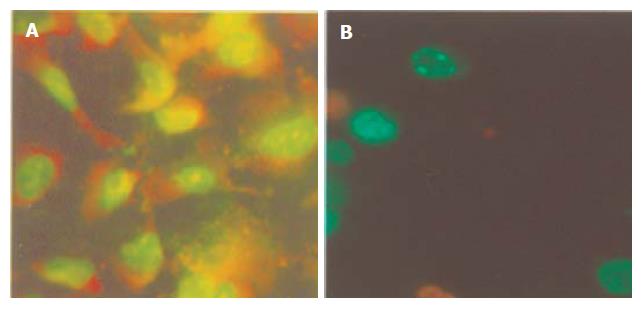
荧光显微镜下AO染色除NS组外, 各用药组均可发现明显的凋亡细胞, 核染色质浓缩, 早期染色质聚集于核周边部而呈新月形, 晚期细胞核浓缩, 并碎裂成大小不等的片段, 晚期凋亡细胞进一步碎裂形成由质膜包绕的含有多少不等的核碎片的凋亡小体, 细胞的细胞核染色质形成明亮的凝聚块, 以各加DDP组最为明显(图1). 激光共聚焦扫描显微镜下细胞的形态变化NS组细胞大小相对均匀, 为圆形, 无缺损或破坏, DNA荧光强度分布地形图显示细胞分布茂密, 整个结构形态充满, 自核边缘至核中央荧光强度逐次递强, 完整无损. 各加药组细胞形态不规则, 荧光强度分布不均, 大面积出现荧光强度减低, 各组均能发现细胞凋亡表现, 以各加DDP组最为明显, 单纯中药组以YHRJGD最为明显(图2).
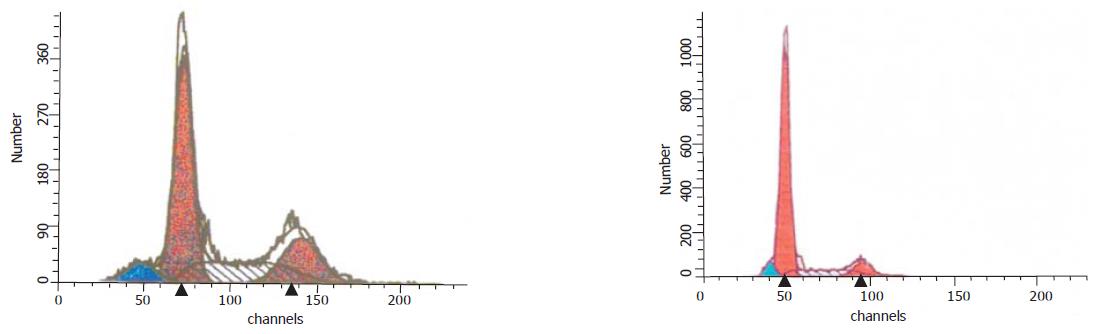
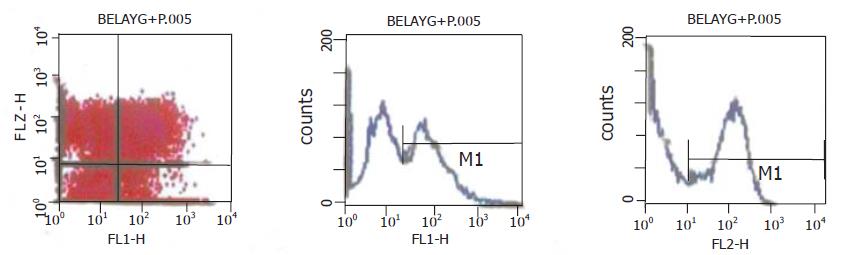
在12 h点上, 与NS组相比, 各加药组出现G0/G1期阻滞, 以YHRJDD最为明显, 未出现细胞凋亡现象. 在24 h点上, 各中药组均出现不同程度的细胞凋亡现象, 以YHRJGD最为明显, 为16.18%, 并出现明显G0/G1期阻滞. 在48 h点上, 各加药组仍有一定数量凋亡细胞, 以YHRJGG最高, 为15.54%, 但总体趋势减低. 在72 h点上, 凋亡细胞数量明显减少, 但仍有G0/G1阻滞现象, 由于此时出现细胞饥饿现象, NSD开始出现部份细胞凋亡(表2, 图3).YHRJDD及YHRJGD组24 h点早期凋亡率并不高, 但中晚期凋亡数量较高, 因此凋亡总数比NS组高, 有显著差异(P<0.001). 另外, 中药加DDP比单纯用DDP凋亡总数明显增高, 差异显著(P<0.001), 显示中药与DDP的协同作用(表3, 图4).
| 分组 | G0/G1 | S | G2-M | APO | |
| 12 h | NSD | 40.0 | 48.8 | 11.2 | 0 |
| NSG | 40.1 | 48.0 | 11.9 | 0 | |
| YHRJDD | 61.4 | 21.4 | 17.2 | 0 | |
| YHRJDG | 52.6 | 30.6 | 16.8 | 0 | |
| YHRJGD | 59.5 | 18.1 | 22.4 | 0 | |
| YHRJGG | 44.8 | 41.7 | 13.5 | 0 | |
| 24 h | NSD | 74.0 | 8.2 | 17.8 | 0 |
| NSG | 59.3 | 17.7 | 23.0 | 0 | |
| YHRJDD | 53.9 | 24.8 | 21.3 | 7.1 | |
| YHRJDG | 63.0 | 9.2 | 17.8 | 4.2 | |
| YHRJGD | 75.6 | 14.2 | 10.2 | 16.2 | |
| YHRJGG | 67.3 | 21.0 | 11.8 | 1.7 | |
| 48 h | NSD | 73.5 | 10.9 | 15.6 | 0 |
| NSG | 59.1 | 18.9 | 22.0 | 0 | |
| YHRJDD | 62.1 | 19.7 | 18.2 | 2.9 | |
| YHRJDG | 43.4 | 35.8 | 21.1 | 5.4 | |
| YHRJGD | 76.6 | 14.5 | 8.9 | 5.1 | |
| YHRJGG | 76.0 | 13.5 | 10.5 | 15.5 | |
| 72 h | NSD | 67.4 | 10.0 | 22.7 | 2.3 |
| NSG | 50.4 | 7.4 | 32.2 | 0 | |
| YHRJDD | 72.7 | 3.8 | 23.5 | 0 | |
| YHRJDG | 70.5 | 6.7 | 22.8 | 1.1 | |
| YHRJGD | 79.9 | 2.7 | 17.4 | 0 | |
| YHRJGG | 75.6 | 17.8 | 6.6 | 1.3 |
| 分组 | 正常 | 早期凋亡 | 中晚期凋亡 | 死亡 | 凋亡总 | |
| 24 h | NSD | 94.0 | 1.38 | 3.7 | 0.9 | 5.2 |
| NSD+DDP | 39.1 | 8.1 | 39.1 | 13.3 | 47.5b | |
| YHRJDD | 89.8 | 1.2 | 5.4 | 3.6 | 6.6b | |
| YHRJDD+DDP | 31.6 | 35.4 | 23.8 | 9.9 | 59.2b | |
| YHRJGD | 89.2 | 1.1 | 6.6 | 2.8 | 8.0b | |
| YHRJGD+DDP | 10.8 | 13.7 | 47.4 | 28.0 | 61.1b |
细胞凋亡是中药作用机制研究的热门课题, 也是中药抗癌的主要作用机理[7,8]. 李杰 et al[2]研究发现, 以益气活血软坚解毒为组方的肝康冲剂可阻止肝癌细胞系Bel-7402细胞G0/Gl期进入S期, 24 h即有细胞分裂出凋亡小体. 陈瑜 et al补肾及健脾复方对皮质酮大鼠T细胞凋亡信号相关基因群具有调控作用[9]. 孟志强 et al[10]研究发现, 健脾理气药对肝癌细胞株SMMC-7721具一定的诱导凋亡及抑制肝癌细胞效应, 能上调P53, P2lWAF1/CIP1基因的表达, 且对肿瘤细胞端粒酶活性有抑制作用. 杨雁et al[11]研究发现黄芪总甙具有诱导肝癌细胞株HepG2细胞和Bel-7402细胞凋亡的作用, 能上调肝癌细胞的wtp53表达. 王三龙et al[12]研究发现中药苏木提取物诱导K562细胞凋亡的研究. 我们的结果显示, 益气活血软坚解毒法有抑制人肝癌系Bel-7402细胞生长作用, 影像学提示有诱导细胞凋亡作用, 说明诱导细胞凋亡是中药抑制肿瘤的主要作用机理.
引起细胞凋亡典型形态学变化的机制在于Ca2+, Mg2+依赖性核酸内切酶的激活导致染色质DNA在核小体连接部位断裂, 形成以180-200 bp为最小单位的单体或寡聚体片段. 流式细胞仪PI染色法可以检测DNA降解, 在正常的G0/G1峰之前出现的一亚二倍体峰为凋亡峰. 我们的研究结果显示, 在药物作用24 h后, 能出现明显的凋亡峰. 近年来, 通过对细胞凋亡的进一步研究发现: 各种细胞受到诱导后产生凋亡的初期, 均会出现膜内外层面磷酯酰丝氨酸(PS)重新分布, 即膜内表面的PS发生不可逆转的外露, 其明显早于核内DNA固缩、变性、裂解[13], 检测外表面的PS, 可了解凋亡的早期状况. AnnexinV与PS有较强的亲和力, 具有钙依赖性. 由于坏死细胞的PS也有外露现象[14], 因此, AnnexinV和能够进入破损细胞膜内与降解DNA结合的PI法联合应用才可以区分凋亡和坏死[15,16]. 我们采用AnnexinV/PI法双染色法观察了用药24 h后早、中、晚期凋亡细胞分布, 结果显示, YHRJ中药组中、晚凋亡细胞较多, 说明早期凋亡发生于24 h之前. 以上说明, 诱导肝癌细胞凋亡是益气活血软坚解毒法抑制肿瘤生长的重要作用机制.
电编: 李琪 编辑:潘伯荣 审读:张海宁
| 1. | 李 杰, 孙 桂芝, 朴 炳奎, 陈 长怀, 刘 玉琴, 顾 蓓, 薛 克勋, 高 进, 苑 景春, 李 江. 肝康冲剂抑瘤作用观察及机理探讨. 中国实 验方剂杂志. 1998;5:32-35. |
| 2. | 李 杰, 孙 桂芝, 朴 炳奎, 刘 玉琴, 顾 蓓, 薛 克勋, 高 进. 中药肝康冲剂提取诱导人肝癌细胞系BEL-7402细胞凋亡的实验研究. 中国 肿瘤生物治疗杂志. 1997;4:234. |
| 6. | Benderitter M, Vincent-Genod L, Berroud A, Voisin P. Simultaneous analysis of radio-induced membrane alteration and cell viability by flow cytometry. Cytometry. 2000;39:151-157. [PubMed] [DOI] |
| 13. | Zwaal RF, Schroit AJ. Pathophysiologic implications of membrane phospholipid asymmetry in blood cells. Blood. 1997;89:1121-1132. [PubMed] |
| 14. | Peng L, Liu JJ. A novel method for quantitative analysis of apoptosis. Lab Invest. 1997;77:547-555. [PubMed] |