修回日期: 2005-07-05
接受日期: 2005-07-09
在线出版日期: 2005-09-15
目的: 探讨经兔肝动脉灌注平阳霉素碘油乳剂(PLE)制作肝纤维化模型的可行性.
方法: 4-5月龄日本大耳白兔24只, 按经肝动脉注入PLE量的不同分成假手术组, 实验A组、实验B组, 分别于术后1、2、4、6、10、14 wk定期开腹取材, 做HE染色及血小板衍化生长因子B(PDGF-B)免疫组化染色.
结果: 6 wk时A组及B组兔肝脏均可见明显纤维化改变, 部分肝组织假小叶形成. B组兔10 wk时4只兔中有一只出现一直径约1.0 cm大小的硬化结节, 光镜下为团状增生的纤维组织. PDGF-B免疫组化染色可见肝细胞胞膜及纤维间隔中大量阳性染色. A、B组积分光密度值在注射后1、2、4、6 wk比假手术组明显升高(118714±14941, 154344±25102 vs 42745±871, P<0.01; 130399±11690, 164855±15486 vs 44052±1043, P<0.01; 116594±21230, 147099±20317 vs 41081±769, P<0.01; 101732±8794, 124177±20429 vs 46366±975, P<0.01).
结论: 经肝动脉灌注PLE制作肝纤维化模型成功率高, 死亡率低. PDGF-B作为肝纤维化的启动因子参与了该模型的纤维化过程.
引文著录: 李枫, 徐克, 刘瑞宝. 经兔肝动脉灌注平阳霉素碘油乳剂制作肝纤维化模型. 世界华人消化杂志 2005; 13(17): 2090-2093
Revised: July 5, 2005
Accepted: July 9, 2005
Published online: September 15, 2005
AIM: To investigate the feasibility of setting up a hepatic fibrosis model by intra-arterial injection of emulsions of iodized oil and pingyangmycin.
METHODS: Twenty-four Japanese big-ear rabbits were divided into sham-operation, experiment A and B group according to the doses of emulsions of iodized oil and pingyangmycin (1.2 and 2.0 mg for A and B, respectively) injected into the hepatic artery. The live specimens were obtained 1, 2, 4, 6, 10, and 14 wk after injection. The histological changes were determined by HE staining, and the contents of platelet derived growth factor-B (PDGF-B) were detected by immunohistochemical staining.
RESULTS: Six weeks after injection, typical features of fibrosis appeared in all the liver tissues of group A and B, and the pseudolobules formed in some tissues. In group B, sclerosis with a diameter of 1.0 cm was found in one of the four rabbits at 10th week under light microscope. The contents of PDGF-B were significantly increased in A and B group as compared with those in sham-operation group 1, 2, 4, and 6 wk after injection (integral optical density: 118714±14941, 154344±25102 vs 42745±871, P <0.01; 130399±11690, 164855±15486 vs 44052±1043, P <0.01; 116594±21230, 147099±20317 vs 41081±769, P <0.01; 101732±8794, 124177±20429 vs 46366±975, P <0.01).
CONCLUSION: The model of hepatic fibrosis can be established successfully by injection of iodized oil and pingyangmycin emulsions into the hepatic artery. PDGF-B plays an important role in the progress of fibrosis as a promoter.
- Citation: Li F, Xu K, Liu RB. A new model of hepatic fibrosis induced by intra-arterial injection of iodized oil and pingyangmycin emulsions. Shijie Huaren Xiaohua Zazhi 2005; 13(17): 2090-2093
- URL: https://www.wjgnet.com/1009-3079/full/v13/i17/2090.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i17.2090
平阳霉素(bleomycin A5)作为一种国产抗肿瘤抗生素, 其临床应用的主要副作用为肺炎样变或肺纤维化[1-4].1985年, Matalon et al[5]用bleomycin对鼠支气管行一次性灌注, 造成鼠肺纤维化.1992年金洪 et al[6]通过向大鼠气管内滴注平阳霉素导致大鼠肺纤维化, 此后气管内滴注平阳霉素制作肺纤维化模型被广泛采用.我们利用平阳霉素的这种特性探索出一种制作肝纤维化模型的新方法.
4-5月龄日本大耳白兔24只, 雌雄不限, 体质量2.5±0.2 kg, 由中国医科大学实验动物中心提供.所有实验兔随机分成3组, 其中假手术组4只, 实验A组10只, 实验B组10只.
所有实验兔均于术前24 h禁食, 4 h禁水. 速眠新注射液(长春农牧大学军事兽医研究所)0.8 mL im 麻醉, 腹中线切口8 cm长, 进腹腔后, 剪断小网膜(在兔身上实际为少量透明系膜组织), 于胃幽门上方找到肝门, 可见明显的肝动脉搏动, 走行朝向肝内, 中途可见其发出胃十二指肠动脉, 向幽门部走行, 用5号半头皮针穿刺肝动脉成功后针头越过胃十二指肠动脉注药.其中假手术组4只兔注入0.4 mL生理盐水; A组10只兔注入0.2 mL碘油+1.2 mg平阳霉素+0.2 mL生理盐水制成的混悬乳剂; B组10只兔注入0.2 mL碘油+2.0 mg平阳霉素+0.2 mL生理盐水制成的混悬乳剂.注药后拔出针头用明胶海绵按压1 min, 确定无出血后关腹缝合.术中严格采用无菌操作, 以防感染.取材: 假手术组4只兔, A组及B组中各自随机抽取5只兔(编号为A1, B1)分别于术后1, 2, 4, 6 wk行全麻, 剑突下偏左或偏右切一2 cm长小口, 分离肌肉组织, 暴露肝脏, 观察肝脏大体改变, 并于肝脏表面用手术刀切取一块约3 mm×3 mm大小的肝组织块, 再用18 G肝穿刺针于肝脏深处取两块组织, 明胶海绵按压止血后缝合.取出的肝组织清水冲洗后立即用福尔马林液固定, 至第6 wk取材后上述14只兔全部处死, A组及B组余下的5只兔(编号为A2, B2)再分别于术后10, 14 wk取材.取材标本采用常规石蜡包埋, 5 μm连续切片, HE染色, 光镜下观察肝脏组织学改变.血小板衍化生长因子B链(PDGF-B)免疫组织化学染色采用ABC法略加改良(试剂盒购于武汉博士德公司).常规石蜡脱水; 2 g/L TWEEN-20PBS漂洗; 4 g/L胃蛋白酶抗原修复; 加入PDGF-B一抗抗体; 滴加二抗抗体; 后加ABC复合物; DAB显色(棕黄色); 封片.使用 MetaMorph/DP10/BX5 彩色显微图象分析仪做组织化学定量分析.随机选取每张切片5个视野, 测定其阳性染色(棕黄色)的积分光密度值(IOD), IOD值越高表明组织抗原含量越高.取5个视野的平均值作为该切片的IOD值.
统计学处理 采用SPSS 10.0统计软件对上述数据做统计分析.
除B1组兔2 wk时取材后死亡一只外(死亡原因考虑为麻醉过量及术后保暖欠佳), 余实验兔均按照实验方法的操作步骤进行.
A组: 1 wk, A1组5只兔中有3只兔肝脏外缘被膜颜色变白, 全部5只兔肝缘欠锐利; 2 wk, A1组全部5只兔肝脏部分区域表面覆盖白色被膜, 肝缘变钝; 4 wk, 大体观与2 wk时相仿; 6 wk, A1组5只兔肝脏部分区域外被白色被膜, 肝脏边缘进一步变钝, 肝表面凸凹不平; 10 wk、14 wk时(A2组5只兔)大体观与6 wk相仿.B组: 1 wk, B1组全部5只兔肝脏表面外被白色被膜, 肝缘欠锐利; 2 wk肝缘进一步变钝; 4 wk时大体观与2 wk相仿(B1组兔第2次取材后死亡1只由B2组中补充1只); 6 wk时肝脏边缘进一步变钝, 肝表面凸凹不平; 10 wk时B2组全部4只兔中有1只肝脏表面可见一直径约1 cm的硬化结节, 质硬, 切割质地如胶皮感; 14 wk时大体观与10 wk相仿.假手术组兔肝缘锐利, 表面光滑, 色泽鲜亮.
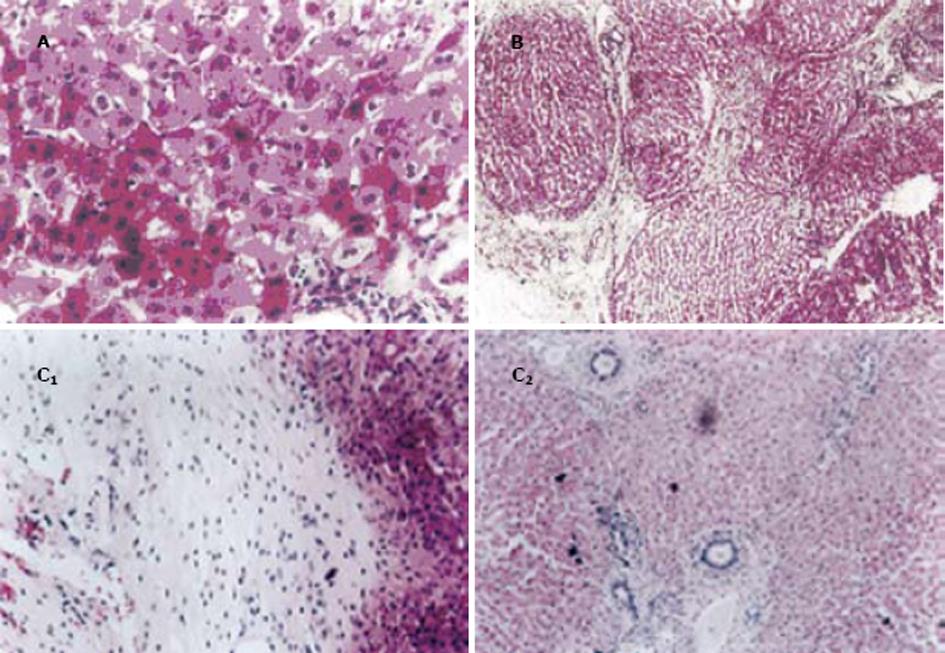
A组: 1 wk HE染色可见肝细胞轻度水样变性, 肿胀, 肝索拥挤, 肝窦充血, 门管区淋巴细胞浸润; 2 wk HE染色肝细胞明显水样变性, 胞质空亮, 部分肝细胞可见嗜酸性改变, 肝窦充血, 汇管区大量淋巴细胞浸润(图1A); 4 wk时HE染色可见肝细胞中度水样变性, 汇管区可见纤维组织增生及部分淋巴细胞浸润, 小叶间隔增厚, 肝窦充血; 6 wk时HE染色可见肝细胞轻度水样变性, 汇管区纤维组织增生, 向小叶内延伸扩展, 形成分割包绕趋势, 部分肝组织可见增生的纤维结缔组织重新分割包绕形成假小叶(图1B); 10, 14 wk时光镜下改变与6 wk相仿.B组: 1 wk HE染色可见肝细胞水样变性, 肿胀, 肝索拥挤, 肝窦充血, 门管区大量淋巴细胞浸润; 2 wk HE染色肝细胞明显水样变性, 胞质空亮, 部分肝细胞可见嗜酸性改变, 肝窦充血, 汇管区大量淋巴细胞浸润; 4 wk HE染色肝细胞仍有明显水样变, 汇管区大量淋巴细胞浸润, 纤维组织增生明显, 小叶间隔增厚, 肝窦充血; 6 wk HE染色肝细胞水样变性较前减轻, 汇管区纤维组织大量增生, 向小叶内延伸扩展, 形成分割包绕趋势, 部分肝组织可见增生的纤维结缔组织重新分割包绕形成假小叶.10 wk光镜下肝组织呈广泛纤维化改变, 部分区域的肝组织可见大片团状增生的纤维结缔组织, 无明显肝细胞结构(图1C1C2); 14 wk时光镜下改变与10 wk相仿.假手术组兔肝细胞形态正常, 肝索排列整齐, 小叶结构清晰.
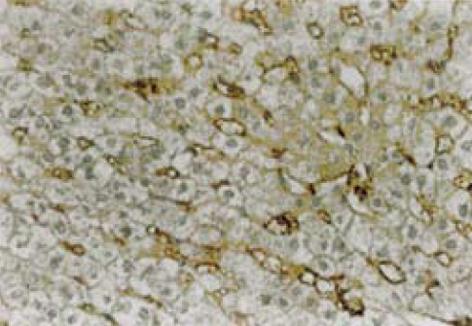
平阳霉素属于博莱霉素(bleomycin)族A5成分, 它对血管内皮细胞存在非特异性抑制和破坏作用, 这种作用被称之为"祛血管作用"[7].我们利用平阳霉素的这种"祛血管作用", 将平阳霉素与碘油的混悬乳剂经兔肝动脉注入制成了兔肝纤维化模型, 并使用免疫组化染色法标记PDGF-B, 通过图象分析观察其动态变化来进一步探讨该纤维化形成的机制.PDGF-B是参与肝纤维化过程的最重要的细胞因子之一, 是促使肝脏纤维化形成的启动因子, 它的主要作用是促使肝星状细胞增殖, 促使肝星状细胞移行并诱导HSC合成TGF, IGF等细胞因子, 引发肝脏纤维化[8-15].我们通过PDGF-B的免疫组织化学染色, 证实PLE介导的肝纤维化也是由PDGF-B启动并参与的.通过A组5只兔取材标本的免疫组织化学定量分析, 我们看出PDGF-B最高表达出现在2 wk, 至6 wk时已有明显下降, 抗原表达主要集中在肝细胞膜和纤维间隔中.综合分析光镜下HE染色结果和免疫组织化学定量分析结果可以得出如下结论: PLE可导致肝细胞损伤, 2 wk时肝细胞变性最重, 随时间推移细胞变性在减轻, PDGF-B的最高表达也集中在2 wk, 随时间推移PDGF-B的表达也在逐渐减少, 肝纤维化则出现在4 wk并逐渐发展成肝硬化.
任何可引起肝损伤的因素长期作用于肝脏均可产生肝细胞变性, 坏死, 继而肝细胞再生和纤维组织增生, 导致肝纤维
化[16-23].我们制成的肝纤维化模型属于化学损伤性模型.其特点为纤维化首先发生在门管区, 随病程进展逐渐向小叶内延伸.肝内纤维化的发生呈不均衡性, 病变程度肝内各部分轻重不等, 6 wk时即可产生明显的纤维化改变, 部分肝组织假小叶形成, 至10 wk时可出现肝硬化结节.
PLE进入肝脏后, 由于碘油在正常肝组织中能停留近20 d[24], 使得平阳霉素得以缓慢释放, 造成慢性肝损伤, 符合肝纤维化产生的条件.因此这种造模方法只需一次给药, 而不会导致大剂量注入毒性药物后产生肝坏死, 肝功能衰竭致动物死亡.此外由于本实验是直接肝动脉给药, 药物直接作用于肝脏, 避免了全身给药后产生的其他脏器的毒副作用, 因此死亡率低.本组实验除1只兔由于麻醉意外死亡余兔均成活.实验A组及B组共19只兔均不同程度出现肝纤维化, 模型出现率从本组实验统计可达100%.综上所述, PLE灌注法肝纤维化模型只需一次给药, 制作方法简便, 模型出现率高, 动物死亡率低, 影响因素少, 理论上模型可重复性应较好.
编辑: 潘伯荣 审读: 张海宁
| 2. | Harrison JH Jr, Lazo JS. High dose continuous infusion of bleomycin in mice: a new model for drug-induced pulmonary fibrosis. J Pharmacol Exp Ther. 1987;243:1185-1194. [PubMed] |
| 3. | Mir LM, Tounekti O, Orlowski S. Bleomycin: revival of an old drug. Gen Pharmacol. 1996;27:745-748. [PubMed] [DOI] |
| 4. | Chandrasekaran L, Seethalakshmi S, Chandrakasan G, Dhar SC. Alterations in lung and skin compositions of rat in bleomycin-induced fibrosis. Biochem Med Metab Biol. 1987;38:205-212. [PubMed] [DOI] |
| 5. | Matalon S, Harper WV, Goldinger JM, Nickerson PA, Olszowka J. Modification of pulmonary oxygen toxicity by bleomycin treatment. J Appl Physiol. 1985;58:1802-1809. [PubMed] |
| 6. | 金 洪, 田 英麟, 姚 汉德, 杨 剑军, 蔡 少华, 于 国, 田 亚军, 吴 德政. 国产平阳霉素诱发肺损伤后的病理与生 化改变的初步探讨. 中华病理学杂志. 1992;21:278-280. |
| 7. | Hay JG, Haslam PL, Dewar A, Addis B, Turner-Warwick M, Laurent GJ. Development of acute lung injury after the combination of intravenous bleomycin and exposure to hyperoxia in rats. Thorax. 1987;42:374-382. [PubMed] [DOI] |
| 8. | Friedman SL. Molecular mechanisms of hepatic fibrosis and principles of therapy. J Gastroenterol. 1997;32:424-430. [PubMed] [DOI] |
| 9. | Malizia G, Brunt EM, Peters MG, Rizzo A, Broekelmann TJ, McDonald JA. Growth factor and procollagen type I gene expression in human liver disease. Gastroenterology. 1995;108:145-156. [PubMed] [DOI] |
| 10. | Isbrucker RA, Peterson TC. Platelet-derived growth factor and pentoxifylline modulation of collagen synthesis in myofibroblasts. Toxicol Appl Pharmacol. 1998;149:120-126. [PubMed] [DOI] |
| 11. | Kinnman N, Hultcrantz R, Barbu V, Rey C, Wendum D, Poupon R, Housset C. PDGF-mediated chemoattraction of hepatic stellate cells by bile duct segments in cholestatic liver injury. Lab Invest. 2000;80:697-707. [PubMed] [DOI] |
| 12. | Borkham-Kamphorst E, Stoll D, Gressner AM, Weiskirchen R. Antisense strategy against PDGF B-chain proves effective in preventing experimental liver fibrogenesis. Biochem Biophys Res Commun. 2004;321:413-423. [PubMed] [DOI] |
| 13. | Liu YK, Shen W. Inhibitive effect of cordyceps sinensis on experimental hepatic fibrosis and its possible mechanism. World J Gastroenterol. 2003;9:529-533. [PubMed] [DOI] |
| 14. | Alcolado R, Arthur MJ, Iredale JP. Pathogenesis of liver fibrosis. Clin Sci (Lond). 1997;92:103-112. [PubMed] [DOI] |
| 15. | Pinzani M, Marra F, Caligiuri A, DeFranco R, Gentilini A, Failli P, Gentilini P. Inhibition by pentoxifylline of extracellular signal-regulated kinase activation by platelet-derived growth factor in hepatic stellate cells. Br J Pharmacol. 1996;119:1117-1124. [PubMed] [DOI] |
| 16. | Wu J, Norton PA. Animal models of liver fibrosis. Scand J Gastroenterol. 1996;31:1137-1143. [PubMed] [DOI] |
| 17. | Xu JW, Gong J, Chang XM, Luo JY, Dong L, Hao ZM, Jia A, Xu GP. Estrogen reduces CCL4-induced liver fibrosis in rats. World J Gastroenterol. 2002;8:883-887. [PubMed] [DOI] |
| 18. | Garcia L, Hernandez I, Sandoval A, Salazar A, Garcia J, Vera J, Grijalva G, Muriel P, Margolin S, Armendariz-Borunda J. Pirfenidone effectively reverses experimental liver fibrosis. J Hepatol. 2002;37:797-805. [PubMed] [DOI] |
| 19. | Fallowfield JA, Iredale JP. Reversal of liver fibrosis and cirrhosis-an emerging reality. Scott Med J. 2004;49:3-6. [PubMed] [DOI] |
| 20. | Albanis E, Friedman SL. Hepatic fibrosis. Pathogenesis and principles of therapy. Clin Liver Dis. 2001;5:315-334. [PubMed] [DOI] |
| 23. | 施 新猷. 现代医学实验动物学. 北京: 人民军医出版社 2000; 457-459. |