修回日期: 2005-05-10
接受日期: 2005-05-19
在线出版日期: 2005-09-15
在癌细胞脱离原发灶、移动并附着远处器官等癌浸润转移过程中, 细胞黏附分子和细胞黏附力发挥着重要作用.至少有两个细胞黏附系统共同参与细胞连接, 某些细胞黏附分子的表达程度及功能活性状态直接影响着癌细胞的脱离和再附着.细胞黏附的力学强度既可以用力来定义也可以用能量来定义, 细胞黏附的分子基础是受体与其特异性配体间的结合, 近年随着流动腔和微吸管技术的相继引入, 有关受体配体结合动力学的研究已经由三维转到二维水平, 这有助于在细胞和分子水平上揭示力学-化学耦合作用的内在规律及其分子生物学机理, 对认识癌细胞转移等某些重要的病理生理过程有重大意义.
引文著录: 许洪卫. 细胞黏附力和黏附分子对癌侵袭性影响的研究展望. 世界华人消化杂志 2005; 13(17): 2057-2060
Revised: May 10, 2005
Accepted: May 19, 2005
Published online: September 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(17): 2057-2060
- URL: https://www.wjgnet.com/1009-3079/full/v13/i17/2057.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i17.2057
癌转移是一个复杂的多步骤的癌细胞与宿主相互作用的过程.Liotta认为, 黏附、基质溶解和移动是癌细胞侵袭宿主的三大步骤.其中黏附是指癌细胞通过自身膜表面的黏附分子与细胞外基质成分间的相互反应.目前人们对于细胞黏附的研究主要集中在两个方面: 一方面是研究它的生物化学机制, 以细胞黏附分子(cell adhesionmolecules, CAM)的研究为代表[1,2], 近年来这方面取得了很大成绩并已逐渐成为生物学界的热点之一[3,4];另一方面是细胞黏附的生物物理性质和机理的研究, 细胞黏附的一个基本物理问题是黏附的力学强度问题, 这里的力学强度既包括细胞间的黏附强度又包括黏附分子间的分子键强度[5].目前这方面的研究报道尚处于起步阶段, 尤其是肿瘤细胞的黏附力学问题, 国内外所见报道不多.
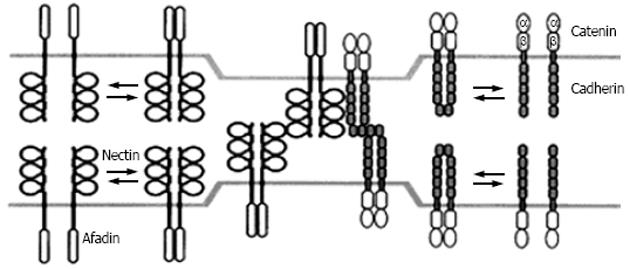
CAM系指存在于细胞膜上的一类跨膜糖蛋白, 包括整合素类(integrins)、钙黏附素类(cadherins)、免疫球蛋白(Ig)类、凝集素类(selectins)四大超家族等[2].细胞黏附和移动等各种细胞功能的发挥离不开细胞连接--包括细胞与细胞间的连接和细胞与细胞外基质的连接.极化的上皮细胞间的连接表现为一种特殊的膜结构形式.可分为紧密连接、黏附连接(adherens junctions, AJs)和桥粒.AJs是其它两种细胞连接形式的基础[6].一般认为, 由钙黏附素、β-连环素(catenins)、α-连环素和丝状肌动蛋白(F-actin)等组成的钙黏附素-连环素系统构成并维系着细胞间的AJs[7].但新近又发现了另一套细胞黏附系统, 它至少由nectin和afadin组成[8].Nectin是一种同源性非钙依赖型的CAM, 属免疫球蛋白超家族, 由nectin-1、nectin-2、nectin-3组成, 其中每个成员又有2-3个剪接变异体, 它们都位于AJs, 具有同型或异型细胞黏附活性.Afadin是一种丝状肌动蛋白结合蛋白, 它有两个剪接变异体, 1-afadin和s-afadin, 人类s-afadin基因突变与急性白血病有关[9].Nectin诸成员的C末端含有保守性基元, 可与afadin的PDZ部分结合, afadin又与丝状肌动蛋白相连, 在AJs中组成另一个独立的黏附连接系统.新近的文献认为[6,10], nectin-1α或nectin-2α与afadin相互结合是钙黏附素介导的AJs中的基本反应通路;nectin-afadin系统与细胞间单纯病毒Ⅰ的传播有关;nectin-2与精源性细胞骨架的形成相关.因此, nectin-afadin系统在细胞连接中发挥着非常重要的作用.
两个细胞黏附系统在功能上是相互关联的(图1).因为钙黏附素介导的细胞黏附作用可激活Src家族激酶, 继而诱导nectin-2δ酪氨酸磷酸化;两系统分别通过各自的细胞内成员afadin和α-连环素相互连接, 共同构建细胞间的AJs.此外, 各自的新成员ponsin(afadin结合蛋白)与vinculin(α-连环素结合蛋白)之间也存在连接点[8].
近年国内外学者通过对黑色素瘤和结直肠癌等肿瘤恶性演进的分子生物学、分子细胞学机制研究发现, 肿瘤的浸润和转移与钙黏附素、整和素等CAM表达水平的变化有关.一方面, 肿瘤细胞表面某些CAM的减少可以使细胞间的黏附性减弱, 肿瘤细胞与细胞外基质成分的黏附性增强, 并导致肿瘤细胞游离出基底膜, 这是肿瘤浸润性生长和远处转移的始动步骤;另一方面, 肿瘤细胞表达的某些CAM使进入血中的肿瘤细胞得以黏附血管内皮细胞, 造成血循转移[1,2].但nectin、afadin与胃癌等肿瘤的关系研究所见文献报道甚少.
我们对不同转移潜能的癌细胞株和癌症患者手术切除标本的初步研究表明, E-钙黏附素表达程度与胃癌细胞浸润转移潜能呈负相关, E-钙黏附素表达下调与胃癌的转移等恶性表型密切相关;E-钙黏附素和连还素表达减弱可能在大肠癌的浸润、转移过程中发挥着重要作用, 同时检测E-钙黏附素、α-连还素、β-连还素三指标的表达比单独检测其中之一更能精确地预测大肠癌的浸润和转移趋势.有限的资料显示, E-钙黏附素基因细胞外区某些外显子缺失或突变, 可能削弱E-钙黏附素的细胞黏附功能, 使低分化印戒状胃癌细胞的侵袭性增强.但连环素等多种因素影响着E-钙黏附素的肿瘤侵袭抑制功能.E-钙黏附素等CAM的表达程度及功能活性状态直接影响着胃癌细胞的脱离和再附着[2].
细胞黏附的力学强度既可以用力来定义也可以用能量来定义.从相对宏观和微观的角度看, 细胞的黏附强度可以在细胞和分子两个水平上表达, 即一个是单个的细胞水平, 一个是单个的分子键水平.在细胞水平, 黏附在一起的两个细胞在被分离的瞬间所受到的分离力即为黏附时的接触力.细胞表面的黏附能量密度是指要分离接触面积为一个单位的细胞对所需作的功.在分子水平, 单键强度是指一个分子键所能承受的最大的力.键能则是指断开一个分子键所需的能量.
细胞黏附的分子基础是受体与其特异性配体间的结合.当受体与配体分子至少一种处于游离状态时, 受体与配体之间的结合是三维的, 目前已有许多方法研究三维受体配体反应动力学.当受体与配体均位于细胞表面时, 受体与配体之间的结合则局限于两细胞之间的二维空间.90年代以来随着流动腔和微吸管技术的相继引入, 有关受体配体结合动力学的研究才由三维转到二维水平.目前二维动力学研究的基本思路是通过黏附概率与接触时间的相关性求得动力学参数.
在外力作用下, 活组织和器官不断改变着其结构和力学特性.作为组织和器官的基本单位, 细胞通过自身形状、结构、力学特性和功能的变化来对力刺激作出适当的反应.检测细胞力学特性的方法包括两大类.一类是针对单细胞的局部特征, 比如细胞探针(cell poking)、局部细胞膜微吸管技术(micropipette aspiration of local cell surface layer)、细胞内包埋或表面黏着外源性磁性颗粒技术、用显微操作器使黏着细胞伸长部分弧度改变技术、声学扫描显微镜以及原子力显微镜(AFM)等[14-16].另一类是针对单细胞的整体特征, 目前主要用于血细胞和肌细胞的力学特性研究.比如全细胞微吸管技术(micropipette aspiration of a whole cell)、用微型平皿对测定细胞的伸缩性、用微吸管对测定细胞的黏弹性[16]以及平行板流动腔系统[17].以下简述其中最具有代表性的两种方法.
又称为微管吸吮实验系统, 是指利用微吸管中的负压对细胞进行直接操作的技术.利用微吸管抓持细胞可实现两细胞的对接连接, 在控制接触面积和接触时间的条件下直接测定细胞与细胞间的黏附概率, 从而排除了流体动力学情况下的干扰因素, 是目前测定细胞黏附力的客观可行的较好方法[16,18].特别是近两年来, Cheng Zhu沿用并改进了Evans et al的方法, 通过控制接触面积和接触时间, 利用同一细胞对反复做黏附实验, 重复上百次, 统计黏附事件发生的频率, 以期达到测定动力学参数的目的[12].
2.4.1 黏附循环测试实验: 以测定CHO细胞二维受体配体(CD16-IgG)结合的动力学速率为例详细说明[19].先将含有半等渗HBSS和1% BSA的溶液3 mL注满显微镜小室, 注入表达受体(1×103)的CHO细胞和被覆配体(1×104)的红细胞, 借助显微操作法, 用相应的微吸管分别吸吮单个的CHO细胞和红细胞并使之呈对称性排列(图2).压力调节系统精确地控制着负压, 使得红细胞的非吸附部分既可维持球形松弛状态(图2A)又容易受作用于吸附部分微力的影响而变形.用计算机辅助的步进电机(piezo translator)操纵红细胞移动, 精确控制两细胞对接的面积和时间(图2B).随着微吸管的缓慢回缩, 两细胞要么立即分离(得分为0), 要么因红细胞被拉长(图2C)而维持短暂的接触(得分为1).
2.4.2 理论计算: 黏附循环测试重复上百次以通过计算黏附次数与测试次数之比来估算总黏附概率(Pt), 特异性黏附概率(Pa)与非特异性黏附概率(Pn)的关系式为: Pa = (Pt-Pa)/(1-Pn), 据此可知, Pa与受体和配体的密度(分别为mr、ml)、接触面积(Ac)和接触时间(t)相关, 如方程式1所示[19]: Pa = 1-exp{-mrmlAcKa[1-exp(-krt)]}(方程式1)
其中, mr、ml可事先分别测出, Ac始终是一个常量, 为了更好地了解Pa与t的关联性, 在每一黏附循环测试系列中, 接触时间都被设定为衡量, 不同的测试系列使用不同的细胞对, 故取系统性方差均值为t值;Ka、kr各为二维结合亲和系数及其反比率.
2.4.3 评价: 与传统的黏附力检测方法相比, 微吸管法具有明显的优点: 红细胞变形是细胞黏附的标志, 通过观察红细胞变形可敏感地检测黏附事件;可人为控制接触条件, 如时间、面积、负压力的大小以及接触频率等;分子键的形成可控制在一个预定的时间内.因此, 微吸管法的许多黏附试验条件可人为调控, 其准确度得到明显提高, 而系统误差被降至最低限度, 可能是目前测定细胞黏附力的较理想方法[20].
细胞流动腔又称为平行板流动腔(parallel-plate flow chamber), 是一个高度远小于横向和纵向几何尺寸的平行平板流动室, 是用以体外研究细胞力学行为的主要工具之一[17].剪切速率G = 6Q/WH2(Q为单位时间的液体流量, W为小室宽度, H为小室高度).剪切速率以细胞能耐受剪切力而不脱落为宜.在细胞黏附力学研究方面, 其基本原理是测定细胞与表面之间每单位位移和每单位黏附持续时间形成的黏附概率, 通过他们之间的定量关系来获得动力学反应速度的信息[20].
2.5.1 恒定力存在下的黏附持续时间: 在细胞黏附的生物物理学研究方面, 流动腔技术也许是最常被采用的研究手段.在流体动力学力存在的情况下, 细胞移动的距离决定着受体与配体的结合与否.我们可以从两种检测方法中获得反转率信息.一种是测定流动的细胞附着于裱衬低密度配体的表面上的黏附持续时间;另一种是在裱衬高密度配体的表面上, 持续滚动的细胞具有滞留-滚动的运动特征, 据此可测得细胞的暂停时间[12].
2.5.2 评价: 流动腔法模拟了白细胞在内皮细胞上的自然流动, 虽然它所受的影响因素较多, 但它比微吸管法更接近于一种生理状态, 在对炎症[21]、肿瘤[22]等病理过程的生物物理机理研究方面, 仍不失为一种理想的较接近生理的模型.
细胞力学行为(黏附、展布、聚集、运动等)及其机制研究, 体现了当前生物力学发展中宏观向微观深入、宏微观相结合这一大趋势, 为细胞间的通讯(当前细胞生物学的热点)拓展了新的研究领域(力学信号的传递、介导、转录、表达), 有助于在细胞和分子水平上揭示力学-化学耦合作用(mechono-chemical effect)的内在规律及其分子生物学机理, 对生物学图式的形成以及认识炎症反应、肿瘤细胞转移等某些重要的病理生理过程有重大意义.
癌细胞浸润和转移性播散机制是现代肿瘤学研究热点之一, 目前国内外研究仅限于针对非肿瘤细胞的力学行为或肿瘤细胞的整和素等CAM基因突变等方面, 若能在同一癌模型上同时探讨细胞黏附力学变化和nectin、afadin等分子生物学变化对癌细胞侵袭潜能的影响, 就有可能为防止癌细胞的脱离和再附着提供新的思路.
编辑: 张海宁
| 6. | Kikyo M, Matozaki T, Kodama A, Kawabe H, Nakanishi H, Takai Y. Cell-cell adhesion-mediated tyrosine phosphorylation of nectin-2δ, an immunoglobulin-like cell adhesion molecule at adherens junctions. Oncogene. 2000;19:4022-4028. [PubMed] [DOI] |
| 7. | Yokoyama S, Tachibana K, Gumbiner BM. Regulation of cadherin adhesive activity. J Cell Biol. 2000;148:399-404. [DOI] |
| 8. | Miyahara M, Nakanishi H, Takahashi K, Horikawa KS, Tachibana K, Takai Y. Interaction of nectin with afadin is necessary for its clustering at cell-cell contact sites but not for its cis dimerization or trans interaction. J Biol Chem. 2000;275:613-618. [PubMed] [DOI] |
| 9. | Horikawa KS, Nakanishi H, Takahashi K, Miyahara M, Nishmura M, Tachibana K, Mizoguchi A, Takai Y. Nectin-3, a new member of immunoglobulin-like cell adhesion molecules that shows homophilic and heterophilic cell-cell adhesion activities. J Biol Chem. 2000;275:10291-10299. [PubMed] [DOI] |
| 10. | Ikeda W, Kakunaga S, Itoh S, Shingai T, Takekuni K, Satoh K, Inoue Y, Hamaguchi A, Morimoto K, Takeuchi M. Tage4/Nectin-like molecule-5 heterophilically trans-interacts with cell adhesion molecule Nectin-3 and enhances cell migration. J Biol Chem. 2003;278:28167-28172. [PubMed] [DOI] |
| 12. | Huang J, Chen J, Chesla SE, Yago T, Mehta P, McEver RP, Zhu C, Long M. Quantifying the effects of molecular orientation and length on two-dimensional receptor-ligand binding kinetics. J Biol Chem. 2004;279:44915-44923. [PubMed] [DOI] |
| 13. | Hinds MT, Park YJ, Jones SA, Giddens DP, Alevriadou BR. Local hemodynamics affect monocytic cell adhesion to a three- dimensional flow model coated with E-selectin. J Biomech. 2001;34:95-103. [PubMed] [DOI] |
| 14. | Bhasin N, Carl P, Harper S, Feng G, Lu H, Speicher DW, Discher DE. Chemistry on a single protein, vascular cell adhesion molecule-1, during forced unfolding. J Biol Chem. 2004;279:45865-45874. [PubMed] [DOI] |
| 15. | Miyazaki H, Hasegawa Y, Hayashi K. A newly designed tensile tester for cells and its application to fibroblasts. J Biomech. 2000;33:97-104. [PubMed] [DOI] |
| 17. | 虞 兰, 郦 鸣阳, 钱 丽君, 王 国雄, 艾 XUN, 顾 兴华, 王 克强. 离体血流循环切应力水平控制方法的研究. 上海生物医学工程杂志. 1999;20:10-15. |
| 18. | Brodland GW, Chen HH. The mechanics of cell sorting and envelopment. J Biomecha. 2000;33:845-851. [PubMed] [DOI] |
| 19. | Chesla SE, Li P, Nagarajan S, Selvaraj P, Zhu C. The membrane anchor influences ligand binding two-dimensional kinetic rates and three-dimensional affinity of FcgammaRIII (CD16). J Biol Chem. 2000;275:10235-10246. [PubMed] [DOI] |
| 21. | Dong C, Lei XX. Biomechanics of cell rolling: shear flow, cell-surface adhesion, and cell deformability. J Biomech. 2000;33:35-43. [PubMed] [DOI] |
| 22. | Kitayama J, Nagawa H, Tsuno N, Osada T, Hatano K, Sunami E, Saito H, Muto T. Laminin mediates tethering and spreading of colon cancer cells in physiological shear flow. Br J Cancer. 1999;80:1927-193. [PubMed] [DOI] |