修回日期: 2005-06-10
接受日期: 2005-06-13
在线出版日期: 2005-08-28
肝X受体(liver X receptors,LXRs)属孤核受体家族,包括LXRα(NR1H3)和LXRβ(NR1H2)两种同源亚型,LXRα在脂代谢密切相关的组织中大量表达,在肝脏中含量最多; 而LXRβ表达广泛.LXRs作为一种氧化固醇激活的核受体,参与机体多种生理活动的调节,包括胆固醇的代谢和转运、脂肪的形成、糖原异生和炎症等过程.本文对LXRs的结构、分布、其信号通路及在胆固醇代谢、脂肪酸合成中的一些重要作用做出一简要综述.
引文著录: 艾正琳, 陈东风, 王晓敏. 肝X受体的研究进展. 世界华人消化杂志 2005; 13(16): 2013-2015
Revised: June 10, 2005
Accepted: June 13, 2005
Published online: August 28, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(16): 2013-2015
- URL: https://www.wjgnet.com/1009-3079/full/v13/i16/2013.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i16.2013
人体细胞核内存在一类具有基因调控作用的核受体(nuclear receptor),由于长期以来未发现其生理性配体而被称为孤受体(orphan receptor).每一个孤受体都有特定的生理性配体,且每一对配体/核受体结合后都相应调控一些特定基因转录表达.人类基因组分析发现,核受体超家族至少有48个成员,分为甾体类和非甾体类两大类.核受体作为配体激活转录因子,调节靶基因的表达,影响机体的许多生理功能[1].其中肝X受体(liver X receptors,LXRs)是孤核受体超家族成员.人LXRs最早是由Willy et al于1995从肝cDNA文库分离得到,因在肝脏表达丰富而命名.近年来随着LXRs内源性配体的发现和分子结构与功能研究的进展,人们对LXRs生物学功能的了解有了长足的进步.LXRs作为一种氧化固醇激活的核受体,参与机体多种生理活动的调节,包括胆固醇的代谢和转运、脂肪的形成、糖原异生和炎症等过程[2].
LXRs结构包括一个核心性DNA结合结构域: 该结构域包含了一个高度保守的锌指结构,使受体与被认为是激素反应元件部位的特异DNA结构结合,启动靶基因的转录,从而发挥基因调控作用; 在蛋白质的NH2-末端包含一个配体非依赖性转录激活作用区; 一个铰链区,可保持受体蛋白的稳定性,使受体在二聚化的同时还可与DNA结合; 尾部的-COOH末端区域较大,包含配体结合域、二聚化接触界面区和一个配体依赖性催化激活功能区[3].
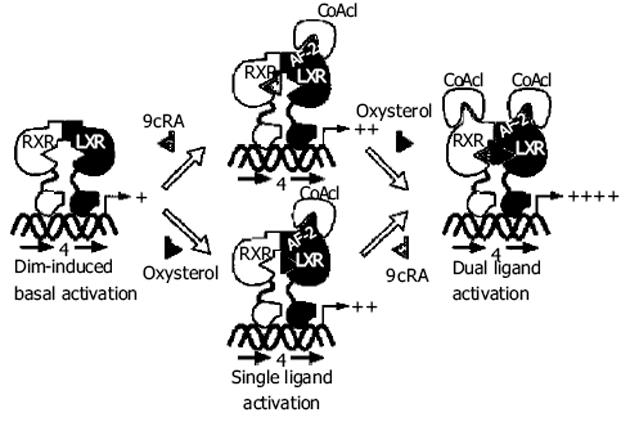
LXRs被内源性配体氧化固醇或人工合成配体激活后,需与类视黄醇X受体(retinoid X receptor,RXR)结合形成异二聚体,方具有转录因子活性.LXRs/RXR异二聚体通过与靶基因中称为LXRE,即LXR反应元件(LXR response element)的特定核苷酸序列结合而调节该基因的转录(图1[5]).LXRE 是一种被4个核苷酸分隔的六核苷酸直接重复序列(称为DR4),其半数核苷酸保守,另一半核苷酸变化显著.LXRs靶基因的转录活化过程可分为三步: (1)配体缺乏时,辅阻遏物与LXRs/RXR结合抑制转录,此途径由组蛋白脱乙酰基酶和染色体修复相关基因介导; (2)激动剂与LXRs或RXR结合,该过程诱导了一个构象的改变,使辅阻遏物解离,辅阻遏子与辅活化子蛋白交换从而修复RNA聚合酶II的活性,并且激活靶基因的表达,产生基础转录; (3)辅活化子补充结合到活化的LXRs/RXRα上,转录被完全激活,此途径配体和受体的结合不依赖于与DNA结合,而直接通过蛋白-蛋白相互作用来完成.异二聚体可被其两个组成部分的配体单独或共同激活,且共同激活时作用相互叠加.LXRs通过上述途径调控胆固醇的代谢、储存、吸收和转运,从而维持胆固醇和脂肪酸代谢平衡[6].
LXRs是机体保持胆固醇相对稳定的关键感受器,可被氧化固醇如24(S)-羟胆固醇、22(R)-羟胆固醇(肾上腺)、27-羟胆固醇(人类巨噬细胞)和24、25-环氧胆固醇(肝脏)激活.LXRs通过调节胆固醇的输出、胆汁酸的产生、脂肪酸的合成及几种脂质转运蛋白从而调控脂质的动态平衡,而这些调控都是通过对上述过程中关键靶基因的转录调节来实现的[7].
胆固醇逆向转运(reverse cholesterol transport,RCT)是周围细胞胆固醇转运至肝脏而被转化、清除的重要生理过程[8].LXRs可调控胆固醇逆向转运,在此过程中LXRs诱导三磷酸腺苷结合盒A1(ATP-binding cassette,ABCA1)和三磷酸腺苷结合盒G1(ATP-binding cassette,ABCG1)的表达,二者是ABC转运蛋白家族中的成员,都是LXRs的靶蛋白.LXRs/RXR通过与DR4元件相互作用介导这一诱导过程,DR4元件似乎是固醇调节ABCA1基因的唯一位点[9].ABCAl是位于组织浆膜中的单体转运蛋白,主要分布于肝、小肠、胎盘、脂肪和脾.ABCAl转运磷脂和胆固醇,被认定是逆向胆固醇转运的限速步骤.ABCAl基因突变导致一种胆固醇失衡引起的疾病: 坦吉尔症(高密度脂蛋白缺乏症)-由于损伤了细胞内胆固醇输出通道,导致血浆高密度脂蛋白(HDL)缺乏.这证明ABCA1基因在LXRs激活的胆固醇输出中有至关重要的作用[6].ABCGl与巨噬细胞固醇细胞内转运有关,是胆固醇和磷脂从细胞内转运到细胞外的受体,特别是载脂蛋白apoA-I和apoE的受体.同时LXRs也诱导ApoE在巨噬细胞和脂肪组织中的表达.Costet et al[10]在培养的巨噬细胞中发现LXRs对ABC1 mRNA和蛋白表达具有调控作用.LXRs的生理性配体22(R)-羟胆固醇可通过激活LXRs,而使ABC1 mRNA表达增加,从富含胆固醇的人类THP1巨噬细胞克隆的ABC1基因的5'端序列转染到RAW巨噬细胞,22(R)-羟胆固醇可使其上游启动子活性增加7倍; 进一步研究发现ABC1基因上游-70到-55 bp区域的由四核苷酸组成的同向重复序列为LXRα/RXR,LXRβ/RXR二聚体的结合位点,该位点的突变将取消脂质介导的ABC1基因启动子的激活和转录.提示LXRs/RXR二聚体的活化介导了脂质引起的ABC1基因的活化.
LXRs也诱导胆固醇酯转运蛋白表达[11],包括磷脂转运蛋白(PLTP)和胆固醇酯转运蛋白(CETP).PLTP是细胞内胆固醇(前β-HDL)产生的有效受体.在此过程中,PLTP将过多的脂蛋白表面磷脂(表面残体)转移至apoA-I.这些残体是脂蛋白酯酶(LPL)水解含甘油三酯(TG)丰富的脂蛋白(如极低脂蛋白,VLDL)时形成的.而且,PLTP通过改造循环中的HDL微粒生成前β-HDL.CETP从HDL微粒到含脂蛋白微粒的载脂蛋白B-100[VLDL,IDL(中间密度脂蛋白),LDL(低密度脂蛋白)和HDL]依次转运胆固醇酯.当IDL和LDL微粒被肝脏吸收时,上述途径介导肝脏胆固醇酯的清除[12].
研究表明啮齿类动物的胆固醇-7α羟化酶(cholesterol 7α-hydroxylase,CYP7A1)是LXRs重要的靶基因之一.胆固醇转变成胆汁酸是体内胆固醇的主要清除途径,CYP7A1被认为是胆固醇转变成胆汁酸基因转录的限速酶.LXRs在胆固醇转变成胆汁酸的代谢过程中的中枢作用已被证实[13].肝细胞内过多的胆固醇通过代谢生成氧化固醇激活LXRs,活化的LXRs上调胆汁酸经典合成途径中的限速酶-CYP7A1的表达.加速胆固醇向胆汁酸转化[14].而胆汁酸作为胆固醇分解代谢的终产物,还可促进过多胆固醇通过ABC转运蛋白ABCG5和ABCG8排泄到胆汁和粪便中.LXRα敲除小鼠在高胆固醇饮食时不能上调CYP7A1的表达,从而导致肝内胆固醇迅速累积而发生毒副作用.有趣的是,1998年Peet et al发现,虽然LXRβ也在肝脏表达,但其存在似乎不能代偿这些小鼠中LXRα的缺失.此外,LXRβ敲除小鼠在高胆固醇饮食下与野生型小鼠没有显著区别[14].然而LXRα/β双敲除小鼠却比LXRα单基因敲除小鼠有更严重的肝脏损害,提示LXRβ也部分参与了对胆固醇代谢的调控.
总之,LXRs在调节胆固醇和胆汁酸的代谢中起到重要作用[15].值得一提的是大鼠、小鼠的胆固醇代谢和人不同,高胆固醇饮食刺激CYP7A1转录仅在大鼠和天然种系小鼠观察到,而人的肝细胞在高胆固醇饮食刺激时却不能上调CYP7A1的表达[16].
LXRs通过对脂肪酸合成的调节间接调控胆固醇的酯化和储存.在高胆固醇条件下,LXRs上调固醇调节元件结合蛋白(sterol regulatory element binding protein-1c,SREBP-1c)的表达[17].因为SREBP-1c是参与脂肪合成基因的主要转录调节因子,SREBP-1c启动子包含一个LXRs的结合位点[18],其蛋白水平的增加,特别是其N 末端含螺旋-环-螺旋亮氨酸拉链结构片断相应的增加,激活了多种参与脂肪酸合成的酶的转录,包括乙酰CoA羧化酶(acetyl CoA carboxylase,ACC)、脂肪酸合酶(fatty acid synthase,FAS)和硬脂酰CoA去饱和酶(steroyl CoA desaturase,SCD-1)等.其中SCD-1催化硬脂酰CoA和软脂酰CoA的Δ9(第9位碳与第10位碳间的双键)去饱和,将他们分别转化为油酰CoA和软脂酰油酰CoA.增多的油酰CoA是脂酰CoA: 胆固醇脂酰转移酶的优势作用底物,可在高胆固醇条件下提高胆固醇酯化以便储存.此外,LXRs也可直接活化FAS的转录,因1为FAS启动子同时含有LXRs和SREBP的结合位点[19].
因此,当细胞内胆固醇浓度过高,LXRs激活SREBP-1c,后者可增加油酸的合成,增多的不饱和脂肪酸与过多的胆固醇酯化,从而促进胆固醇的储存.而减少LXRs的激活可抑制SREBP-1c的转录,从而减少脂肪形成和甘油三酯(TG)合成[20].此外,多不饱和脂肪酸可加速SREBP-1c的分解,因此,多不饱和脂肪酸能通过减少其合成和加强其分解来减少SREBP-1c.LXRs基因敲除小鼠肝脏表达SREBP-1c减少,引起脂质代谢的改变,进一步证实了LXRs 在此途径中的重要作用[17].
总之,过去10年的研究表明了LXRs在脂代谢调节平衡中的重要作用-LXRs/RXR异二聚体与配体结合后可促进许多靶基因的表达[21].如LXRs与激动剂结合可激活SREBP-1c,随后增加脂肪酸、TG和PL的合成; 而且增加ABCA1和ABCG5/ABCG8表达将使甾醇吸收减少,使肝和巨噬细胞中胆固醇、PL流向血浆和胆汁.除此以外,LXRs和配体结合也能直接激活靶基因CYP7A、CETP、LPL和apoE的表达.
尽管在LXRs的分子结构和生理功能研究中取得一些巨大进步,但仍存在一些重要问题,例如将其用于动脉粥样硬化、II型糖尿病等治疗中还有许多问题,如LXRs激动剂有望成为抗糖尿病药,但LXRs被激活后所产生的药理效应会导致严重的肝脂肪变性,其原因可能与胰岛素抵抗和Ⅱ型糖尿病有关[22].这些问题还有待进一步的研究来解决.
编辑: 王谨晖 审读:张海宁
| 1. | Edwards PA, Kennedy MA, Mak PA. LXRs; oxysterol-activated nuclear receptors that regulate genes controlling lipid homeostasis. Vascul Pharmacol. 2002;38:249-256. [PubMed] [DOI] |
| 2. | Houck KA, Borchert KM, Hepler CD, Thomas JS, Bramlett KS, Michael LF, Burris TP. T0901317 is a dual LXR/FXR agonist. Mol Genet Metab. 2004;83:184-187. [PubMed] [DOI] |
| 3. | Valledor AF, Ricote M. Nuclear receptor signaling in macrophages. Biochem Pharmacol. 2004;67:201-212. [PubMed] [DOI] |
| 4. | Joseph SB, Tontonoz P. LXRs: new therapeutic targets in atherosclerosis? Curr Opin Pharmacol. 2003;3:192-197. [PubMed] [DOI] |
| 5. | Peet DJ, Janowski BA, Mangelsdorf DJ. The LXRs: a new class of oxysterol receptors. Curr Opin Genet Dev. 1998;8:571-575. [PubMed] [DOI] |
| 6. | Barish GD, Evans RM. PPARs and LXRs: atherosclerosis goes nuclear. Trends Endocrinol Metab. 2004;15:158-165. [PubMed] [DOI] |
| 7. | Schuster GU, Parini P, Wang L, Alberti S, Steffensen KR, Hansson GK, Angelin B, Gustafsson JA. Accumulation of foam cells in liver X receptor-deficient mice. Circulation. 2002;106:1147-1153. [PubMed] [DOI] |
| 8. | Pelton PD, Patel M, Demarest KT. Nuclear receptors as potential targets for modulating reverse cholesterol transport. Curr Top Med Chem. 2005;5:265-282. [PubMed] [DOI] |
| 9. | Schwartz K, Lawn RM, Wade DP. ABC1 gene expression and ApoA-I-mediated cholesterol efflux are regulated by LXR. Biochem Biophys Res Commun. 2000;274:794-802. [PubMed] [DOI] |
| 10. | Costet P, Luo Y, Wang N, Tall AR. Sterol-dependent transactivation of the ABC1 promoter by the liver X receptor/retinoid X receptor. J Biol Chem. 2000;275:28240-28245. [PubMed] |
| 11. | Luo Y, Tall AR. Sterol upregulation of human CETP expression in vitro and in transgenic mice by an LXR element. J Clin Invest. 2000;105:513-520. [PubMed] [DOI] |
| 12. | Kovanen PT, Pentikainen MO. Pharmacological evidence for a role of liver X receptors in atheroprotection. FEBS Lett. 2003;536:3-5. [PubMed] [DOI] |
| 13. | Ulven SM, Dalen KT, Gustafsson JA, Nebb HI. LXR is crucial in lipid metabolism. Prostaglandins Leukot Essent Fatty Acids. 2005;73:59-63. [PubMed] [DOI] |
| 14. | Lehmann JM, Kliewer SA, Moore LB, Smith-Oliver TA, Oliver BB, Su JL, Sundseth SS, Winegar DA, Blanchard DE, Spencer TA. Activation of the nuclear receptor LXR by oxysterols defines a new hormone response pathway. J Biol Chem. 1997;272:3137-3140. [PubMed] [DOI] |
| 15. | Makishima M. Nuclear receptors as targets for drug development: regulation of cholesterol and bile acid metabolism by nuclear receptors. J Pharmacol Sci. 2005;97:177-183. [PubMed] [DOI] |
| 17. | Schultz JR, Tu H, Luk A, Repa JJ, Medina JC, Li L, Schwendner S, Wang S, Thoolen M, Mangelsdorf DJ. Role of LXRs in control of lipogenesis. Genes Dev. 2000;14:2831-2838. [PubMed] [DOI] |
| 18. | Eberle D, Hegarty B, Bossard P, Ferre P, Foufelle F. SREBP transcription factors: master regulators of lipid homeostasis. Biochimie. 2004;86:839-848. [PubMed] [DOI] |
| 19. | Joseph SB, Laffitte BA, Patel PH, Watson MA, Matsukuma KE, Walczak R, Collins JL, Osborne TF, Tontonoz P. Direct and indirect mechanisms for regulation of fatty acid synthase gene expression by liver X receptors. J Biol Chem. 2002;277:11019-11025. [PubMed] [DOI] |
| 20. | Coleman RA, Lee DP. Enzymes of triacylglycerol synthesis and their regulation. Prog Lipid Res. 2004;43:134-176. [PubMed] [DOI] |
| 21. | Edwards PA, Kast HR, Anisfeld AM. BAREing it all: The adoption of LXR and FXR and their roles in lipid homeostasis. J Lipid Res. 2002;43:2-12. [PubMed] |
| 22. | Grefhorst A, van Dijk TH, Hammer A, van der Sluijs FH, Havinga R, Havekes LM, Romijn JA, Groot PH, Reijngoud DJ, Kuipers F. Differential effects of pharmacological liver X receptor activation on hepatic and peripheral insulin sensitivity in lean and ob/ob mice. Am J Physiol Endocrinol Metab. 2005; [Epub ahead of print]. [PubMed] [DOI] |