修回日期: 2005-05-28
接受日期: 2005-06-30
在线出版日期: 2005-08-28
目的: 体外研究不同亚型干扰素-α(IFN-αF020;2b, IFN-αF020;2a, IFN-αF020;1b)抗HBV活性和信号分子基因应答水平的差异性, 以探讨用信号分子作为一种新的抗病毒评价标准的可能性.
方法: 0.5, 1, 2, 4, 8 MU/L IFN-αF020;2b, IFN-αF020;2a, IFN-αF020;1b作用于2.2.15细胞后, 用Abbott诊断试剂盒分别检测上清中HBsAg, HBeAg的含量, 并计算其抑制率; 1 MU/L IFN-αF020;2b, IFN-αF020;2a, IFN-αF020;1b作用于HepG2细胞后, 利用RT-PCR及Western blotting方法检测胞内STAT1, IFNAR mRNA及蛋白表达水平的差异性.
结果: IFN-α对HBsAg, HBeAg抑制率随药物浓度增加而增强, 当IFN-α浓度为0.5, 1 MU/L时, 三组不同亚型IFN-α对HBsAg, HBeAg抑制率无统计学差异.当浓度为2, 4, 8 MU/L时, IFN-αF020;1b组对HBsAg, HBeAg抑制率明显较IFN-αF020;2b, IFN-αF020;2a组高(HBsAg: F = 4.51, 6.23; HBeAg: F = 3.11, 4.72, P<0.05), 而IFN-αF020;2b, IFN-αF020;2a组间无统计学差异.RT-PCR和Western blotting结果1 MU/L时, IFN-αF020;1b处理组IFNAR, STAT1 mRNA及蛋白表达水平均较IFN-αF020;2b组高, 两组比较无统计学差异.IFN-αF020;1b, IFN-αF020;2b处理组IFNAR, STAT1 mRNA及蛋白表达水平明显较IFN-αF020;2a组高, 均存在统计学差异(mRNA: F = 5.26, 15.6; 蛋白: F = 17.7, 20.1, P<0.05).
结论: IFN-α 1b, IFN-αF020;2b抗HBV活性较强, IFN-αF020;2a较弱.用信号分子STAT1, IFNAR来评价IFN-α抗病毒活性则更为敏感.
引文著录: 卢年芳, 吴莹, 唐霓, 郑瑞强, 朱亚彬, 闫歌, 张秉强, 黄爱龙. 三种IFN-α抗病毒活性新方法的比较. 世界华人消化杂志 2005; 13(16): 1964-1969
Revised: May 28, 2005
Accepted: June 30, 2005
Published online: August 28, 2005
AIM: To investigate the antiviral activity on Hepatitis B Virus and the gene responses of interferon alpha with different subtypes in vitro, and to assess the feasibility of using the signal transduction molecules as a new standard for evaluating the antiviral activities of IFN-α subtypes.
METHODS: After 2.2.15 cells were respectively treated with IFN-α 2b, IFN-α 2a, IFN-α 1b of varied concentrations (0.5,1,2, 4, 8 MU/L), the contents of HBsAg and HBeAg in the supernatant were measured by Abbot kit and the inhibitory rates on HBsAg and HBeAg were calculated. After HepG2 cells were treated with 1MU/L IFN-α 2b, IFN-α 2a, IFN-α 1b, the levels of STAT1, IFNAR mRNA and protein of were detected by reverse transcription polymerase chain reaction (RT-PCR) and Western blotting.
RESULTS: The inhibitory rate of IFN-α 2b, IFN-α 2a, IFN-α 1b on HBsAg and HBeAg showed no statistical differences at the concentration of 0.5 or 1 MU/L. At the concentrations of 2, 4 and 8 MU/L, the inhibitory rate of IFN-α 1b was significantly higher than that of IFN-α 2b or IFN-α 2a (HBsAg: F = 4.51, 6.23; HBeAg: F = 3.11, 4.72, all P<0.05), while there was no significant difference between IFN-α 2b and IFN-α 2a. The levels of IFNAR, STAT1 mRNA and protein expressionwere slightly higher in IFN-α 1b group than that in IFN-α 2b group. However, the levels of mRNA and protein expression in IFN-α 1b or IFN-α 2b group markedly higher than that in IFN-α 2a group (mRNA: F = 5.26, 15.6; protein: F = 17.7, 20.1, all P<0.05).
CONCLUSION: IFN-α 1b and IFN-α 2b have stronger antiviral activity on HBV than IFN-α 2a. The signal transduction molecules (STAT1, IFNAR) are more sensitive in evaluating the antiviral activity of IFN-α.
- Citation: Lu NF, Wu Y, Tang N, Zheng RQ, Zhu YB, Yan G, Zhang BQ, Huang AL. Comparison among three new ways of antiviral activity about interferon alpha. Shijie Huaren Xiaohua Zazhi 2005; 13(16): 1964-1969
- URL: https://www.wjgnet.com/1009-3079/full/v13/i16/1964.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i16.1964
干扰素是一种具有广谱抗病毒, 抗肿瘤和免疫调节作用的细胞因子[1-2].其中干扰素-α在临床上最为常见, 已被广泛地应用于病毒, 原虫, 寄生虫和真菌感染以及白血病, 淋巴瘤, 实体瘤等肿瘤的治疗中.IFN根据其分子结构及抗原性不同可分为α, β, γ三型, 而仅IFN-α家族至少有15种亚型, 目前用于病毒性疾病及肿瘤治疗的IFN-α主要有IFN-αF020;2b, IFN-αF020;2a, IFN-αF020;1b三种亚型.有关IFN-α的不同亚型抗HBV活性的研究观点不一致[3-5].有的学者认为IFN-αF020;1b与IFN-αF020;2b抗HBV疗效相似, 有的学者认为IFN-α 2b抗HBV疗效强于IFN-α 2a.然而另有学者认为IFN-αF020;1b的抗HBV活性最强, IFN-αF020;2b次之, IFN-αF020;2a最弱.但由于临床研究病例数有限, 对照不严格, 研究不系统, 结论不可靠.关于从抗病毒水平和基因应答水平来评价不同亚型IFN-α的抗病毒活性的研究, 至今国内外未见相关报道.我们用Abbot试剂盒检测IFN-α 2b, IFN-αF020;2a, IFN-αF020;1b对2.2.15细胞分泌的HBsAg, HBeAg的抑制率, 用RT-PCR及Western blotting方法检测基因应答水平上信号传导分子STAT1, IFNAR mRNA及蛋白表达水平, 比较信号传导分子的表达水平与IFN-α对HBsAg, HBeAg的抑制率的关系, 来探讨用信号分子作为一种新的抗病毒评价标准的可能性.
HepG2细胞系及2.2.15细胞系: 均由重庆医科大学病毒性肝炎研究所保存.RPMI1640培养基为美国Gibco公司产品, 小牛血清为杭州四季清公司产品, 胎牛血清为美国Hyclone公司产品, G418为美国Sigma公司产品.RNA提取试剂盒为德国Qiagen公司产品, RT-PCR二步法试剂盒为TaKaRa公司产品, ECL增强发光试剂购于美国Pierce公司, 兔抗人STAT1, 兔抗人IFNAR, 羊抗人beta-actin多克隆抗体购于美国Santa Cruz公司.辣根过氧化物酶标记羊抗兔, 兔抗羊IgG购于北京中山生物技术有限公司.100 bp Ladder Marker和λ-EcoT14 I digest DNA Marker PCR标准参照物购于TaKaRa公司.IFN-αF020;1b, IFN-αF020;2b, IFN-αF020;2a均为国产.
实验分为4组.IFN-αF020;2b组; IFN-αF020;2a组; IFN-αF020;1b组; 未加IFN- 的空白对照组.每个IFN-α组中分别有0.5, 1, 2, 4, 8 MU/L五个浓度梯度用来做HBsAg, HBeAg抑制率实验.1MU/L IFN-αF020;2b, IFN-α 2a, IFN-αF020;1b分别作用于HepG2细胞4, 8, 16, 24 h或12, 24, 48 h后收集各组HepG2细胞, 用来做RT-PCR或Western blotting实验.
1.2.1 HBsAg, HBeAg抑制率的测定: 将2.2.15细胞调整为1×108个/L, 接种于24孔培养板中, 每孔1 mL, 待细胞贴壁后, 换用各组含药培养液, 每种浓度药物做3个复孔, 加药后3 d换液一次, 7 d终止实验, 换出的上清液置-20℃保存备测, 并以不含药的培养上清液作为空白对照.用Abbot检测试剂盒对细胞上清液中的HBsAg, HBeAg进行检测.3个平行孔取平均值后计算抑制率(%) = (P/N值对照孔-P/N值实验孔)÷(P/N 值对照孔-2.1).
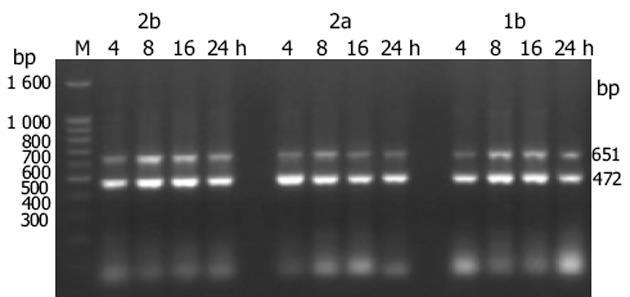
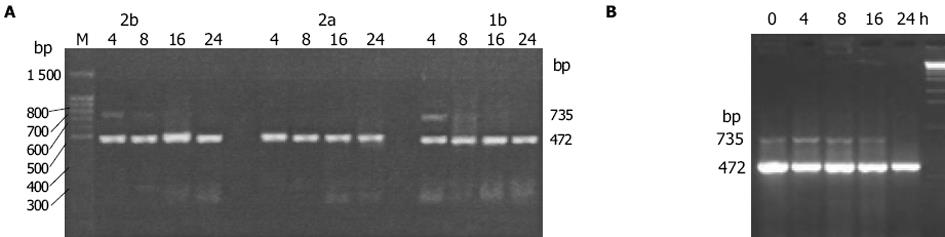
1.2.2 STAT1, IFNAR mRNA水平的检测: 用Qiagen公司的RNA提取试剂盒提取胞内总RNA, 从Gene Bank中找出相应分子的基因序列, 用DNAssist 1.02软件进行同源性分析.最后用Prime Primer引物设计软件进行引物的设计(表1), 送上海生物工程公司合成.
| Target gene | P1 | P2 | product(bp) |
| STAT1 | 5'-GTGATGAACATGGAGGAGTC-3' | 5'-ACTGAACCGCAGCAGGA-3 | 651 |
| IFNAR | 5'-AGTGTTATGTGGGCTTTGGATGGTTTAAGC-3' | 5'-TCTGGCTTTCACACAATATACAGTCAGTGG-3' | 735 |
| β-actin | 5'-TGGCACCACACCTTCTACAA-3' | 5'-GCAGCTCGTAGCTCTTCTCC-3' | 472 |
在逆转录反应体系20 μL中, 加入mRNA 5 μL, 10 mmol/L dNTP 2 μL, RNAse Inhibitor 1 μL, oligo dT 1 μL, AMV Reverse Transcriptase 1 μL, 在设定的条件下进行反应: 42℃ 30 min; 99℃ 5 min; 5℃ 5 min.分别取cDNA 5 μL, 目的基因与β-actin的上下游引物各0.12 μL, Taq酶0.15 μL, 加入到PCR反应体系中扩增.STAT1, IFNAR的反应条件分别为94℃ 4 min; 94℃ 30 s, 61℃ 30 s, 72℃ 50 s; 72℃ 10 min; 94℃ 4 min; 94℃ 30 s, 60℃ 30 s, 72℃ 50 s; 72℃ 10 min, 循环数分别为30, 30.PCR产物经凝胶成像后, 用Image Master TotalLab生物学软件分析条带的吸光值, 以β-actin为内参, 每种分子均扩增3次, 3次结果取平均值为最后结果.
1.2.3 IFNAR, STAT1蛋白表达的Western印迹分析: 参照分子克隆方法提取HepG2细胞胞质蛋白, 并根据需要进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质; 电泳后将PAGE凝胶中的蛋白质通过电转方法转移至硝酸纤维素膜(4℃).用TBST(25 mmol/L Tris, 0.15 NaCl, pH 7.2, 0.5 g/L Tween-20)室温封闭1 h后, 加入相应的兔抗人的IFNAR(1∶1 000稀释), STAT1(1∶3 000稀释), 以及羊抗人的β-肌动蛋白(1∶1 000稀释)多克隆抗体, 4℃过夜.洗膜后加入相应的辣根过氧化物酶标记的羊抗兔以及兔抗羊二抗IgG, 稀释度为IFNAR(1∶10 000), STAT1(1∶30 000), β-肌动蛋白(1∶10 000), 室温1 h.洗膜后, 加入ECL增强发光显色系统显色.运用凝胶成像分析系统进行扫描读取各条带的A值, 蛋白表达量按被测条带与相应的β-actin的比率计算.
统计学处理 数据采用SPSS 10.0 统计软件包进行分析, 各组数据用均数±标准差表示, 组与组间数据应用ANOVAS(Analysis of Variance)分析.
2.2.15细胞分泌的HBsAg, HBeAg在细胞培养3 d时即可检测出, 在7 d达高峰, 且HBeAg分泌量明显高于HBsAg, IFN-α对HBsAg, HBeAg的抑制率随药物浓度的增大而增强(表2), IFN-αF020;1b对HBsAg, HBeAg的抑制率均高于IFN-αF020;2b和IFN-α 2a.当浓度为0.5, 1 MU/L时, IFN-αF020;2b, IFN-αF020;2a, IFN-αF020;1b对HBsAg, HBeAg抑制率均无统计学差异; 当浓度为2, 4, 8 MU/L时, IFN-αF020;1b对HBsAg, HBeAg抑制率明显比IFN-αF020;2b, IFN-αF020;2a高(P<0.05); IFN-αF020;2b对HBsAg, HBeAg抑制率轻微高于IFN-αF020;2a, 但无统计学意义.说明IFN-α 1b体外抗HBV活性最强, IFN-αF020;2b, IFN-αF020;2a抗HBV活性次之.
| (MU/L) | IFN-α 2b | IFN-α 2a | IFN-α 1b | |||
| HBsAg | HBeAg | HBsAg | HBeAg | HBsAg | HBeAg | |
| 0.5 | 21.8±2.2 | 18.1±3.8 | 19.2±1.4 | 17.5±2.8 | 25.0±1.8 | 20.5±2.5 |
| 1.0 | 40.8±3.4 | 35.9±2.0 | 36.0±8.5 | 30.5±7.9 | 44.4±3.2 | 38.9±1.7 |
| 2.0 | 42.0±4.6b | 40.0±3.8b | 42.8±2.4b | 42.0±2.6b | 62.1±1.0 | 51.5±3.4 |
| 4.0 | 51.1±2.7b | 51.3±1.5b | 54.6±2.2b | 50.6±2.6b | 70.9±1.6 | 70.4±2.2 |
| 8.0 | 69.5±1.6a | 65.1±2.3a | 65.0±4.3a | 63.2±5.3a | 73.5±1.5 | 71.6±1.8 |
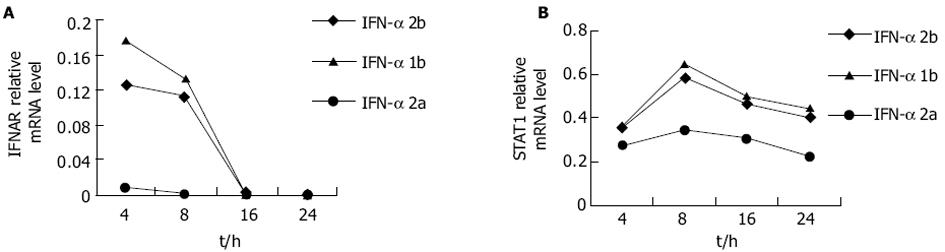
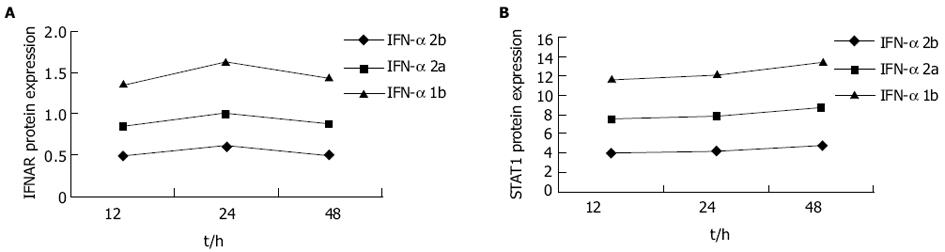
STAT1, IFNAR RT-PCR产物经12 g/L琼脂糖电泳后, 可见其特异性的扩增条带, 且目的条带大小与预想值完全吻合(图1, 图2A).IFN-α作用后STAT1, IFNAR mRNA表达量的相对值均上升(表3), 前者于作用8 h时达高峰, 后者于IFN-α作用开始(4 h)时达高峰, IFN-α作用组IFNAR mRNA的表达量较未加IFN-α组明显升高(图2B).IFN-α作用于HepG2细胞后, STAT1, IFNAR mRNA的表达水平IFN-αF020;1b组略高于IFN-αF020;2b组, 但无统计学差异, 当二者与IFN-αF020;2a组比较时则均存在统计学差异(图3A-B).
| IFN-α 2b | IFN-α 2a | IFN-α 1b | ||||||||||
| 4 h | 8 h | 16 h | 24 h | 4 h | 8 h | 16 h | 24 h | 4 h | 8 h | 16 h | 24 h | |
| STAT1 | 0.347±0.02 | 0.590±0.07 | 0.461±0.11 | 0.413±0.05 | 0.280±0.04 | 0.351±0.01 | 0.302±0.09 | 0.225±0.04 | 0.35±0.05 | 0.65±0.04 | 0.487±0.01 | 0.432±0.09 |
| IFNAR | 0.127±0.01 | 0.113±0.01 | 0 | 0 | 0.008 | 0 | 0 | 0 | 0.180±0.03 | 0.133±0.02 | 0 | 0 |
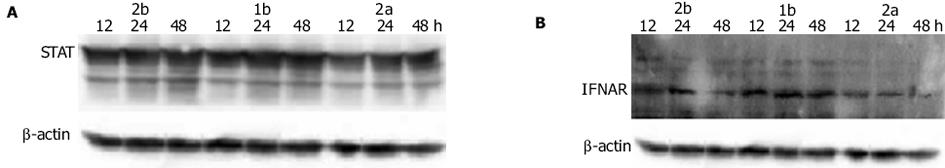
不同亚型的IFN-α作用于HepG2细胞后, 胞内STAT1, IFNAR的蛋白水平逐渐升高, 前者于48 h时达高峰, 后者于24 h时达高峰.IFN-αF020;1b, IFN-αF020;2b作用后STAT1, IFNAR的蛋白水平无统计学上的差异, 但与IFN-αF020;2a相比, 则存在统计学上的差异(P<0.05), 不同亚型IFN-αF020;2b, IFN-αF020;2a, IFN-αF020;1b作用于HepG2细胞12, 24, 48 h后STAT1, IFNAR western印迹结果见图4.STAT1, IFNAR蛋白表达(STAT1/β-actin, IFNAR/β-actin)的趋势图见图5.
鉴于IFN-α存在多种亚型, 为评价不同亚型IFN-α的抗病毒活性, 科学家进行过许多研究, 采用WISH细胞-VSV病毒检测系统, 即IFN-α能刺激Wish细胞株产生抗病毒蛋白, 从而使WISH细胞免受水疱性口炎病毒(VSV)的攻击, 根据待测样品不同稀释度的保护能力, 计算出IFN-α生物学活性单位的方法.但是此检测系统存在着很大的缺限性.因为同一IFN-α在不同的细胞上表现为不同的抗病毒活性, 如在WISH细胞上, 人的IFN-α1的抗病毒活性与IFN-αF020;2a, IFN-αF020;2b相差30倍, 但在MBDK细胞上, 人的IFN-α1, IFN-αF020;2a, IFN-αF020;2b的抗病毒活性相似[6].所以IFN-α在WISH细胞上抗病毒活性的高低, 不能反映他在其他细胞(HepG2或2.2.15细胞)上的抗病毒活性水平.因此用这个系统来评价IFN-α的抗病毒活性具有很大局限性.在体外, 有的学者采用微量细胞病变(CPE)抑制法来比较不同亚型IFN-α在Vero细胞上抗单纯疱疹病毒作用[7].有的学者把含三种不同亚型IFN-α(A1, A4, A9)表达基因的质粒转入小鼠体内, 进行抗巨细胞病毒的研究[8].而有关IFN-α不同亚型在体外肝癌细胞株上抗HBV活性的研究, 国内外却鲜有报道.
IFN-α欲发挥抗病毒作用, 必须首先作用于IFN-α受体(IFNAR), 激活后的IFN-α受体可以导致IFN-α信号传导通道Janus激酶(Janus kinase)家族及信号转导和转录活化因子(signal transducers and activators of transcription, STAT)通道, 即JAK-STAT通道中一系列分子的激活[9-10], 最终产生抗病毒蛋白而发挥抗病毒作用[11].临床上有关IFNAR的研究颇多, 曾有学者[12]发现, 小鼠肝内IFNAR的表达量升高时, IFN-α抗病毒作用增强.而在临床上, 许多学者一致认为肝细胞或单核细胞内IFNAR的表达量是IFN-α抗慢性丙型肝炎病毒(HCV)疗效的决定性因素, IFNAR mRNA的表达量在IFN-α持续反应组明显高于不反应组[13].说明IFN-α受体在抗病毒过程中起重要作用, IFNAR表达量的高低可以间接说明干扰素抗病毒活性的强弱.由此引发我们思考: 经不同亚型IFN-α诱导后, 信号分子IFNAR, STAT1等的表达水平是否存在统计学差异?我们能否通过比较以上分子表达水平来间接评价不同亚型IFN-α抗HBV活性?此外, 以上分子的表达差异是否与IFN-α的抗病毒活性存在某种关系?目前国内外尚未见相关报道.
我们从抗病毒水平与IFN-α信号传导分子的基因应答水平两方面来评价IFN-αF020;2b, IFN-αF020;2a, IFN-αF020;1b的抗病毒活性.在基因应答水平上, HepG2细胞经1 MU/L IFN-α(相当于临床上干扰素-α治疗慢性乙型肝炎的剂量5MU)诱导后, IFN-αF020;1b组, IFN-αF020;2b组IFNAR mRNA及蛋白水平相比无统计学差异, 但均显著高于IFN-αF020;2a组.以上实验结果初步表明1 MU/L IFN-αF020;1b, IFN-αF020;2b的抗病毒活性比IFN-αF020;2a强.Horvath et al[14研究发现能表达出完全活性STAT1分子的HepG2细胞具有很强的抗病毒作用, 而只表达STAT1突变体的HepG2细胞则无抗病毒作用, 另有学者[15]发现, 敲除STAT1基因的小鼠并无异常反应, 但对IFN-α和IFN-γ完全没有反应性, 而且对病毒和微生物的感染异常敏感, 表明STAT1在调节干扰素依赖的生物学反应中扮演关键性角色.我们发现, IFN-α诱导后STAT1 mRNA水平明显上升, 并于4 h时达高峰; Western blotting法检测到STAT1分子的蛋白水平亦逐渐上升, 于48 h时达高峰, 该结果与Melen et al[16]的研究结果一致.IFN-αF020;1b, IFN-αF020;2b诱导后STAT1, STAT2 mRNA或蛋白水平相比无统计学差异, 但均显著高于IFN-αF020;2a.以上结果表明, 在三种不同亚型IFN-α组之间, IFNAR, STAT1的表达水平存在一致性关系, 即IFN-αF020;1b, IFN-αF020;2b诱导组IFNAR, STAT1的表达水平均显著高于IFN-αF020;2a诱导组.STAT1在IFN-α抗病毒过程中与IFNAR一样, 起着同样重要的作用.
在抗病毒水平上, 当IFN-α的浓度达2, 4, 8 MU/L时, IFN-αF020;1b对HBsAg, HBeAg的抑制率比IFN-αF020;2b和IFN-αF020;2a强, 存在显著性差异, IFN-αF020;2b对HBsAg, HBeAg的抑制率虽比IFN-αF020;2a高, 但无统计学差异.1MU/L IFN-αF020;1b, IFN-αF020;2b, IFN-αF020;2a分别作用于2.2.15细胞后, IFN-αF020;1b对HBsAg, HBeAg的抑制率比IFN-αF020;2b和IFN-αF020;2a略强, 三者之间均无统计学差异.而1 MU/L IFN-αF020;1b作用后STAT1, IFNAR的表达水平最高, IFN-αF020;2a最弱.综上所述, IFN-α对HBsAg, HBeAg的抑制率与其诱导后IFNAR, STAT1的表达水平趋势大体一致, 二者之间具有一致性的关系, 即IFNAR, STAT1的表达水平越高, 对HBsAg, HBeAg的抑制率越强.说明从干扰素的基因应答水平(STAT1, IFNAR的表达水平)来评价干扰素抗病毒活性的可能性, 且其灵敏度更高, 故本实验为评价干扰素类药物的抗病毒活性找到了新的方法.
重庆医科大学病毒性肝炎研究所高小玲、宋文鑫硕士, 蒲丹、陶鹏、况舸、陈道荣、张建军、郭进军博士.
编辑: 潘伯荣 审读: 张海宁
| 1. | Alvaro D, Gigliozzi A, Marucci L, Alpini G, Barbaro B, Monterubbianesi R, Minetola L, Mancino MG, Medina JF, Attili AF. Corticosteroids modulate the secretory processes of the rat intrahepatic biliary epithelium. Gastroenterology. 2002;122:1058-1069. [PubMed] [DOI] |
| 2. | Platanias LC, Fish EN. Signaling pathways activated by interferons. Exp Hematol. 1999;27:1583-1592. [PubMed] [DOI] |
| 3. | 邹 淑碧, 张 定凤, 赵 有蓉, 潘 澄清, 秦 波, 范 淳, 张 全海, 王 志毅, 何 华. 重组干扰素a1与a2b治疗慢性乙型肝炎的疗效对比 研究. 中华肝病学会肝脏病杂志. 1994;2:180-181. |
| 5. | Tong F, Tang Y, Bai J. The influence of interferon alpha neutralizing antibodies on the therapeutic effectiveness in patients with chronic viral hepatitis. Zhonghua Shiyan He Linchuang Bingduxue Zazhi. 1999;13:345-347. [PubMed] |
| 7. | 吴 妹英, 杨 吉成, 盛 伟华, 李 丽娥, 谢 宇锋. rhIFNa2a、IFNa2b和IFNa1b、IFNa1b突变体的抗病毒效应的对比分析. 苏州医学院学报. 2001;21:629-631. |
| 8. | Yeow WS, Lawson CM, Beilharz MW. Antiviral activities of individual murine IFN-alpah subtypes in vivo: intramuscular injection of IFN expression constructs reduces cytomegalovirus replication. J Immunol. 1998;160:29322939. [PubMed] |
| 9. | Caraglia M, Vitale G, Marra M, Budillon A, Tagliaferri P, Abbruzzese A. Alpha-interferon and its effects on signalling pathways within cells. Curr Protein Pept Sci. 2004;5:475-485. [PubMed] [DOI] |
| 11. | Han CS, Chen Y, Ezashi T, Roberts RM. Antiviral activities of the soluble extracellular domains of type I interferon receptors. Proc Natl Acad Sci USA. 2001;98:6138-6143. [PubMed] [DOI] |
| 12. | Takane H, Ohdo S, Baba R, Koyanagi S, Yukaura E, Higuchi S. Relationship between 24-hour rhythm in antiviral effect of interferon-beta and interferon-alpha/beta receptor expression in mice. Jpn J Pharmacol. 2002;90:304-312. [PubMed] [DOI] |
| 13. | Hamamoto S, Fukuda R, Ishimura N, Rumi MA, Kazumori H, Uchida Y, Kadowaki Y, Ishihara S, Kinoshita Y. 9-cis retinoic acid enhances the antiviral effect of interferon on hepatitis C virus replication through increased expression of type I interferon receptor. J Lab Clin Med. 2003;141:58-66. [PubMed] [DOI] |
| 14. | Horvath CM, Darnell JE Jr. The antiviral state induced by alpha interferon and gamma interferon requires transcriptionally active Stat1 protein. J Virol. 1996;70:647-650. [PubMed] |