修回日期: 2005-06-12
接受日期: 2005-06-13
在线出版日期: 2005-08-15
目的: 探讨细胞周期调节基因cyclin D1、CDK4、cyclin E和p27Kip1在我国食管鳞癌(SCC)中的表达特点及其在食管上皮癌变中的可能作用.
方法: 应用流式细胞术对81例食管鳞癌中cyclin D1、CDK4、cyclin E、p27Kip1的表达进行检测, 并对结果进行定量分析.
结果: cyclin D1、CDK4、cyclin E蛋白在正常食管上皮的表达都较低, 在异型增生上皮中有所增高, 而在SCC中表达都较高, 且随分化程度的降低而逐渐增高, 组间差异显著(分别为F = 28.369, P<0.01;F = 9.016, P<0.01;F = 22.667, P<0.01).p27Kip1在正常食管上皮中表达最高, 随分化程度的降低而显著减少, 组间差异显著(F = 5.783, P<0.01).p27Kip1表达分别与cyclin D1、CDK4和cyclin E基因表达呈显著负相关(r = -0.380, -0.242, -0.333;P<0.05), 而后三种基因表达之间呈显著正相关(cyclin D1与CDK4 r = 0.711, P<0.01;cyclin D1与cyclin E r = 0.638, P<0.01;CDK4与cyclin E r = 0.430, P<0.01).
结论: 在食管鳞癌中细胞周期调节基因cyclin D1、CDK4、 cyclin E和p27Kip1表达异常与食管上皮细胞癌变密切相关.
引文著录: 金春亭, 张林西, 李海军, 李玉珍, 武欣, 范婕, 左东升, 王淑强. 人食管鳞癌中细胞周期调节基因蛋白的表达. 世界华人消化杂志 2005; 13(15): 1909-1912
Revised: June 12, 2005
Accepted: June 13, 2005
Published online: August 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1909-1912
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1909.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1909
细胞周期调节基因与细胞癌变的关系, 是近年来生命科学领域的研究热点之一. 目前, 已发现在癌变过程中有多种细胞周期调控因子表达异常. 但是, 对于多种细胞周期调节基因在食管上皮癌前病变及食管鳞癌(squamous cell carcinoma, SCC)中的表达特点及可能的作用、多种细胞周期调节基因表达的相互关系, 目前少见报道. 为此, 本研究运用新鲜食管癌手术切除标本, 研究了细胞周期调节基因蛋白cyclin D1、CDK4、cyclin E、p27Kip1在食管SCC及癌前病变中的表达情况, 为食管癌的早期癌变研究提供理论依据.
收集我院附属医院2001-08/12食管癌患者手术切除标本81例. 男50例, 女31例, 年龄30-71岁, 平均年龄55±0.6岁. 其中高分化SCC 39例, 中分化SCC 18例, 低分化SCC 24例. 同时取切端正常食管黏膜5例, 癌旁组织10例. 术后立即取材, 以100 mL/L中性甲醛固定, 常规脱水、浸蜡、包埋, 并进行连续切片, HE染色, 由2位富有经验的病理医师分别进行病理组织学分级诊断. 同时在相同部位取材, 以700 mL/L冷乙醇固定, 进行流式细胞仪检测. 癌旁上皮经组织学证实都有明显的不典型增生. 患者术前未经放疗或化疗. cyclin D1、CDK4、cyclin E、p27Kip1都是小鼠IgG单抗, Santa Cruz公司产品; 羊抗鼠IgG-FITC, Jackson Immunoresearch公司产品. 以上抗体工作液浓度均为1:100.
基因蛋白表达的流式细胞仪检测: 具体方法按文献[1]进行. 基因蛋白表达的定量分析: cyclin D1、CDK4、cyclin E、p27Kip1基因蛋白表达的定量分析: 以荧光指数(Fluorescence Index, FI)表示他们的相对含量, 公式为: FI = (样品基因蛋白表达的平均荧光强度-对照样品平均荧光强度)/正常样品平均荧光强度.
统计学处理 采用SPSS10.0统计软件进行统计分析. 组间显著性检验采用单因素方差分析(ANOVA), 组间多重比较采用Scheffe法. 基因表达之间的相关分析采用Pearson法. P<0.05时表示差异有显著性.
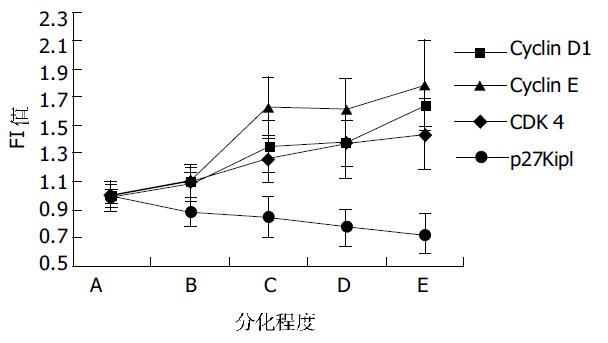
cyclin D1在正常及异型增生上皮中的表达都很低, 而在不同分化SCC中表达较高, 且随分化程度降低显著增高, 在低分化SCC中表达最高(表1), 组间差异非常显著(F = 28.369, P<0.01). 尤其是正常及异型增生组分别与不同分化SCC各组间差异显著(P<0.05).
CDK4的表达随分化程度降低而逐渐增高, 在正常上皮组中最低, 在低分化SCC中最高(表1), 组间差异非常显著(F = 9.016, P<0.01). 特别是正常上皮组和异型增生组分别与中、低分化SCC组间, 高分化与低分化SCC组间差异显著(P<0.05).
cyclin E表达在正常上皮中很低, 异型增生上皮中有明显增高, 而在不同分化SCC中的表达都较高(表1), 组间差异非常显著(F = 22.667, P<0.01). 尤其是正常和异型增生组分别与不同分化的SCC各组间差异显著(P<0.05).
p27Kip1表达在不同分化组间的差异具有显著性(F = 5.783, P<0.01). 其表达在正常上皮中最高, 异型增生上皮中减少, 而在不同分化SCC中的表达则随着分化程度的降低明显减少, 在低分化SCC中表达最低(表1).cyclin D1、CDK4、cyclin E和p27Kip1表达趋势见图1.
对流式细胞仪检测结果进行的相关性分析显示, p27Kip1表达分别与cyclin D1、CDK4、cyclin E基因表达呈显著负相关(相关系数分别为r = -0.380;r = -0.242;r = -0.333;P<0.05). 后3种基因表达之间呈显著正相关(cyclin D1与CDK4相关系数r = 0.711, P<0.01;cyclin D1与cyclin E相关系数r = 0.638, P<0.01;CDK4与cyclin E相关系数r = 0.430, P<0.01).
在食管癌的形成及逐步演进过程中, 可有多个分子事件发生. 其中可能有细胞周期调节基因的表达异常. 细胞周期调节失控是肿瘤发生的重要机制之一. 参与细胞周期调控的因子主要有: 细胞周期蛋白(cyclin)、细胞周期蛋白依赖性激酶(cyclin dependent-kinase, CDK)和CDK抑制因子(cyclin dependent-kinase inhibitor, CKI), 其中CDK是调节细胞周期的核心成分. CKI通过与cyclin、CDK或cyclin-CDK复合物的结合, 抑制CDK的活性, 调节细胞周期进程.
cyclins是具有细胞周期特异性的一组蛋白. 各型cyclin分别与不同的CDKs有特殊亲和力. cyclin D1所表达的蛋白在细胞周期中是G1期细胞增殖信号的关键蛋白, 可与CDK4构成cyclin D1/CDK4复合体, 使Rb抑癌基因产物磷酸化而失活, 从而使细胞进入周期. 若cyclin D1或/和CDK4表达明显增加, cyclin D1/CDK4促细胞增殖活性大大增强, 过多的细胞进入细胞周期, 造成食管上皮的过度增殖以至癌变. 有报道认为cyclin D1参与人体多种肿瘤的形成[2]. 本研究通过对食管癌及癌前病变细胞中cyclin D1及CDK4蛋白表达的检测发现, 随着食管上皮向癌的发展, 蛋白表达明显增高, 提示cyclin D1或/和CDK4基因蛋白过度表达参与食管上皮早期癌变的形成, 可能是一个较好的早期诊断分子标志物. Kitahara et al[3]认为cyclin D1, CDK4过度表达及p16基因缺失可能参与食管癌细胞的自主生长; 另有报道[4-5]认为, cyclin D1基因蛋白过度表达和/或p16蛋白表达缺失是食管SCC的预后指标. 不同学者对cyclin D1基因蛋白在食管癌中的作用还不够一致[6-9]. 进一步说明对食管癌前病变及食管癌进行cyclin D1研究的必要性. 亚硝酸盐是中国食管癌高发区重要的致癌因素之一[10].Youssef et al[11-12]对甲基苄基亚硝胺诱发的大鼠食管癌进行cyclin D1检测发现, cyclin D1过度表达, 并证实在食管癌变中cyclin D1过度表达发生在早期.
cyclin E是G1期的另一个细胞周期蛋白, 表达时间稍晚于cyclin D1, 可与CDK2特异结合形成CDK2/cyclin E复合体, 从而激活CDK2, 促进细胞周期向前进展. 但目前关于cyclin E在食管癌中的研究较少. 本研究发现, cyclin E随食管上皮异型性增高其表达含量逐渐增高, 在低分化SCC中表达最高, 其表达与病理学分级密切相关. 提示cyclin E基因蛋白在食管癌变中可能有重要作用. Anayama et al[13]对食管癌中cyclin E等基因表达研究发现, 其与临床病理参数无关. Matsumoto et al[14]认为cyclin E和CDK2与肿瘤预后无明显关系. cyclin E在食管癌中有高表达, 但是目前尚未确定cyclin E与食管癌临床病理参数之间的关系, 有待进一步研究.
p27Kip1是一个重要的细胞周期抑制蛋白, 属于CDK抑制因子(CKI), 已在一些恶性肿瘤中作过研究, 特别是乳癌、肺癌、膀胱癌和前列腺癌[15]. p27Kip1基因蛋白能广泛抑制各种cyclin和CDK的活性, 但主要是抑制cyclin E-CDK2等G1期激酶复合物, 使细胞不能通过G1期. 我们发现, p27Kip1的表达在正常上皮中最高, 在SCC中则随分化程度的降低其表达显著减少. 提示p27Kip1表达降低参与食管SCC形成及进展. 有研究认为p27Kip1缺失发生在早期癌变过程, 在异型增生上皮表达减少, 侵袭转移性强的癌更倾向于p27Kip1表达缺失[15-16].p27Kip1表达缺失可能与食管癌组织分化及患者预后较差有关[16-18], 可能是此病的一个独立预后指标[18]. 但也有研究[19]发现61%食管癌中有p27Kip1蛋白高表达, 且与肿瘤浸润、淋巴结转移及患者预后较差有关.
因此, 在食管SCC及癌前上皮中有cyclin D1、CDK4、cyclin E蛋白及p27Kip1蛋白等细胞周期调控蛋白表达的紊乱, 促进细胞增殖的cyclin D1、cyclin E及CDK4表达异常增高, 而负性调节基因p27Kip1表达显著减少. 导致过多细胞进入细胞周期, 细胞增殖活性增强以致癌变. 而正常细胞周期的控制需要cyclins、CDK4和抑制蛋白之间的平衡[20].p27Kip1表达分别与cyclin D1、cyclin E及CDK4表达呈负相关, 而后三者之间表达呈正相关, 也说明细胞周期调节蛋白表达紊乱. 对食管上皮癌前病变及食管癌中多种细胞周期相关基因分子标志的研究, 将有助于揭示食管癌的早期癌变机制, 提高食管癌的早期诊断水平.
编辑: 王谨晖 审读:张海宁
| 2. | Motokura T, Arnold A. Cyclin D and oncogenesis. Curr Opin Genet Dev. 1993;3:5-10. [PubMed] [DOI] |
| 3. | Kitahara K, Yasui W, Yokozaki H, Semba S, Hamamoto T, Hisatsugu T, Tahara E. Expression of cyclin D1, CDK4 and p27KIP1 is associated with the p16MTS1 gene status in human esophageal carcinoma cell lines. J Exp Ther Oncol. 1996;1:7-12. [PubMed] |
| 4. | Itami A, Shimada Y, Watanabe G, Imamura M. Prognostic value of p27(Kip1) and CyclinD1 expression in esophageal cancer. Oncology. 1999;57:311-317. [PubMed] [DOI] |
| 5. | Takeuchi H, Ozawa S, Ando N, Shih CH, Koyanagi K, Ueda M, Kitajima M. Altered p16/MTS1/CDKN2 and cyclin D1/PRAD-1 gene expression is associated with the prognosis of squamous cell carcinoma of the esophagus. Clin Cancer Res. 1997;3:2229-2236. [PubMed] |
| 6. | Kunisaki C, Shimada H, Akiyama H, Nomura M, Matsuda G, Ono H. Prognostic factors in esophageal cancer. Hepatogastroenterology. 2004;51:736-740. [PubMed] |
| 7. | Wu MY, Zhuang CX, Yang HX, Liang YR. Expression of Egr-1, c-fos and cyclin D1 in esophageal cancer and its precursors: An immunohistochemical and in situ hybridization study. World J Gastroenterol. 2004;10:476-480. [PubMed] [DOI] |
| 8. | Zuo LF, Lin PZ, Qi FY, Guo JW, Liu JH. Flow cytometric analysis of DNA, telomerase content and multi-gene expression in esophageal epithelial dysplasia. World J Gastroenterol. 2003;9:2409-2412. [PubMed] |
| 9. | Güner D, Sturm I, Hemmati P, Hermann S, Hauptmann S, Wurm R, Budach V, Dörken B, Lorenz M, Daniel PT. Multigene analysis of Rb pathway and apoptosis control in esophageal squamous cell carcinoma identifies patients with good prognosis. Int J Cancer. 2003;103:445-454. [PubMed] [DOI] |
| 11. | Youssef EM, Hasuma T, Morishima Y, Takada N, Osugi H, Higashino M, Otani S, Fukushima S. Overexpression of cyclin D1 in rat esophageal carcinogenesis model. Jpn J Cancer Res. 1997;88:18-25. [PubMed] [DOI] |
| 12. | Wang QS, Sabourin CL, Wang H, Stoner GD. Overexpression of cyclin D1 and cyclin E in N-nitrosomethylbenzylamine-induced rat esophageal tumorigenesis. Carcinogenesis. 1996;17:1583-1588. [PubMed] [DOI] |
| 13. | Anayama T, Furihata M, Ishikawa T, Ohtsuki Y, Ogoshi S. Positive correlation between p27Kip1 expression and progression of human esophageal squamous cell carcinoma. Int J Cancer. 1998;79:439-443. [PubMed] [DOI] |
| 14. | Matsumoto M, Furihata M, Ishikawa T, Ohtsuki Y, Ogoshi S. Comparison of deregulated expression of cyclin D1 and cyclin E with that of cyclin-dependent kinase 4 (CDK4) and CDK2 in human oesophageal squamous cell carcinoma. Br J Cancer. 1999;80:256-261. [PubMed] [DOI] |
| 15. | Chetty R; University Health Network, Princess Margaret Hospital, 610 University Avenue, Fourth Floor, Suite 302 Toronto, ON M5G 2M9, Canada. runjan.chetty@uhn.on.ca. p27 Protein and cancers of the gastrointestinal tract and liver: an overview. J Clin Gastroenterol. 2003;37:23-27. [PubMed] [DOI] |
| 16. | Shibata H, Matsubara O, Wakiyama H, Tanaka S. The role of cyclin-dependent kinase inhibitor p27 in squamous cell carcinoma of the esophagus. Pathol Res Pract. 2001;197:157-164. [PubMed] [DOI] |
| 17. | Yasunaga M, Tabira Y, Nakano K, Iida S, Ichimaru N, Nagamoto N, Sakaguchi T. Accelerated growth signals and low tumor-infiltrating lymphocyte levels predict poor outcome in T4 esophageal squamous cell carcinoma. Ann Thorac Surg. 2000;70:1634-1640. [PubMed] [DOI] |
| 18. | Shamma A, Doki Y, Tsujinaka T, Shiozaki H, Inoue M, Yano M, Kawanishi K, Monden M. Loss of p27(KIP1) expression predicts poor prognosis in patients with esophageal squamous cell carcinoma. Oncology. 2000;58:152-158. [PubMed] [DOI] |
| 19. | Kagawa Y, Yoshida K, Hirai T, Toge T. Significance of the expression of p27Kip1 in esophageal squamous cell carcinomas. Dis Esophagus. 2000;13:179-184. [PubMed] [DOI] |