修回日期: 2005-06-10
接受日期: 2005-06-13
在线出版日期: 2005-08-15
目的: 建立裸鼠人涎腺黏液表皮样癌多药耐药模型, 实施裸鼠体内逆转耐药方案, 为研究逆转耐药机制以及临床逆转涎腺黏液表皮样癌耐药奠定实验基础.
方法: 建立裸鼠人涎腺黏液表皮样癌多药耐药模型采用细胞培养法、裸鼠体内试验以及光镜、透射电镜等方法并观察分化诱导剂HMBA 联合化疗药物逆转肿瘤耐药作用.
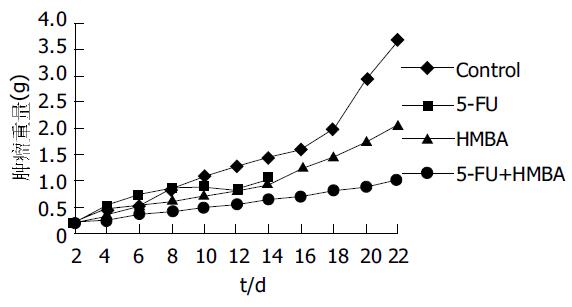
结果: 裸鼠皮下细胞接种成瘤率20/20. 对照组、5-FU、HMBA和5-FU联合HMBA药物治疗组裸鼠存活时间分别为20.8, 13.6, 16.4和21.2 d; 肿瘤倍增时间分别为113, 135, 109和212 h. 与对照组相比, 5-FU和HMBA治疗组肿瘤抑制率分别为25.55和44.0%, 统计学处理无显著性差异(P>0.05).5-FU联合HMBA组肿瘤抑制率为 71.8 %(P<0.05). 联合用药组HE染色坏死细胞少于5-FU组, 但多于HMBA组及对照组. 透射电镜观察细胞有明显的脂滴并有明显的凋亡细胞形成. 联合用药组HE染色多见变性与坏死的细胞, 个别细胞染色质聚集成片类似凋亡细胞.
结论: 分化诱导剂HMBA与5-FU联合应用可在一定程度上减少药物副作用, 同时提高裸鼠的存活质量和其对化疗药物的耐受性, 增加肿瘤细胞对药物的敏感程度而达到逆转效果.
引文著录: 李焰, 吴军正, 刘斌, 李峰, 惠延平, 黄晓峰, 于华. 裸鼠人涎腺黏液表皮样癌多药耐药模型逆转耐药的体内研究. 世界华人消化杂志 2005; 13(15): 1834-1838
Revised: June 10, 2005
Accepted: June 13, 2005
Published online: August 15, 2005
AIM: To establish the multidrug resistance (MDR) model in nude mice using human salivary gland mucoepidermoid carcinoma cell line MEC-1/5-FU and to observe the reversal of multidrug resistance.
METHODS: MEC-1/5-FU cells (0.2 mL, 1×1010/L) were injected into the backs of 20 six-week-old nude mice subcutaneously. After the tumor was developed, the mice were randomly divided into 4 groups, each containing 5 mice. The mice in the four groups were respectively injected with 5-FU (20 mg/kg), HMBA (800 mg/kg), 5-FU (10 mg/kg) plus HMBA (400 mg/kg) and normal saline (control) peritoneally. The tumor mass and the body mass of the nude mice were measured every other day. Three weeks after treatment, the mice were sacrificed, and the tumor tissue was examined by HE staining and transmission electron microscopy.
RESULTS: All the 20 nude mice developed tumor tubules 6-8 days after the injection of MEC-1/ 5-FU cells, and the mean tumor mass was 193 52 mm3. The survival times of the mice were 20.8, 13.6, 16.4 and 21.2 days in control, 5-FU, HMBA and HMBA plus 5-FU group, respectively and the doubling times of the tumor mass were 113, 135, 109 and 212 h, respectively. The tumor inhibition rate was 25.6% in 5-FU group, and 44.0% in HMBA group, whereas that in HMBA plus 5-FU group was 71.8%. Significant difference in tumor inhibition was observed between HMBA plus 5-FU group and control group (P<0.05). Compared with control and HMBA group, there were more necrotic cells in HMBA plus 5-FU group (30-40%), which was fewer than that in 5-FU group (40-50%). Under electron microscopy, obvious necrosis was observed in HMBA plus 5-FU group, and some cells manifested apoptotic features.
CONCLUSION: The combination of HMBA and 5-FU can inhibit tumor growth more efficiently and increase the survival rate of the nude mice.
- Citation: Li Y, Wu JZ, Liu B, Li F, Hui YP, Huang XF, Yu H. Reversal of multidrug resistance in a nude mice model induced by human salivary gland mucoepidermoid carcinoma cell line MEC-1/5-FU in vivo. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1834-1838
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1834.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1834
肿瘤细胞具有对多种化疗药物产生耐药性的特征, 肿瘤细胞的多药耐药(MDR)现象往往导致肿瘤化疗失败, 因此寻求有效可靠多途径的对肿瘤细胞耐药现象的逆转对策是当前研究重要课题[1-2]. 由于MDR的发生机制十分复杂, 近年来, 为研究肿瘤的机制, 国内外诸多实验室在体外诱导耐药细胞系、建立动物耐药模型、选择可靠、有效、精确的逆转MDR方案, 提高化疗的效果等方面正在开展大量工作[3-5]. 黏液表皮样癌是常见的颌面部涎腺恶性肿瘤, 高度恶性的黏液表皮样癌疗效差, 预后不良, 至今尚无有效的治疗方法[6-7]. 我们采用细胞培养体外试验筛选的逆转剂进行裸鼠体内逆转耐药试验, 尝试筛选有效、可行的MDR逆转方案, 为临床涎腺黏液表皮样癌的治疗以及逆转肿瘤耐药奠定实验基础.
采用第四军医大学口腔医学院口腔生物学教研室所建立的人涎腺黏液表皮样癌耐药细胞株MEC-1/5-FU[8]. 复苏后的MEC-1/5-FU细胞继续使用诱导药物持续常规培养于RPMI 1640培养液(含100 mL/L胎牛血清, 10 kU/L青霉素, 100 mg/L链霉素), 50 mL/L CO2, 37 ℃条件, 每3 d更换1次培养液, 5-7 d传代1次. 细胞生长状态稳定后, 取对数生长期MEC-1/5-FU细胞进行实验. 细胞培养所用RPMI 1640培养基、胰蛋白酶为Gibco产品, 5FU购自上海旭东海普制药厂, 六亚甲基双乙酰胺(HMBA)为Sigma产品. 实验用药分别用无菌生理盐水配制成高浓度贮存液-20 ℃存放, 使用时用RPMI 1640培养液作相应稀释. 裸鼠Balb/c.nu系, 6周龄, 体质量18-20 g, 购自上海斯莱克实验动物有限责任公司. 无特定病原体条件(SPF)的空气洁净的层流架内饲养、观察, 所使用的饲养笼具、垫料、饲料、以及饮用水按常规经高压蒸汽灭菌.
常规消化对数生长期的MEC-1/5-FU 细胞, 制备单细胞悬液, 无血清培养液洗涤2次, 重悬于无血清培养液, 计数, 调整细胞密度为1×1010/L, 无菌条件皮下接种于裸鼠背部, 每点接种0.2 mL(2×106个细胞). 接种部位肿瘤长出后, 将裸鼠随机分为4组, 5只/组, 采用体外实验结果选择的逆转药物进行治疗. 于治疗开始每日裸鼠ip相应药物. 5-FU治疗组注射20 mg/kg[9], HMBA组注射800 mg/kg[10], 联合用药组为5-FU 10 mg/kg加HMBA 400 mg/kg, 对照组注射生理盐水. 隔日称量裸鼠体质量同时分别测量瘤体长径a、短径b, 观察记录裸鼠生长及存活状况以及逆转耐药作用的逆转效果. 治疗3 wk后处死裸鼠, 切除肿瘤组织称质量并分别测量瘤体长径a, 短径b, 以瘤体质量为纵坐标, 生长时间为横坐标, 绘制裸鼠肿瘤增殖曲线, 计算肿瘤倍增时间及肿瘤抑制率[9]. 分别将肿瘤以及心、肺、肾、肝脏等主要脏器分别行病理学检查, 标本40 g/L多聚甲醛固定、石蜡包埋, 切片, HE染色, 光镜观察. 透射电镜样品用30 g/L戊二醛固定, 常规处理后, 透射电镜观察各组肿瘤超微结构的变化. 肿瘤体积倍增时间:DT = t[log2/(logVt-logVo)], 公式中t为肿瘤生长时间, Vo和Vt分别为测量瘤体大小开始和结束时的肿瘤体积[11]. 肿瘤抑制率 = (C-T )/C×100. 公式中T为给药组平均瘤质量, C为对照组平均瘤质量.
统计学处理 实验数据采用Mcrosoft Excel, Sigmapolt2000软件进行数据分析.
倒置显微镜下观察MEC-1/5-FU细胞均为贴壁生长的上皮样细胞, 细胞增殖活跃, 核分裂多见, 细胞大小不一可见重叠生长. 细胞增殖率测定群体倍增时间为28.8 h.
细胞接种后3-7 d接种部位出现肿瘤结节, 成瘤率20/20. 观察可见肿瘤结节质地较硬, 增长速度较快, 肿瘤体积大小不等. 瘤块平均体积为193±52 mm3. 分组治疗后密切观察裸鼠一般情况可见, 肿瘤瘤块生长较迅速, 裸鼠反应较敏捷, 进食正常, 治疗6次时5-FU组裸鼠很快消瘦, 反应逐渐迟钝, 进食情况差, 皮肤皱缩并发红, 出现腹泻. 治疗13 d后裸鼠极度消瘦, 陆续死亡2只, 其余反应迟钝, 腹泻严重, 极度衰竭, 为留取标本于治疗2 wk时提前处死5-FU组裸鼠. HMBA组裸鼠治疗前2 wk生长一般状况较明显好于5-FU组, 裸鼠动作活跃, 进食较好, 治疗进行至3 wk时, 可见随瘤体增大裸鼠逐渐消瘦, 进食情况较差. 联合用药组裸鼠动作活跃, 进食正常, 一般情况较其他组好(表1, 图1).
| 分组 | 注药(存活数) | 生存时间(d) | 肿瘤体积(mm3) | 抑瘤率(%) | 瘤体倍增(h) | ||
| 开始 | 13次 | 结束 | |||||
| 对照组 | 5 | 5 | 3 | 20.8 | 3.651±1.172 | 0 | 113 |
| 5-FU组 | 5 | 3 | 0 | 13.6 | 1.055±0.858 | 25.6 | 135 |
| HMBA组 | 5 | 4 | 3 | 16.4 | 2.043±0.356 | 44.0 | 109 |
| 5-FU+HMBA组 | 5 | 5 | 3 | 21.2 | 1.028±0.309a | 71.8 | 212 |
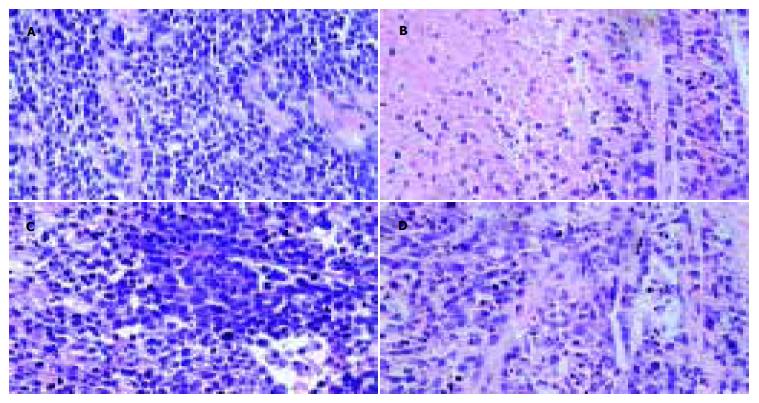
裸鼠背部皮下可见包块隆起, 切开呈圆形位于皮下. 皮下圆形包块和周围组织界限清楚, 易剥离. 包块切面灰白, 质地细腻, 部分有局灶性坏死和囊性变. 部分包块中心部位可见暗褐色坏死灶. 肝、肺、心脏等脏器未见病变, 未查到肿大的淋巴结. 光镜下观察瘤组织呈腺样或巢状排列, 可见不规则的腺腔形成. 细胞密集, 为多角形或梭形, 细胞大小不一, 异形性明显, 胞界清楚, 胞质丰富、红染, 核大深染, 可见嗜酸性核仁, 分裂相多见. 瘤细胞间质可见不规则的纤维间质和黏液样物质, 坏死多见(多灶性的、片状坏死和局灶性坏死), 对照组坏死细胞区域较小, HMBA组细胞增生活跃, 坏死细胞少见. 5-FU组细胞可见大片弥漫性坏死, 坏死细胞约占40-50%, 联合用药组坏死细胞约所占区域少于5-FU组但较对照组和HMBA组为多且明显, 约占观察区域的30-40%(图2).
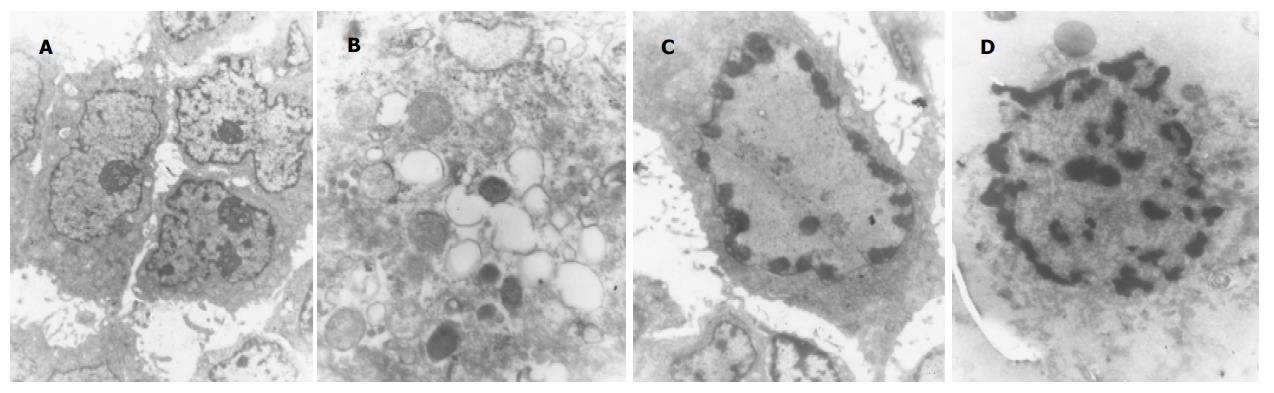
对照组肿瘤细胞不规则、核仁明显, 细胞成片状排列, 形成原始腺样结构. 细胞上皮样特征明显, 细胞之间可见发育不良的细胞连接, 部分细胞散在, 核仁明显, 可见明显的核分裂, 细胞器胞质丰富, 线粒体、核仁较多, 巢之外可见细胞基质成分和较多胶原. 部分细胞内可见脂滴, 有细胞内腺管形成, 少部分细胞有凋亡现象, 可见细胞之间的黏液样基质, 微绒毛发达. 细胞间可见桥粒结构. 5-FU组细胞明显变性, 细胞电子密度降低, 核异染色质增多, 靠近核膜边缘. 核膜腔扩张, 内质网扩张, 线粒体肿胀、空泡化. HMBA组细胞近似圆形或卵圆形, 细胞核异染色质增多, 沿核膜边缘成块状排列, 未见核分裂, 核仁不明显, 有明显的脂滴. 有明显的凋亡细胞形成. 联合用药组部分细胞存活, 可见核分裂, 血管结构尚可, 胞质胞膜较完整, 核内异染色质增多. 部分细胞坏死明显, 变性与坏死的细胞均可见到核膜腔扩张, 染色质凝集靠边, 细胞核破裂成碎片状. 无明显组织结构, 细胞界限不清, 细胞器无法分辨. 胞质崩解坏死的肿瘤细胞聚集成片. 个别细胞染色质聚集成片, 类似凋亡细胞. 坏死严重(图3).
MDR逆转剂是指全部或部分恢复耐药的肿瘤细胞对化疗药物敏感性的一类物质[12], 具有逆转MDR作用的多种药物其作用机理各不相同[13-14], 目前其主要研究方向在于: 寻找高效低毒的逆转剂; 联合应用机制不同的逆转剂; 通过特殊制剂手段; 进行构效关系研究广泛筛选; 采用反义技术在基因水平调节[15]. 有研究表明, 分化诱导剂是众多药物中的一种具有其独特的作用机制的逆转药物. 自1960年代发现分化诱导剂以来, 为恶性肿瘤的化疗提供了新的途径. HMBA为杂极性诱导分化剂的代表, 目前已发现HMBA可对包括人急性早幼粒白血病细胞HL-60、人肾癌细胞以及人胶质瘤等多种肿瘤具有诱导终末分化的作用[16-17]. 本教研室既往曾报道研究HMBA对人黏液表皮样癌治疗及增敏协同抗癌作用[9]. 我们在既往研究的基础上建立裸鼠耐药模型, 进一步观察HMBA对黏液表皮样癌治疗作用及联合化疗药物进行治疗的逆转耐药效应. 实验观察可见:5-FU药物治疗组与对照组以及其他各治疗组相比, 裸鼠生活质量差, 治疗过程中短时间内出现衰竭, 治疗13 d时发现陆续死亡2只. HE染色见细胞大面积坏死, 透射电镜观察细胞电子密度降低, 核异染色质增多, 靠近核膜边缘. 核膜腔扩张, 内质网扩张, 线粒体肿胀、空泡化. 肿瘤抑制率低于30%(25.6%), 统计学处理无显著性差异. 表明该组对治疗药物不敏感, 毒性反应导致裸鼠生存时间缩短. HMBA给药组裸鼠生存时间较5-FU组略延长, 平均存活天数为16.6 d, HE染色坏死细胞少于5-FU组. 透射电镜观察细胞有明显的脂滴并有明显的凋亡细胞形成. 表明虽然HMBA药物毒性低于5-FU, 裸鼠的生活质量有一定改善, 肿瘤抑制率为44.0%, 对肿瘤的治疗存在一定的疗效, 但统计学处理无显著性差异. 5-FU与HMBA联合用药组可观察到一方面较低剂量的联合用药使裸鼠对药物毒性反应有所减轻, 裸鼠存活时间延长. 另一方面肿瘤对药物的敏感性增强, 抑瘤率为71.8%, 经统计学处理有显著性差异(P<0.05).HE染色见变性与坏死的细胞均可见到核膜腔扩张, 染色质凝集靠边, 细胞核破裂成碎片状, 个别细胞染色质聚集成片类似凋亡细胞.
有资料表明, 分化诱导治疗可使异常增殖的癌细胞转变为不增殖的较为成熟的细胞. 其诱导分化的机制有可能为HMBA可一定程度改变细胞膜及信号传递系统并且改变细胞周期调控因子及相关原癌基因与抑癌基因、合成调控特殊功能蛋白质等[18-20]. 肿瘤抑制率为疗效评价指标, 抑制率>30%, 经统计学处理有显著性差异(P<0.05)者, 评定该药对肿瘤有一定疗效[9]. 结合本实验结果试分析: 分化诱导剂HMBA与5-FU联合应用与对照组以及单独用药组相比, 采用较低的给药浓度, 可能在一定程度上减少了药物副作用, 同时部分提高了裸鼠的存活质量和其对化疗药物的耐受性, 从而增加了肿瘤细胞对药物的敏感程度而达到逆转效果, 使肿瘤的抑瘤率得以提高. 作为分化诱导剂的HMBA协同化疗药物治疗及逆转肿瘤细胞耐药的机制尚待进一步研究.
编辑: 潘伯荣 审读:张海宁
| 1. | Boumendjel A, Baubichon-Cortay H, Trompier D, Perrotton T, Di Pietro A. Anticancer multidrug resistance mediated by MRP1: recent advances in the discovery of reversal agents. Med Res Rev. 2005;25:453-472. [PubMed] [DOI] |
| 2. | Ojima I, Borella CP, Wu X, Bounaud PY, Oderda CF, Sturm M, Miller ML, Chakravarty S, Chen J, Huang Q. Design, synthesis and structure-activity relationships of novel taxane-based multidrug resistance reversal agents. J Med Chem. 2005;48:2218-2228. [PubMed] [DOI] |
| 3. | Millet J, Alibert S, Torrentino-Madamet M, Rogier C, Santelli-Rouvier C, Bigot P, Mosnier J, Baret E, Barbe J, Parzy D. Polymorphism in plasmodium falciparum drug transporter proteins and reversal of in vitro chloroquine resistance by a 9,10-dihydroethanoanthracene derivative. Antimicrob Agents Chemother. 2004;48:4869-4872. [PubMed] [DOI] |
| 4. | Limtrakul P, Khantamat O, Pintha K. Inhibition of P-glycoprotein activity and reversal of cancer multidrug resistance by Momordica charantia extract. Cancer Chemother Pharmacol. 2004;54:525-530. [PubMed] [DOI] |
| 5. | Qi J, Wang S, Liu G, Peng H, Wang J, Zhu Z, Yang C. Pyronaridine, a novel modulator of P-glycoprotein-mediated multidrug resistance in tumor cells in vitro and in vivo. Biochem Biophys Res Commun. 2004;319:1124-1131. [PubMed] [DOI] |
| 6. | Sakamoto K, Izumaru S, Kurita T, Miyajima Y, Nakashima T. [Clinical review of mucoepidermoid carcinomas]. Nihon Jibiinkoka Gakkai Kaiho. 2005;108:142-149. [PubMed] [DOI] |
| 7. | Sobral AP, Loducca SV, Nunes FD, de Araújo NS, Kowalski LP, de Araújo VC. Relationship between major and minor salivary gland mucoepidermoid carcinoma malignancy grading and presence of stromal myofibroblasts: immunohistochemical study. J Oral Pathol Med. 2004;33:335-339. [PubMed] [DOI] |
| 9. | 韩 锐. 抗癌药物研究与实验技术. 北京: 北京医科大学、中国协和医科大学联合出版社 1997; 297-459. |
| 11. | Shimomura K, Manda T, Mukumoto S, Masuda K, Nakamura T, Mizota T, Matsumoto S, Nishigaki F, Oku T, Mori J. Antitumor activity and hematotoxicity of a new, substituted dihydrobenzoxazine, FK973, in mice. Cancer Res. 1988;48:1166-1172. [PubMed] |
| 12. | Peer D, Dekel Y, Melikhov D, Margalit R. Fluoxetine inhibits multidrug resistance extrusion pumps and enhances responses to chemotherapy in syngeneic and in human xenograft mouse tumor models. Cancer Res. 2004;64:7562-7569. [PubMed] [DOI] |
| 13. | Li DQ, Wang ZB, Bai J, Zhao J, Wang Y, Hu K, Du YH. Reversal of multidrug resistance in drug-resistant human gastric cancer cell line SGC7901/VCR by antiprogestin drug mifepristone. World J Gastroenterol. 2004;10:1722-1725. [PubMed] [DOI] |
| 15. | Tepsiri N, Chaturat L, Sripa B, Namwat W, Wongkham S, Bhudhisawasdi V, Tassaneeyakul W. Drug sensitivity and drug resistance profiles of human intrahepatic cholangiocarcinoma cell lines. World J Gastroenterol. 2005;11:2748-2753. [PubMed] [DOI] |
| 17. | Palumbo C, Albonici L, Bei R, Bocci C, Scarpa S, Di Nardo P, Modesti A. HMBA induces cell death and potentiates doxorubicin toxicity in malignant mesothelioma cells. Cancer Chemother Pharmacol. 2004;54:398-406. [PubMed] [DOI] |
| 18. | Chou TC, Guan Y, Soenen DR, Danishefsky SJ, Boger DL. Potent reversal of multidrug resistance by ningalins and its use in drug combinations against human colon carcinoma xenograft in nude mice. Cancer Chemother Pharmacol. 2005;56:379-390. [PubMed] [DOI] |
| 19. | Peer D, Dekel Y, Melikhov D, Margalit R. Fluoxetine inhibits multidrug resistance extrusion pumps and enhances responses to chemotherapy in syngeneic and in human xenograft mouse tumor models. Cancer Res. 2004;64:7562-7569. [PubMed] [DOI] |