修回日期: 2005-05-22
接受日期: 2005-06-01
在线出版日期: 2005-08-15
目的: 建立人脐血间充质干细胞(umbilical cord blood mesenchymal stem cells, UCBMSC)的体外分离、培养方法, 体外诱导UCBMSC分化为类肝细胞, 观察UCBMSC细胞生物学特性, 并对类肝细胞进行分子生物学及功能鉴定.
方法: 采用体外细胞培养技术, 分离培养人脐血UCBMSC, 在10 g/L Matrigel作基质, 2.5 mmol/L AZA预处理10-12 h, HGF 10 mg/L+FGF4 10 mg/L+HGM培养基中诱导. 用显微摄像和MTT研究细胞增殖及生长特征, 用流式细胞仪、免疫组织化学、RT-PCR鉴定细胞表型. 采用ELISA法检测培养上清中人白蛋白水平.
结果: 每份脐血可获得150±20个贴壁细胞; 细胞种植后6 d达到对数生长期.连续传10代后, 每份脐带血UCBMSC可扩增达109-1010个细胞. UCBMSC表型为CD44及CD166阳性, CD34及CD45阴性. 在添加FGF4和HGF的Matrigel上诱导培养的UCBMSC在21-28 d时, 形态由长梭形变为三角形, 多角形或类圆形. 细胞转圆率为40%-50%, 双核细胞比率5%-7%. 免疫组化, RT-PCR检测显示未诱导培养的UCBMSC中, 有较少的细胞表达AFP及其mRNA, 未见其他肝脏特有的转录因子或者胞质蛋白标志. 诱导早期可见较多细胞表达GATA4, AFP和CK19及其mRNA, 至诱导后期表达下降, 而ALB, CK18, GST-p和肝细胞转录因子HNF1a表达逐渐上升. ALB, CK18阳性细胞比例达61%-65%.未诱导分化的UCBMSC没有分泌ALB和产生尿素, 诱导分化的UCBMSC以时间依赖方式产生白蛋白.
结论: 人脐血UCBMSC先分化为肝前体细胞, 再分化为成熟肝细胞, 获得了在复制及翻译各环节肝细胞标志阳性的类肝细胞, 已具备肝细胞特有的分泌白蛋白功能.
引文著录: 何念海, 赵文利, 王宇明. 人脐血间充质干细胞体外诱导分化为类肝细胞. 世界华人消化杂志 2005; 13(15): 1814-1818
Revised: May 22, 2005
Accepted: June 1, 2005
Published online: August 15, 2005
AIM: To differentiate human umbilical cord blood mesenchymal stem cells (UCBMSCs) into functional hepatocyte-like cells in vitro, and to identify the molecular biology and function of hepatocyte-like cells.
METHODS: Human UCBMSCs were isolated and cultured in vitro. Matrigel (10 g/L) was used as matrix, and after pretreated with 2.5 mmol/L AZA for 10-12 h, UCBMSCs were induced in HGF (10 mg/L)+FGF4 (10 mg/L)+HGM medium in vitro. The proliferation of UCBMSCs was detected by MTT. The phenotypes of UCBMSCs were identified by flow cytometry, immunohistochemistry, and reverse transcription polymerase chain reaction (RT-PCR). The level of albumin (ALB) in the supernatant was determined with enzyme linked immunosorbent assay (ELISA).
RESULTS: About 150±20 adherent cells were obtained in each cord blood unit, and the growth of the cells entered log phase 6 d after plantation. The number of UCBMSCs reached 109-1010 after 10 generations. The CD44 and CD166 phenotypes were positive in UCBMSCs, whereas CD34 and CD45 were negative. On day 21-28, UCBMSCs changed from long fusiform to polygonal or round-like shape (40-50%). The rate of double-nucleus cells was 5-7%. A few parts of the undifferentiated UCBMSCs expressed alpha-fetoprotein (AFP) and AFP mRNA, but did not express any of the liver-specific transcription factors or cytoplasmic markers. In the early period of induction, many cells expressed GATA4, AFP and CK19 proteins and their mRNA, and their expression reduced in the late period of induction. However, the expression of ALB, CK18, GST-p and hepatic nuclear factor-1a(HNF-1m) increased gradually in the process of induction. The rates of ALB- and CK18-positive cells were 61-65%. The undifferentiated UCBMSCs did not secret ALB and urea while the differentiated UCBMSCs produced ALB in a time-dependent manner.
CONCLUSION: Human UCBMSCs can be successfully induced to differentiate into hepatocyte-like cells, which are able to secret ALB.
- Citation: He NH, Zhao WL, Wang YM. Human umbilical cord blood mesenchymal stem cells differentiate into functional hepatocypte-like cells in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1814-1818
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1814.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1814
骨髓间充质干细胞(marrow mesenchymal stem cell, MMSC)具有向多种中胚层和神经外胚层来源组织细胞分化的能力, 在一定条件下, 还可以形成肌小管和肌腱[1-4]. 大量研究显示MMSC可在人为诱发肝脏病变的实验鼠体内分化为肝细胞, 重建肝脏, 使病鼠肝脏功能恢复正常[5].Ratajczak et al[6]报道CXCR4阳性细胞移出骨髓后表达早期肌肉, 肝脏和神经细胞的mRNA. 体外利用小鼠骨髓细胞或来自骨髓的成体多潜能干细胞在不同条件下可分化为类肝细胞[5,7-14].MSC具有可反复多次采集和自体移植或应用而不出现免疫排斥反应的优势. 如果能够利用易于获得的MSC在体外诱导分化为成熟肝细胞, 将为肝细胞移植及生物人工肝提供大量的细胞来源. 但MSC体内移植尚不能达到大规模增殖, 体外向肝细胞转化尚未见报道. 我们建立人脐带血间充质干细胞(umbilical cord blood mesenchymal stem cell, UCBMSC)的体外分离, 培养方法, 体外诱导分化UCBMSC为类肝细胞, 观察UCBMSC细胞生物学特性, 并对类肝细胞进行分子生物学和功能鉴定.
健康产妇正常分娩的足月顺产人胎儿脐带血共15份. 用脐血收集袋收集每份脐血50-100 mL(肝素抗凝). 脐血与0.01 mol/L pH7.4的PBS按1:1混匀, 再与5 g/L的甲基纤维素按4:1混匀, 静置30 min沉降红细胞. 吸上清, 500 r/min, 4 ℃, 离心5 min, 弃上清, 用0.0 mol/L PBS重悬细胞, 轻轻地叠加到盛有到相对密度1.077的淋巴细胞分离液上(Ficoll与脐带血体积比约1:1), 900 r/min, 20 ℃, 离心20 min, 可见血清, 单核细胞白膜层, 分离液, 红细胞沉淀四个清晰层面, 用吸管小心地收集白色界面单个核细胞层, 用含100 mL/L FBS的MEM培养基洗2次, 500 r/min, 离心5 min洗涤细胞, 以除去Ficoll.MEM培养基重悬单核细胞, 取细胞悬液90 mL, 加入台盼蓝10 mL, 鉴定细胞活率; 计数后, 用含100 mL/L FBS的MEM培养基调整细胞浓度为2×109/L, 接种入培养瓶中, 置于37 ℃, 50 mL/L CO2, 饱和湿度的孵箱内培养. 1 wk后, 更换培养基, 倒置显微镜观察, 弃掉未贴壁细胞. 贴壁细胞即为UCBMSC. 以后每3 d换液1次. 细胞长到80%融合时, 用1:1的2.5 g/L胰蛋白酶和0.2 g/L EDTA混合液消化. 80%融合时给予2.5 g/L胰酶消化(在显微镜下控制消化时间), 按1:3传代扩增. 传代标记为P1, P2, P3......等. 采用MTT法观察细胞生长曲线. 流式细胞仪检测UCBMSC表型标记CD44, CD166, CD34, CD45.
按文献[15]先予10 g/L Matrigel基质包被细胞爬片, 选择第3-5代增生旺盛, 活力良好的UCBMSC, 2.5 mmol/L AZA和20 mL/L FBS预处理10-12 h后, 用0.01 mol/L PBS洗涤2次, 按(10-20)×103cells/cm2接种, 给予HGF 10 mg/L+FGF4 10 mg/L+HGM培养基诱导诱导, 每2 d换液1次. 倒置显微镜观察细胞形态变化.
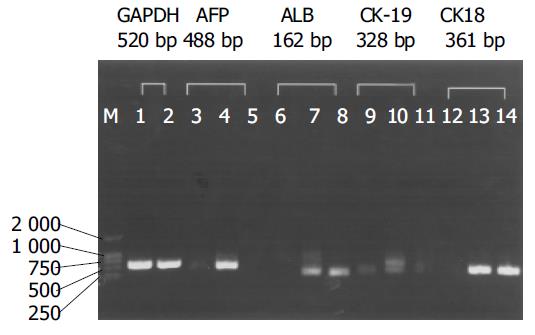
1.2.1 免疫组化法检测肝细胞标志蛋白在诱导分化细胞中的表达及分布: 分别于诱导4, 7, 14, 21, 28 d收集细胞, 并以未诱导UCBMSC作为阴性对照, 以免疫组织化学法检测检测肝细胞早期标志AFP, CK19及转录因子GATA4, 成熟肝细胞标志ALB, CK18, GST-p和肝细胞转录因子HNF1a的表达. 操作按SABC免疫组化说明书进行. 计数阳性细胞比例. 比较不同时相细胞中肝细胞标志表达情况. 分别收集未诱导的UCBMSC和诱导10, 28 d的细胞. RNA的提取按Roche公司RT-PCR试剂盒(Tripure分离试剂)说明书进行, 取上述溶液4 mL加入996 mL无Rnase水中, 在紫外分光光度计上测定A260和A280的值. A260/A280在1.8以上说明RNA纯度符合要求. 吸10 mL(0.4 g/L)RNA样品10 g/L脂糖凝胶, 160 V电压电泳15 min, 于凝胶成像仪上, 拍照. 设计如下5对基因引物: FP基因引物, 特异性扩增片段428 bp. 上游引物:5'-AAATGCGTTTCTCGTTGC-3', 下游引物: 5'-CAGCCTCAAGTTGTTCCTCT-3'; LB基因引物, 特异性扩增片段162 bp. 上游引物: 5'-TGCTTGAATGTGCTGATGACAGGG-3', 下游引物: 5'-AAGGCAAGTCAGCAGGCATCTCATC-3'; K19基因引物, 特异性扩增片段328 bp. 上游引物: 5'-ATGGCCGAGCAGA ACCGGAA-3', 下游引物: 5'-CCATGAGCCGCTGGTACTCC-3'; K18基因引物, 特异性扩增片段361 bp. 上游引物: 5'-GAACCACGAAGAGGAAGTAAA-3'; 下游引物: 5'-CATCTGTAGGGCGTAGCG-3'; APDH看家基因引物, 特异性扩增片段520 bp. 上游引物: 5'-GTCAACGGATTTGGTCTGTATT-3', 下游引物: 5'-AGTCTTCTGGGTGGCAGTGAT-3'. 以提取的RNA为模板进行逆转录和PCR反应. 取扩增液5 mL加溴酚蓝1 mL于20 g/L琼脂糖凝胶电泳, 并加小分子质量标记, 电压50 V, 电泳40 min, 取下凝胶紫外线下观察结果, 并在凝胶成像仪上电脑拍照. 分别于细胞诱导分化的0, 3, 6, 13, 20, 27 d换液, 换液量均为3 mL, 培养24 h后收集上清, 分别以原代培养的单层胎肝细胞上清为阳性对照用放射免疫分析法检测白蛋白浓度. 同时记录培养细胞数. 研究均为复份, 每组研究重复2次. 检测灵敏度为0.5 mg/L. 计算每个细胞每小时白蛋白分泌量[标本浓度(mg/L)×3(mL)×106÷24(h)×细胞总数]pg×100/(细胞穐).
统计学处理 计量资料均以mean±SD表示并进行均数t检验或u检验, 以P<0.05为差异有显著性意义.
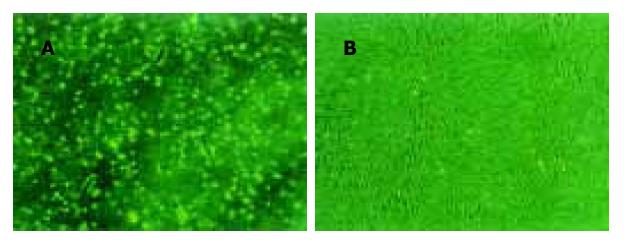
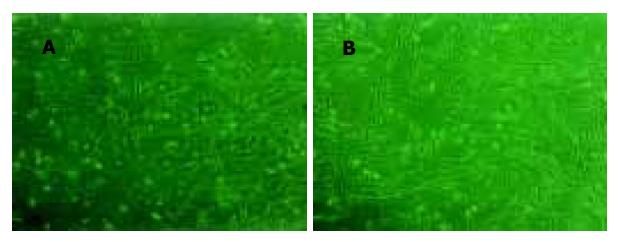
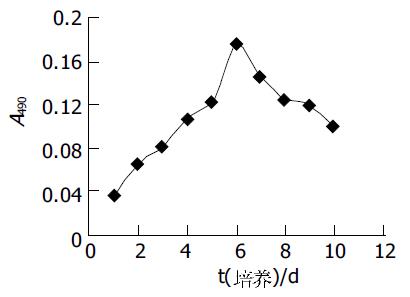
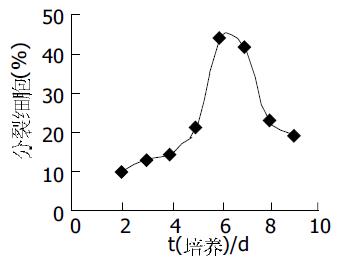
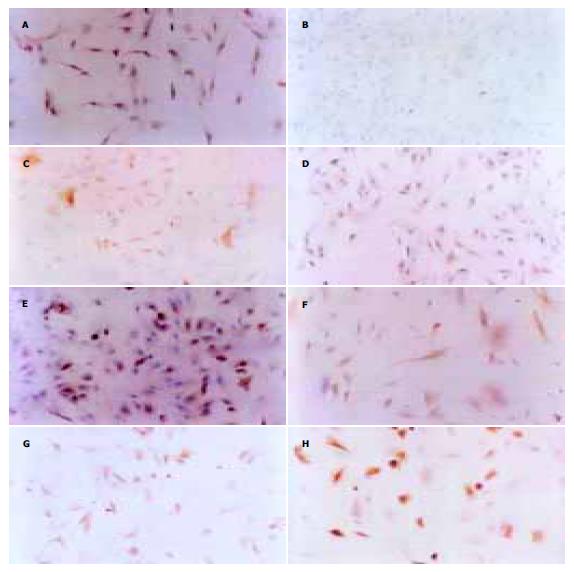
人脐血单核细胞培养后, 20%(3/15)的样本出现间充质样细胞, 细胞数量平均为150±20个贴壁细胞, 胞体呈梭形(图1A), 集落稀少. 原代生长缓慢, 最初散在存在, 2 wk后形成几十到几百个细胞的克隆(图1B), 3 wk后细胞生长达80-90%融合, 每个克隆约几百至几千个细胞, UCBMSC呈较均一的长梭形. 每瓶单层融合的UCBMSC消化后, 平均获得(8.25±0.49)×105个UCBMSC. 将原代细胞传代培养(图2A), 传代后的UCBMSC 1 wk左右融合, 可继续传代扩增(图2B). 传代培养细胞7-9 d可传1代, 传10代后可达到109-1010个细胞. 传代培养10代的细胞未出现衰老征象. 传代培养的潜伏期约为1-3 d, 传代培养细胞的对数增殖期约为2-3 d, 对数增殖期后至接种后8 d进入平台期(图3). 细胞分裂指数曲线的趋势与生长曲线基本类似, 在达到对数生长期后, 分裂相的细胞明显减少(图4). 连续传10代后, 每份脐带血来源的UCBMSC可扩增达到109-1010个细胞. 取培养第5代的细胞, 流式细胞术显示, UCBMSC中CD44及CD166表达阳性细胞比例分别为96.7%和91.7%;CD34及CD45表达阳性细胞比例为0%和2.05%.
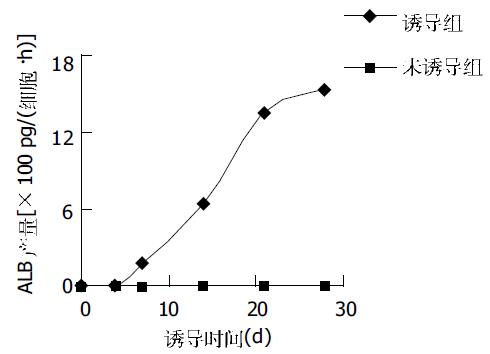
在添加FGF4和HGF的Matrigel上诱导培养的UCBMSC在21-28 d时, 形态由长梭形变为三角形, 多角形或类圆形. 细胞转圆率为40-50%, 双核细胞比率5%-7%. ALB, CK18阳性细胞比例达61-65%(表1, 图5).RT-PCR方法检测A260/A280比值在1.75-1.90之间; 说明RNA质量好, 纯度高. RT-PCR显示, 未诱导的UCBMSC仅可表达微弱的AFP mRNA, 诱导早期可见AFP mRNA和CK19 mRNA表达, 诱导后期未见扩增, 而ALB mRNA, CK18 mRNA早期和后期均可见表达(图6). 在分化过程的不同时间点检测ALB生成, 同期培养的未诱导分化UCBMSC没有分泌ALB; 而给予FGF4和HGF处理后, UCBMSC产生的白蛋白以时间依赖方式增加(图7).
| 标志 | 未诱导 | t(诱导)/d | ||||
| 4 | 7 | 14 | 21 | 28 | ||
| AFP | + | ++ | + | - | - | NT |
| CK19 | - | ± | + | - | - | NT |
| GATA4 | - | ± | + | ++ | ++ | +++ |
| ALB | - | 稀少± | ++ | ++ | ++ | +++ |
| CK18 | - | 稀少± | ++ | +++ | ++ | +++ |
| HNF1a | - | 稀少± | - | ± | + | + |
| +GST-p | - | 稀少± | ± | + | + | ++ |
最近发现脐血中存在MSC[16], UCBMSC形态与MMSC相似, 倍增时间为48 h, 传代后形态基本无变化; UCBMSC不表达CD34及CD45, 强表达CD44及CD166, 与MMSC的表面抗原特性一致, 是脐血中区别于造血干细胞的一群处于未分化状态的非定向干祖细胞. 在添加FGF4和HGF的Matrigel上诱导培养UCBMSC 4 d后表达肝脏特有的转录因子GATA4和较低水平的胞质蛋白CK19, AFP阳性细胞比例达到最高, 同时非常稀少的细胞呈现肝细胞分化中重要的转录因子HNF1a, 胞质蛋白ALB, 或者CK18染色阳性. 在7 d时, 大的上皮细胞出现HNF1a染色阳性, 同时ALB和CK18染色强度增加. 只有非常少的细胞表达AFP.UCBMSC在诱导培养14, 21和28 d后, 大的上皮细胞GATA4, HNF1a, GST-p, CK18和ALB染色阳性, 而AFP或者CK19染色阴性. 用蛋白质印迹分析确认了AFP, CK18和ALB的免疫组化结果. RT-PCR确证了肝细胞分化中重要的胞质蛋白如CK19, CK18, AFP, ALB. 大量研究显示骨髓细胞或纯化的造血干细胞(haemopoietic stem cell, HSC)均可在体内转化为肝细胞[5,7-14]. 我们的实验结果显示UCBMSC向类肝细胞的横向分化是先分化为肝前体细胞, 表达肝细胞分化的早期标志GATA4, CK19和AFP, 再分化为成熟肝细胞, 表达肝细胞的晚期标志HNF1a, HNF-3b, CK18和ALB.UCBMSC在诱导条件下可获得在复制及翻译各环节肝细胞标志阳性的类肝细胞.
业已证明联用FGF4和HGF可将UCBMSC诱导为具有肝细胞形态和表型的细胞[12-14], 单有此点不能证明细胞已分化为肝细胞, 除非证明获得了肝细胞的功能性特征. 白蛋白产生是肝细胞存在和代谢活性的特异性试验. 我们的功能试验结果证明诱导培养后的UCBMSC产生白蛋白, 提示从人脐带血来源的UCBMSC体外用AZA预处理后培养于Matrigel包被并加用FGF4和HGF的HGM培养基时不仅表达肝细胞标志, 更有与肝细胞合成代谢活性一致的功能特征. 成体组织特异性干细胞分化为不同组织细胞的发现对干细胞具有组织特异性的传统生物学观点提出了挑战. 在我们的培养系统中, UCBMSC被诱导, 去分化而变为肝前体细胞, 而后再分化肝细胞样细胞, 象在克隆过程所见的培养系统诱导染色质重塑并改变细胞命运. UCBMSC在体外能被分离, 扩增和保持群体倍增数的未分化状态, 并被诱导特异分化为肝细胞样细胞, 使UCBMSC成为体内基因性或获得性肝病治疗及应用于生物人工肝装置的理想细胞. 进一步的研究是探索UCBMSC衍生的肝细胞样细胞治疗肝脏疾病的潜力.
编辑: 潘伯荣 审读:张海宁
| 1. | Liechty KW, MacKenzie TC, Shaaban AF, Radu A, Moseley AM, Deans R, Marshak DR, Flake AW. Human mesenchymal stem cells engraft and demonstrate site-specific differentiation after in utero transplantation in sheep. Nat Med. 2000;6:1282-1286. [PubMed] [DOI] |
| 2. | Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284:143-147. [PubMed] [DOI] |
| 3. | Mezey E, Chandross KJ. Bone marrow: a possible alternative source of cells in the adult nervous system. Eur J Pharmacol. 2000;405:297-302. [PubMed] [DOI] |
| 4. | Fukuda K. Reprogramming of bone marrow mesenchymal stem cells into cardiomyocytes. C R Biol. 2002;325:1027-1038. [PubMed] [DOI] |
| 5. | Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, Henegariu O, Krause DS. Liver from bone marrow in humans. Hepatology. 2000;32:11-16. [PubMed] [DOI] |
| 6. | Ratajczak MZ, Kucia M, Reca R, Majka M, Janowska-Wieczorek A, Ratajczak J. Stem cell plasticity revisited: CXCR4-positive cells expressing mRNA for early muscle, liver and neural cells 'hide out' in the bone marrow. Leukemia. 2004;18:29-40. [PubMed] [DOI] |
| 7. | Lagasse E, Connors H, Al-Dhalimy M, Reitsma M, Dohse M, Osborne L, Wang X, Finegold M, Weissman IL, Grompe M. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med. 2000;6:1229-1234. [PubMed] [DOI] |
| 8. | Krause DS, Theise ND, Collector MI, Henegariu O, Hwang S, Gardner R, Neutzel S, Sharkis SJ. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell. 2001;105:369-377. [PubMed] [DOI] |
| 9. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 10. | Theise ND, Badve S, Saxena R, Henegariu O, Sell S, Crawford JM, Krause DS. Derivation of hepatocytes from bone marrow cells in mice after radiation-induced myeloablation. Hepatology. 2000;31:235-240. [PubMed] [DOI] |
| 11. | Alison MR, Poulsom R, Jeffery R, Dhillon AP, Quaglia A, Jacob J, Novelli M, Prentice G, Williamson J, Wright NA. Hepatocytes from non-hepatic adult stem cells. Nature. 2000;406:257. [PubMed] [DOI] |
| 12. | Oh SH, Miyazaki M, Kouchi H, Inoue Y, Sakaguchi M, Tsuji T, Shima N, Higashio K, Namba M. Hepatocyte growth factor induces differentiation of adult rat bone marrow cells into a hepatocyte lineage in vitro. Biochem Biophys Res Commun. 2000;279:500-504. [PubMed] [DOI] |
| 13. | Miyazaki M, Akiyama I, Sakaguchi M, Nakashima E, Okada M, Kataoka K, Huh NH. Improved conditions to induce hepatocytes from rat bone marrow cells in culture. Biochem Biophys Res Commun. 2002;298:24-30. [PubMed] [DOI] |
| 14. | Yamazaki S, Miki K, Hasegawa K, Sata M, Takayama T, Makuuchi M. Sera from liver failure patients and a demethylating agent stimulate transdifferentiation of murine bone marrow cells into hepatocytes in coculture with nonparenchymal liver cells. J Hepatol. 2003;39:17-23. [PubMed] [DOI] |
| 16. | Erices A, Conget P, Minguell JJ. Mesenchymal progenitor cells in human umbilical cord blood. Br J Haematol. 2000;109:235-242. [PubMed] [DOI] |