修回日期: 2005-05-29
接受日期: 2005-06-08
在线出版日期: 2005-07-28
目的: 采用健康♂Sprague-Dwley(SD)大鼠建立胰腺外分泌功能研究的动物模型.
方法: 取体质量300-350 g SD大鼠16只, 随机分为两组(对照组8只, 实验组8只). 麻醉后在大鼠幽门下5 mm和十二指肠、空肠交界处分别置直径2 mm的塑料管并固定; 从十二指肠乳头Oddi括约肌处留置直径0.7 mm的塑料管. 稳定30 min后, 每隔15 min收集一次胆胰混合液, 测定体积后留取100 mL胆胰混合液, 用双蒸水稀释以测定蛋白含量, 剩余的胆胰混合液在下一收集时间内灌入十二指肠. 收集4管基础状态胆胰混合液后, 实验组以3 mL/h的速度向十二指肠内灌注200 g/L脂肪乳液2 h, 并收集8管胆胰混合液进行体积和蛋白测定. 对照组不进行十二指肠灌注.
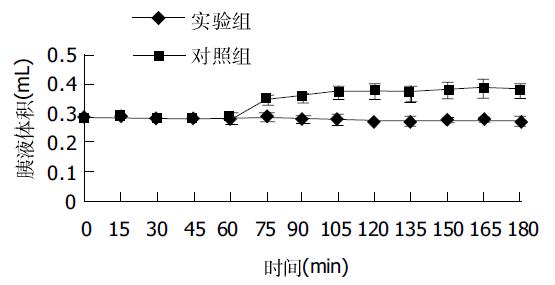
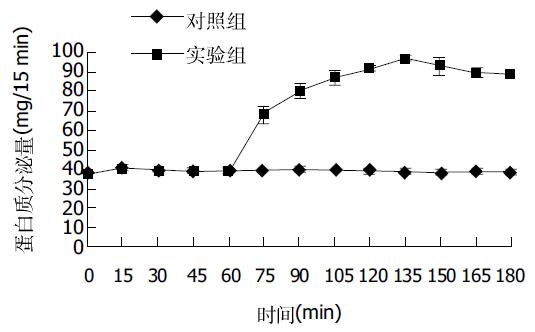
结果: SD大鼠胰管插管后均有澄清淡黄色胆胰混合液流出. 十二指肠灌注200 g/L脂肪乳后胆胰混合液体积较基础状态增加54.17%(P<0.01); 蛋白分泌量较基础状态增加115.1%(P<0.01), 实验组十二指肠灌注后胰液的蛋白含量和胰液体积均较灌注前升高, 对照组胰液蛋白含量和体积无变化.
结论: 本实验成功建立胰腺外分泌功能研究的SD大鼠模型, 优点在于可以直接收集胆胰混合液进行各项指标测定, 反映胰腺外分泌功能, 是一个有效、可靠, 重复性好的动物模型.
引文著录: 陈小燕, 李兆申, 屠振兴, 曹晓鹏. 胰腺外分泌功能研究大鼠模型的建立. 世界华人消化杂志 2005; 13(14): 1760-1762
Revised: May 29, 2005
Accepted: June 8, 2005
Published online: July 28, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(14): 1760-1762
- URL: https://www.wjgnet.com/1009-3079/full/v13/i14/1760.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i14.1760
到目前为止, 国内关于直接测定胰液以研究胰腺外分泌功能的大鼠模型鲜见报道, 1990年袁葆直et al[1]对胰腺外分泌功能的研究曾经用Wistar大鼠胰腺插管收集胰液. 以后国内学者多采用大鼠血清葡萄糖、血清淀粉酶、胰腺组织淀粉酶、胰腺腺泡3H-亮氨酸掺入的测定等来间接反映胰腺外分泌功能的改变[2], 但具有局限性. 为此, 我们参考文献[3-6], 采用健康♂Sprague-Dwley(SD)大鼠建立胰腺外分泌功能研究的动物模型, 这样就可以直接收集大鼠胰液测定胰液的体积、碳酸氢根浓度和蛋白浓度以直观反映胰腺外分泌功能, 在此基础上可进一步研究胰腺外分泌功能的机制.
体质量300-350 g的健康♂SD大鼠(西普尔-必凯实验动物有限公司)16只, 随机分为两组, 对照组8只, 实验组8只. 200 g/L脂肪乳液购自广东侨光制药有限公司, 直径2 mm的塑料管改良自扬州市长城医疗器械厂制造的一次性使用静脉输液针, 恒流泵HL-2B购自上海市清浦沪西仪器厂, 一次性使用intima-Ⅱ静脉留置针购自江苏碧迪医疗器械有限公司, 微量进样器购自上海安亭微量进样器厂, BCA蛋白质检测试剂盒购自PIERCE公司.
实验组动物禁食过夜, 实验前2 h禁水. 以20 g/L氯胺酮(60-80 mg/kg)腹腔麻醉后固定于恒温金属板上, 维持肛温37 ℃.实验过程中每30 min追加一次1/3麻醉剂量的氯氨酮. 用安尔碘消毒腹部皮肤后, 沿腹正中切口开腹, 暴露胃及十二指肠、胰腺, 在幽门下5 mm和十二指肠、空肠交界处分别留置直径2 mm的塑料管并固定以待十二指肠脂肪乳的灌注, 仔细分离幽门周围结缔组织后结扎幽门, 结扎空肠上段; 暴露胰管, 从十二指肠乳头处顺畅无阻力地插入外径0.7 mm的一次性使用intima-Ⅱ静脉留置针, 拔出针芯, 固定留置针导管以收集胰液. 动物稳定30 min后, 每隔15 min收集一次胰液, 测定体积后留取100 mL胰液用双蒸水稀释以测定蛋白含量, 其余部分胰液在下一收集时段内从幽门下留置管内匀速注入十二指肠. 收集4管基础状态胰液后开始以恒流泵HL-2B按3 mL/h的速度向十二指肠内灌注200 g/L脂肪乳液2 h, 并收集8管灌注后胰液. 对照组除了不进行十二指肠灌注外, 其余处理同实验组.
(1)胰液体积测定: 采用微量进样器测定胰液体积(mL). (2)胰液蛋白测定: 采用BCA法. 操作流程严格按照BCA蛋白质检测试剂盒说明书进行.
统计学处理 实验数据以means±SD表示, 应用SPSS 11.0统计软件, 采用t检验对各组均数进行显著性检验, P<0.05为有统计学意义.
对照组180 min内单位时间(15 min)分泌的胰液体积无明显变化, 实验组十二指肠内灌注200 g/L脂肪乳液2 h后单位时间分泌的胰液体积均值较注射前增加31.6%(P<0.01). 对照组和实验组在后120 min内胰液的蛋白分泌量各时间点均值比较, 在第105、120、165、180 min有显著性差别(P<0.05)(图1).
单位时间的胰液蛋白分泌量根据单位时间内分泌的胰液体积乘以同时间段内胰液的蛋白含量计算, 以15 min为一个单位. 对照组180 min内胰液蛋白分泌量无明显变化, 实验组十二指肠内灌注200 g/L脂肪乳液2 h后胰液蛋白分泌量增加115.1%(P<0.01). 对照组和实验组在后120 min内胰液蛋白分泌量各时间点均值比较均有显著性差别(P<0.01)(图2).
餐后胰腺外分泌是食物消化吸收过程中的重要组成部分, 目前认为这一过程主要由内分泌激素胆囊收缩素(cholecy-stokinin, CCK)及迷走-迷走反射作用于胰腺的迷走神经胆碱能节后神经调节[7-11]. 但餐后迷走神经信号的上传、中枢整合后控制胰腺分泌信号的下传神经通路及在这一通路中参与的神经递质还未阐明. 但是到目前为止, 国内关于直接测定胰液以研究胰腺外分泌功能的大鼠模型鲜有报道. 因此, 有必要建立一个有效、可靠、重复性好的动物模型以进行胰腺外分泌调节机制的进一步研究.
胰腺外分泌的调节分为头相、胃相和肠相. 其中肠相是调节胰腺分泌最重要的组成部分. 食物进入小肠后, 蛋白、脂肪和胃酸通过复杂的网络系统包括激素和神经递质产生局部的肠胰反射进一步刺激胰腺分泌. 实验证明[12]: 在长期应用阿托品以及迷走神经切除者的十二指肠刺激对于胰腺外分泌的影响较小. 由于十二指肠黏膜的迷走神经初级传入纤维含有大量CCK-A及5-羟色胺(5-hydroxy-tryptamine, 5-HT)受体, 肠道内的刺激, 如碳水化合物、高渗盐水及黏膜磨擦等, 可导致肠黏膜嗜铬细胞(enterochromaffin cell, EC)释放5-HT, 继而作用于迷走传入神经末梢的5-HT3受体, 引起迷走反射主导的胰腺分泌. 本研究建立的动物模型希望能够通过十二指肠灌注营养物质, 观察灌注前后收集的腺外分泌功能的改变, 从而能够进一步进行胰腺外分泌调控机制的研究.
胰液是无色、无嗅的碱性液体, pH约为7.8-8.4, 胰液中含有无机物和有机物. 在无机成分中, 碳酸氢盐的含量很高. 胰液中的有机物主要是蛋白, 由多种消化酶组成, 含量由0.1-10%不等, 随分泌的速度不同而有不同. 因此, 可通过测定单位时间胰液的体积和单位时间蛋白分泌量直接反映胰腺外分泌功能的改变.
本实验建立胰的外分泌功能研究的大鼠模采用两组动物胰管插管内均有澄清淡黄色胰液流出, 直接收集胰液进行各项指标(体积、蛋白酶等)测定, 观察胰液外分泌功能的改变, 进一步可以进行各种胰腺外分泌功能的基础研究. 本模型的优点就在于可以直接收集胰液进行各项指标测定, 从而通过测定单位时间胰液的体积、碳酸氢根的浓度和单位时间蛋白分泌量, 直接反映胰腺外分泌功能的改变. 本模型的建立为大鼠胰腺外分泌功能调节机制的研究打下了基础, 是一个有效、可靠, 而且重复性很好的动物模型.
编辑: 王谨晖 审读:张海宁
| 3. | Guan D, Phillips WT, Green GM. Pancreatic secretion stimulated by CCK is not mediated by capsaicin-sensitive vagal afferent pathway in awake rats. Am J Physiol. 1996;270:G881-G886. [PubMed] |
| 4. | Li Y, Hao Y, Owyang C. Evidence for autoregulation of cholecystokinin secretion during diversion of bile pancreatic juice in rats. Gastroenterology. 1995;109:231-238. [PubMed] [DOI] |
| 5. | Li Y, Wu XY, Zhu JX, Owyang C. Intestinal serotonin acts as paracrine substance to mediate pancreatic secretion stimulated by luminal factors. Am J Physiol Gastrointest Liver Physiol. 2001;281:G916-G923. [PubMed] |
| 6. | Li JP, Chang TM, Chey WY. Roles of 5-HT receptors in the release and action of secretin on pancreatic secretion in rats. Am J Physiol Gastrointest Liver Physiol. 2001;280:G595-G602. [PubMed] |
| 7. | Owyang C. Physiological mechanisms of cholecystokinin action on pancreatic secretion. Am J Physiol. 1996;271:G1-G7. [PubMed] |
| 8. | Niebergall-Roth E, Singer MV. Central and peripheral neural control of pancreatic exocrine secretion. J Physiol Pharmacol. 2001;52:523-538. [PubMed] |
| 9. | Li Y, Owyang C. Endogenous cholecystokinin stimulates pancreatic enzyme secretion via vagal afferent pathway in rats. Gastroenterology. 1994;107:525-531. [PubMed] [DOI] |
| 10. | Li Y, Hao Y, Owyang C. High-affinity CCK-A receptors on the vagus nerve mediate CCK-stimulated pancreatic secretion in rats. Am J Physiol. 1997;273:G679-G685. [PubMed] |
| 11. | Li Y, Owyang C. Pancreatic secretion evoked by cholecystokinin and non-cholecystokinin-dependent duodenal stimuli via vagal afferent fibres in the rat. J Physiol. 1996;494:773-782. [PubMed] [DOI] |
| 12. | Adler G, Beglinger C, Braun U, Reinshagen M, Koop I, Schafmayer A, Rovati L, Arnold R. Interaction of the cholinergic system and cholecystokinin in the regulation of endogenous and exogenous stimulation of pancreatic secretion in humans. Gastroenterology. 1991;100:537-543. [PubMed] [DOI] |