修回日期: 2005-05-29
接受日期: 2005-06-08
在线出版日期: 2005-07-28
目的: 研究抗HBV多聚酶TP区VH抗体抑制HepG2.2.15细胞的HBV分泌与复制.
方法: 用HepG2.2.15细胞分泌的HBV的多聚酶TP区作为抗原, 用PCA方法进行VH抗体选择. VH抗体基因克隆到真核表达载体pZeoSV2(+), 把载体转化入HepG2.2.15细胞而抑制细胞分泌病毒颗粒. 荧光定量PCR检测各组细胞HBV DNA含量.
结果: 在抗体库中共选择出3个TP区相关抗体. 抗TP区VH抗体可以抑制HepG2.2.15细胞分泌病毒颗粒. 加入VH抗体的HepG2.2.15细胞(C组)比没加入VH抗体的HepG2.2.15细胞(A, B组)分泌病毒颗粒明显减少(上清内:3.480±0.32 vs 5.268±0.07, 5.105±0.78, P<0.05; 细胞内: 5.718±0.15 vs 7.716±0.74, 7.394±0.97, P<0.05).
结论: 抗HBV多聚酶TP区VH抗体可以抑制HepG2.2.15细胞的HBV分泌与复制.
引文著录: 于俊岩, 兰林, 王宇明, 丁世涛. 幽门螺杆菌感染在肝癌发生中的潜在作用. 世界华人消化杂志 2005; 13(14): 1692-1695
Revised: May 29, 2005
Accepted: June 8, 2005
Published online: July 28, 2005
AIM: To study a functional variable fragment of heavy chain (VH) antibody against the terminal protein (TP) region of hepatitis B virus (HBV) polymerase (Pol) and its inhibition on the replication of HBV in vitro.
METHODS: The TP region of HBV Pol secreted by the HepG2.2.15 cells was used as an antigen, and the antibodies were selected with protein fragment complementation assay (PCA). The VH antibody gene was cloned into expression vector pZeoSV2(+), and then pZeoSV2(+)-VH was transfected into HepG2.2.15 cells. The contents of HBV DNA in the cells were detected by fluorescent quantitative polymerase chain reaction (FQ-PCR).
RESULTS: Three antibodies against the TP region of HBV were selected. The replication of HBV was markedly inhibited by the anti-TP Pol VH antibodies. The contents of HBV DNA in the pZeoSV2(+)-VH transfected cells (Group C) were significantly higher than those in the non-transfected and pZeoSV2(+) transfected cells (Group A and C)(Supernate: 3.480±0.32 vs 5.268±0.07, 5.105±0.78, P<0.05; Intracellular: 5.718±0.15 vs 7.716±0.74, 7.394±0.97, P<0.05).
CONCLUSION: The anti-TP Pol VH antibodies can inhibit the replication of HBV in HepG2.2.15 cells.
- Citation: Yu JY, Lan L, Wang YM, Ding ST. Variable fragment of heavy chain antibody against TP region of Hepatitis B Virus polymerase inhibits replication of hepatitis B virus in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(14): 1692-1695
- URL: https://www.wjgnet.com/1009-3079/full/v13/i14/1692.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i14.1692
乙型肝炎病毒是引起慢性肝病和肝细胞肝癌的主要原因[1]. 治疗慢性乙型肝炎是预防肝细胞肝癌的一项重要措施. 在慢性乙型肝炎的治疗中, 重链可变区抗体(VH)是一个人工合成的、有特异高亲和力的抗体. 在本研究中我们检测了重链可变区抗体抑制HBV复制的效果. 有多种技术可以从抗体库中选择特异性抗体, PCA方法在抗体选择中显示出很多优点. 在PCA方法中, mDHFR基因被分割成两部分:mDHFR[1]和mDHFR[2], 他们分别与抗原和抗体基因相连. 当编码mDHFR的两个载体被共转化进细菌时, 如果特异性抗原、抗体相互识别, 那么分别与他们相连的mDHFR[1]和mDHFR[2]就会接触而恢复完整的mDHFR酶活性, 细菌得以存活.
pZeoSV2(+)、转染试剂盒LipofectamineTM 2000均购自Invitrogen, 限制性内切酶购自新英格兰公司, BD In-FusionTM PCR Cloning Kit购自BD Biosciences Clontech, 测序由上海生物工程公司完成, HepG2.2.15细胞由第三军医大学西南医院感染病研究所引进并保存, HBV PCR荧光定量检测试剂盒由上海克隆生物高技术有限公司生产. 用PCA(protein fragment complementation assay, PCA)方法选择HBV多聚酶TP区VH抗体[2], 共选择出3个抗体[3], 把带有3个抗体的大肠杆菌菌株BL21(DE3)pLysS分别接种于含有10、100、1 000、10 000 mg/L TMP浓度的M9选择培养基, 只有含有VH1的大肠杆菌能在最高浓度的TMP中存活, 故认为VH1抗体与抗原的亲和力最高.
把用PCA方法选择出的细菌阳性克隆抽提质粒, 进行PCR扩增VH1.P1:5'-TACCGAGCTCGGATCCATGC AGGTGCAGCTGCAG-3', P2:5'-CTGGACTAGTGGATCCTCATGA AGAGACGGTGAC-3', PCR反应条件:95 ℃ 5 min, 95 ℃ 30 s, 58 ℃ 45 s, 75 ℃ 45 s循环35次, 75 ℃ 10 min. 用BD In-FusionTM PCR Cloning Kit把VH抗体基因插入真核表达载体pZeoSV2(+)(酶切位点为BamHI), 即pZeoSV2(+)-VH, 并进行测序验证. 制备脂质体转染用DNA: 转染用质粒pZeoSV2(+)-VH进行去内毒素处理并测得其浓度为718.83 mg/L.HepG2.2.15细胞的培养HepG2.2.15细胞在含100 mL/L胎牛血清的RPMI1640培养基中(含青霉素100 kU/L, 链霉素100 kU/L), 37 ℃, 体积分数为50 mL/L CO2的孵箱中用24孔培养板培养. 实验分3组, A组:HepG2.2.15细胞单纯培养;B组:pZeoSV2(+)转染HepG2.2.15细胞;C组:pZeoSV2(+)-VH转染HepG2.2.15细胞. 待细胞生长融合达90%后转染, 按试剂盒手册进行操作. 收集细胞培养液, 加入PEG8000至终浓度为100 g/L, 冰浴放置4 h, 12 000 g离心30 min, 将沉淀溶解于原培养液体积1%的TNE缓冲液中(10 mmol/L Tris-HCl, pH7.5;100 mmol/L NaCl;1 mmol/L EDTA). 加入SDS至终浓度为10 g/L, 蛋白酶K至终浓度为1 g/L, 50 ℃孵育2 h. 经酚-氯仿抽提, 乙醇沉淀, 将DNA溶解于TE缓冲液中(10 mmol/L Tris-HCl, pH8.0;1 mmol/L EDTA)[4]. 再用HBV PCR荧光定量检测试剂盒检测HBV DNA含量: 在PCR反应管中加入反应液和样本DNA共26 mL, 各反应管放入LightCycler PCR自动荧光检测仪;PCR扩增:50 ℃反应1 min, 94 ℃保温2 min, 再93 ℃→60 ℃ 30 s循环40次. 由计算机软件自动分析计算出定量结果, 采用对数平均值的方法计算HBV DNA平均拷贝数.
统计学处理 实验数据以mean±SD表示, 率的显著性差异分析采用SPSS12.0软件.
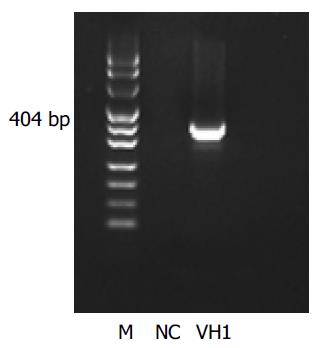
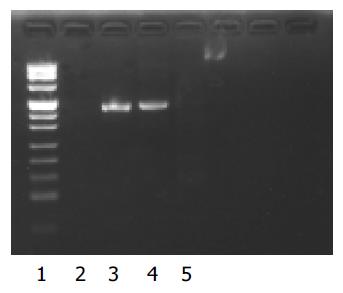
在抗体库中共选择出3个TP区相关抗体, 根据DNA序列和Werner Mler数据库(http://www.dnaplot.de/input/human-v.html)标明了3个抗体. PCR扩增VH1(约404 bp)(图1). 在空白质粒pZeoSV2(+)的基础上, 经酶切位点BamHI构建重组质粒, 测序分析(图2)表明质粒插入序列VH与设计相符. 各组培养细胞裂解产物作为模版, PCR扩增VH1抗体(图3). 只有C组可扩增出VH1抗体, 与阳性对照(重组质粒pZeoSV2(+)-VH)的扩增片段相同. 而B组为阴性结果. HepG2.2.15培养细胞转染质粒pZeoSV2(+)-VH前后的光镜图片(图4A, B). 通过对各组培养细胞内HBV DNA含量的测定, 转染空白质粒组即B组对HepG2.2.15细胞无明显抑制HBV颗粒分泌的作用, 而转染VH抗体质粒组即C组对HepG2.2.15细胞却有明显抑制HBV颗粒分泌的作用(表1).
HepG2.2.15细胞是一种整和ayw型HBV全基因组, 并且可以表达HBV各产物、分泌HBV颗粒的肝癌细胞株, 他模拟了HBV感染和其基因组已整和到宿主细胞基因组中的状态, 因此用他进行抗病毒的研究比较接近于疾病的治疗过程. 人们试图通过多种努力来阻止HBV的复制. 现在的焦点之一是集中于能够干预病毒的复制周期而不影响宿主细胞的代谢功能. HBV多聚酶就是一个重要的靶蛋白, 他是一个多功能酶[5], 在病毒的复制周期中发挥着关键作用. 末端蛋白(TP)作为HBV多聚酶的组成部分, 具有多种功能, 主要是由前基因组RNA反转录负链DNA时作为引物;HBV多聚酶虽然在胞质中合成, 其全部或其裂解形成的TP区可移行至胞核内, 以完成反转录中的功能[6]. 所以抑制或中和TP区功能可以有效地抑制HBV复制. 重链可变区抗体(VH)可在原核细胞或真核细胞内表达, 我们的实验已证明他们有很强的中和抗原的作用, 从而可以对HepG2.2.15细胞有明显抑制HBV颗粒分泌的作用. 细胞内抗体通常指的是scFv(single chain variable fragments, scFv), 但scFv几乎不能在细胞内发挥作用. 因为scFv在细胞内质网成熟, 而细胞内的还原环境使scFv不能形成二硫键, 这对抗体的正确折叠至关重要, 从而影响scFv的可溶性与稳定性. 而VH抗体不存在这样的缺陷[7], VH抗体不需要链内二硫键也同样具有活性. 重链可变区抗体(VH)可在原核细胞或真核细胞内表达, 已证明他们有很强的中和抗原的作用[8], 如在抗肿瘤蛋白RAS的3种抗体中:scFv, VH和VL(轻链可变区抗体), VH的活性是scFv的5倍, 而VL实验证明无活性. 还有一点, 在选择特异性抗体中, VH抗体库的多样性要比scFv抗体库的多样性小的多.
HBV多聚酶TP区由177个氨基酸组成, 据报道有多个抗原决定簇. 在我们的研究中用PCA方法选择出了具有特定功能的3个抗体, 至于每一个抗体对应的抗原决定簇还需要进一步的实验验证. 已证明对HBV复制有抑制作用的有干扰素、RNA干扰等, 为了进一步证明抗HBV多聚酶TP区VH抗体抑制HBV复制的作用, 我们正在对以上生物制剂进行平行对比, 以及特异性VH抗体的体外表达, 有关实验数据待发表.
编辑: 潘伯荣 审读:张海宁
| 1. | Wright TL, Lau JY. Clinical aspects of hepatitis B virus infection. Lancet. 1993;342:1340-1344. [PubMed] [DOI] |
| 2. | Pelletier JN, Arndt KM, Pluckthun A, Michnick SW. An in vivo library-verse-library selection of optimized protein-protein interactions. Nat Biotechnol. 1999;17:683-690. [PubMed] [DOI] |
| 4. | Feng Y, Kong YY, Wang Y, Qi GR. Intracellular inhibition of the replication of hepatitisB virus by hamnerhead ribozymes. J Gastroenterol Hepatol. 2001;16:1125-1130. [PubMed] [DOI] |
| 5. | zu Putlitz J, Lanford RE, Carlson RI, Notvall L, de la Monte SM, Wands JR. Properties of monoclonal antibodies directed against hepatitis B virus polymerase protein. J Virol. 1999;73:4188-4196. [PubMed] |
| 6. | Bartenschlager R, Junker-Niepmann M, Schaller H. The P gene product of hepatitis B virus is required as a structural component for genomic RNA encapsidation. J Virol. 1990;64:5324-5332. [PubMed] |
| 7. | Holt LJ, Herring C, Jespers LS, Wodven BP, Tomlinson IM. Domain antibodies: proteins for therapy. Trends Biotechnol. 2003;21:484-490. [PubMed] [DOI] |