修回日期: 2005-04-22
接受日期: 2005-04-27
在线出版日期: 2005-07-28
目的: 探讨转化生长因子β1(TGF-β1)、转化生长因子β1Ⅱ型受体(TGF-β1RⅡ)、核转录因子-kB(NF-κB)在肝细胞癌(HCC)中表达.
方法: 在30例肝癌组织和癌旁肝组织中, 用免疫组化技术, 分别检测TGF-β1 TGF-β1RⅡ及NF-κB蛋白的表达; 用原位杂交方法检测TGF-β1mRNA的表达, 以CD34标记血管内皮细胞, 观察TGF-β1及TGF-β1RⅡ蛋白与微血管密度(MVD)、TGF-β1蛋白与TGF-β1mRNA、NF-κB与TGF-β1的关系.
结果: 肝癌组织TGF-β1mRNA平均光密度明显高于癌旁组织(0.1043±0.035 vs 0.0620±0.0225, P<0.01)、TGF-β1蛋白平均光密度表达明显高于癌旁组织(0.0725±0.0102 vs 0.0442±0.0103, P<0.01); 肝癌组织TGF-β1RⅡ蛋白平均光密度表达明显低于癌旁组织(0.0402±0.0113 vs 0.0669±0.0157, P<0.01); 肝癌组织NF-κB蛋白表达均明显高于癌旁组织(0.0723±0.0210 vs 0.0305±0.0116, P<0.01), 肝癌组织MVD明显高于癌旁组织(31.23±9.25 vs 4.24±2.10,P<0.01), 肝癌组织TGF-β1蛋白阳性表达与MVD呈正相关(t = 3.25, P<0.01);TGF-β1 mRNA与TGF-β1 蛋白呈正相关(χ2 = 8.21, P<0.01);NF-κB蛋白阳性表达与TGF-β1蛋白阳性表达呈正相关(χ2 = 9.075, P<0.01); 而TGF-βRⅡ蛋白与MVD呈负相关.
结论: 肝癌组织中TGF-β1基因的变化发生在多个水平, 肝癌细胞中TGF-β1RⅡ、NF-κB蛋白表达异常, 并与MVD相关, 提示他们在肝细胞癌血管形成中发挥重要作用, NF-κB可能在介导TGF-β1的活化或产生中发挥一定的作用.
引文著录: 缪林, 张锁林, 季国忠, 范志宁, 刘政, 张平, 杨春. 肝癌组织中TGF-β1、TGF-β1RⅡ和NF-κB的表达. 世界华人消化杂志 2005; 13(14): 1663-1666
Revised: April 22, 2005
Accepted: April 27, 2005
Published online: July 28, 2005
AIM: To explore the expression of TGF-β1, TGF-β1RII and NF-κB in hepatocellular carcinoma (HCC) tiussues.
METHODS: Immunohistochemistry was used to detect the expression of TGF-β1, TGF-βRII and NF-κB protein in 30 HCC and the corresponding cancer-adjacent tissues. The expression of TGF-β1 mRNA was determined in 30 HCC and the corresponding cancer-adjacent tissues by in situ hybridization. Vascular endothelial cells were labeled with CD34 to observe the microvessel density (MVD). Then the relationships between TGF-β1 protein and MVD, TGF-β1RII protein and MVD, NF-κB and TGF-β1 protein as well as between TGF-β1 protein and mRNA were analyzed.
RESULTS: The expression of TGF-β1 protein and mRNA in HCC tissues were significantly higher than those in the cancer-adjacent tissues (Mean optical density: 0.0725±0.0102 vs 0.0442±0.0103, P < 0.01; 0.1043±0.0350 vs 0.0620±0.0225,P < 0.01). The MVD in HCC tissues was also markedly higher than that in the cancer-adjacent tissues (31.23±9.25 vs4.24±2.10, P < 0.01). The level of NF-κB expression was significantly higher than that in the cancer-adjacent tissues (0.0723±0.0210 vs 0.0305±0.0116, P < 0.01), while the level of TGF-βRII was lower (0.0402±0.0113 vs 0.0669±0.0157, P < 0.01). Obviously positive relationships existed between TGF-β1 protein and MVD (t = 3.25, P < 0.01), TGF-β1 mRNA and TGF-β1 protein (χ2 = 8.21, P < 0.01) as well as between NF-κB and TGF-β1 protein (χ2 = 9.075, P < 0.01), but the expression of TGF-β RIIprotein was negatively related to MVD.
CONCLUSION: TGF-β1, TGF-β1RII and NF-κB protein is abnormally expressed in HCC tissues and they are significantly related to MVD. They may play important roles in the angiogenesis of hepatocellular carcinoma. NF-κB may mediate the activation and production of TGF-β1.
- Citation: Miao L, Zhang SL, Ji GZ, Fan ZN, Liu Z, Zhang P, Yang C. Expression of TGF- b1, TGF-β1RII and NF-k B in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(14): 1663-1666
- URL: https://www.wjgnet.com/1009-3079/full/v13/i14/1663.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i14.1663
转化生长因子-β1(transforming growth factor β1, TGF-β1)是TGF-β超家族的主要成员, 能抑制肝细胞、内皮细胞、上皮细胞的增生, 诱导细胞外基质的形成[1-3]. 其受体有3种, 即TGF-βRI、TGF-βRII、TGF-βRIII. 研究表明他们在多种肿瘤中存在异常[4-6]. 转化生长因子的合成是由核转录因子(如NF-κB)来调控的. 有关其在肝细胞癌中表达情况目前报道不多. 我们研究TGF-β1及TGF-β RII、NF-κB在肝癌组织的表达, 并研究其与微血管密度(MVD)的关系; 同时研究NF-κB蛋白与TGF-β1蛋白阳性表达之间的关系.
原发性肝细胞癌标本30例, 来自本院病理科存档石蜡包埋标本, 蜡块连续切片, 厚度为4 mm, CD34抗体为即用型, 购自北京中山生物技术有限公司. TGF-β1、TGF-β1RII、NF-κB抗体(浓缩型)为Santa Cruz公司产品(北京中山生物技术有限公司).
TGF-β1、TGF-β1RII、NF-κB蛋白表达及MVD的测定: 采用链霉素亲生物素-过氧化物酶法(SP法).MVD采用CD34抗体标记法, 稀释滴度均为1:100. 步骤如下: 石蜡切片常规二甲苯脱蜡至水; 3% H2O2室温孵育10 min, 以消除内源性过氧化物酶活性;PBS冲洗; 分别滴加CD34抗体、TGF-β1抗体、TGF-β1RII抗体、NF-κB抗体(一抗), 室温下过夜; PBS冲洗; 滴加生物素标记的二抗, 37 ℃孵育30 min; PBS冲洗; 滴加辣根酶标记链霉卵白素, 37 ℃孵育30 min; PBS冲洗; DAB显色, 封片观察. 对30例原发性肝细胞癌及癌周标本进行原位杂交染色. 试剂盒购自武汉博士德生物工程有限公司, 按试剂盒说明书操作. 免疫组化以细胞核或胞质着色棕黄色颗粒为阳性细胞, 原位杂交以细胞核或胞质着色紫兰色颗粒为阳性细胞. CD34染色深褐色条索状细胞簇为微血管.
微血管密度(MVD)按Weidner方法进行[7]:CD34抗原染色后, 在低倍镜下(×100)找出微血管最密集区, 再在高倍镜下(×400)计算5个视野被染成棕色的血管数目, 取其平均值作为微血管密度. TGF-β1、TGF-β1RII、NF-κB免疫组织化学结果: 全部切片在显微镜下观察, 阳性判断标准为: 上皮细胞或癌细胞胞核或胞质染色呈棕黄色或棕褐色颗粒, 阴性: 胞核或胞质不着色. 对所有TGF-β1、TGF-β1RII、NF-κB蛋白阳性切片进行图像分析, 每张切片放大200倍, 随机选取5个视野, 测量窗面积为430 205 mm2, 分别测量阳性细胞面积比(Na%)(阳性反应面积/测量窗面积)和阳性细胞平均吸光度(A). 对所有TGF-β1mRNA阳性切片进行图像分析, 方法同免疫组化. 资料分析采用瑞医RY2000病理图文分析系统.
统计学处理 采用t检验和χ2检验.
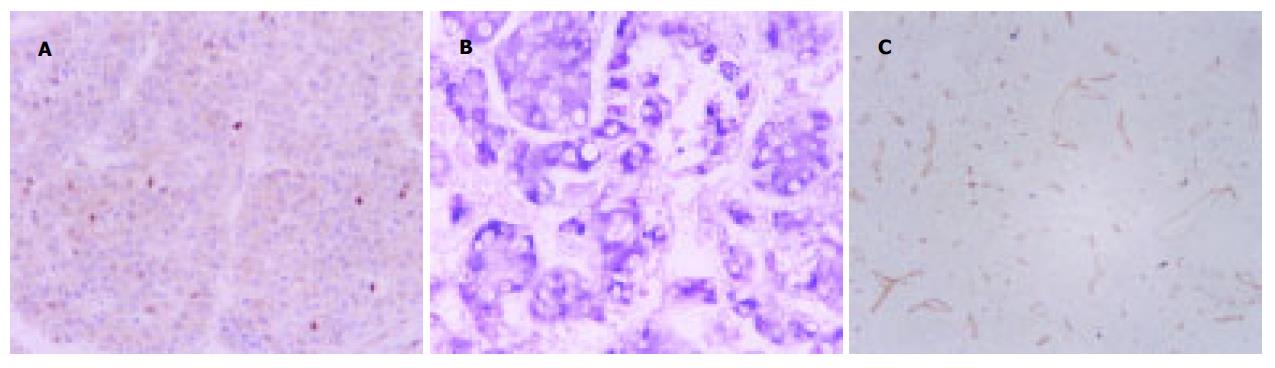
肝癌组织TGF-β1蛋白明显高于癌旁组织, 经统计学处理二者差异均有显著性(P<0.01); 肝癌组织TGF-β1RII蛋白明显低于癌旁组织, 经统计学处理二者差异均有显著性(P<0.01)(表1, 图1A).
30例原发性肝细胞癌及癌周标本TGF-β1 mRNA阳性例数分别为17例和15例, 肝癌组织TGF-β1 mRNA明显高于癌旁组织, 肝癌组织中NF-κB蛋白明显高于癌旁组织, 肝癌组织中微血管密度明显高于癌旁组织, 统计学处理二者差异均有极显著性(表2, 图1B-C).
肝癌组织TGF-β1蛋白阳性表达组微血管密度明显高于TGF-β1蛋白阴性表达组, 统计学处理二者差异有显著性(P<0.01)(表3); 肝癌组织TGF-β1蛋白、TGF-β1 mRNA表达均阳性者占50.0%(15/30), TGF-β1蛋白、TGF-β1 mRNA表达均阴性者占26.7%(8/30), 二者表达一致率达76.7%(23/30), 统计学处理二者呈显著相关(χ2 =8.21, P<0.01); 肝癌组织TGF-β1蛋白、NF-κB蛋白表达均阳性者占56.7%(17/30), TGF-β1蛋白、NF-κB蛋白表达均阴性者占23.3%(7/30), 二者表达一致率达80.0%(24/30), 统计学处理二者呈显著相关(χ2 = 9.075, P<0.01)(表4).
| n | 微血管密度(MVD) | ||
| TGF-β1蛋白 | + | 20 | 35.65±12.87 |
| + | 10 | 25.12±4.68 |
| TGF-β1 mRNA | NF-κB蛋白 | ||||||
| + | - | 合计 | + | - | 合计 | ||
| TGF-β1蛋白 | + | 15 | 5 | 20 | 17 | 3 | 20 |
| - | 2 | 8 | 10 | 3 | 7 | 10 | |
| 合计 | 17 | 13 | 30 | 20 | 10 | 30 | |
肿瘤的生长、侵袭及转移依赖于血管生成, 肿瘤不仅通过肿瘤血管获得丰富的营养物质, 而且还通过肿瘤血管向外输出肿瘤细胞, 导致肿瘤不断生长和转移. 肿瘤的微血管密度是反映肿瘤血管生成的有效指标, 在活体, Chen et al[8]报道可采用动态螺旋CT增强扫描来反映肝癌微血管密度. 在离体标本中, 目前常采用标记血管内皮的方法来检测肿瘤的微血管密度, 而CD34和VIII因子是常采用的标记方法. 而CD34和VIII因子是常采用的标记方法. Poon et al[9]报道肝癌组织中MVD明显高于癌旁组织, 且肝癌组织中MVD与肝癌预后相关, MVD高, 预后差. 本研究结果同样显示, 肝癌组织中MVD明显高于癌旁组织, 进一步说明了肿瘤血管生成在肿瘤发生发展中的重要作用. TGF-β是细胞生长、分化重要调控因子, 其有5个亚型:TGF-β1-5, 在哺乳动物只有TGF-β1, 2, 3, 三者的生物学作用相似, 序列同源性70-80%, 其中TGF-β1含量最高, 有代表性. TGF-β受体有3种, 即TGF-βRI、TGF-βRII、TGF-βRIII. 他们相对分子质量分别为65×103, 85-110×103和6×105. 起信号转导作用的是Ⅰ型和Ⅱ型受体.Ⅰ、Ⅱ型受体都是单次跨膜的丝氨酸/苏氨酸蛋白激酶受体. 胞膜外区较短, 胞质区较长. 胞膜外区富含半胱氨酸. 胞质区含有丝氨酸/苏氨酸蛋白激酶结构域, 具有丝氨酸/苏氨酸蛋白激酶的活性. 与Ⅱ型受体相比, Ⅰ型受体的胞外区和胞质区均较短. TGF-β1首先与TGF-βRII结合形成二聚体, 而后TGF-βRI加入形成三聚体, 参与信号转导. TGF-β1对肝细胞增殖具有强烈的抑制作用. 例如在肝大部切除肝再生后期, 正是由于肝组织中TGF-β1的大量表达, 才导致肝再生的自然终止. 另外, TGF-β1在很低浓度(<20 pmol/L = 即可诱导肝细胞凋亡[10], Kim et al[11]亦同样证实TGF-β1诱导肝细胞凋亡. 因此, TGF-β1对肝细胞的生长调控至关重要. Bedossa et al[12]研究发现, 肝癌组织表达TGF-β1, 正常肝脏、肝硬化不表达TGF-β1; 正常肝细胞膜周可表达TGF-β1RII, 而肝癌组织细胞膜周不表达TGF-β1RII, 但部分肝癌细胞核周可见到TGF-β1RII聚集. 本研究结果显示, 在肝癌组织中TGF-β1表达增强, TGF-β1RII表达减弱, 而癌旁组织相反. 说明二者在肝癌发生中起重要作用. TGF-β1能抑制血管增殖, 促进肝细胞凋亡, 但由于肝癌组织TGF-βRII表达减弱, 使肝癌细胞逃逸了TGF-β1的抑制作用[13], 从而导致了肝癌的发生发展. 本研究结果还显示, 肝癌组织中TGF-β1 mRNA存在异常, 说明肝癌组织中TGF-β1基因存在多个水平异常. 且TGF-β1蛋白与TGF-β1 mRNA呈正相关, 由于蛋白表达的检测简单易行, 而原位杂交条件要求较高, 因此前者更适合广大医务工作者开展.
TGF-β1的合成受核转录因子的调控, 目前发现的核转录因子主要有NF-κB、AP-1等. NF-κB是1986年Sen和Baltimore应用凝胶电泳迁移率实验研究发现的B细胞核提取物中存在的一种能与免疫球蛋白k轻链基因的增强子kB序列特异性结合的蛋白质因子, 他是由p65和p50组成的二聚体. 正常情况下他存在于胞质, 当受到刺激后, NF-κB的抑制因子IkB从NF-κB复合体上脱落, 活化的NF-κB进入细胞核促进靶基因转录. 由于TGF-β1活化因子组织转谷氨酰氨酶(tissue transglutaminase, tTG)基因的启动子中含有NF-κB的结合位点, 因而NF-κB能促进TGF-β1表达. 本研究结果证实NF-κB表达与TGF-β1表达呈正相关. 总之, 肝癌组织中TGF-β1基因的变化发生在多个水平, 肝癌细胞中TGF-β1、TGF-β1RⅡ、NF-κB蛋白表达异常, 并与MVD相关, 提示他们在肝细胞癌血管形成中可能发挥重要作用, NF-κB可能在介导TGF-β1的活化或产生中发挥一定的作用.
编辑: 潘伯荣 审读:张海宁
| 1. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-807. [PubMed] [DOI] |
| 2. | Dennler S, Goumans MJ, ten Dijke P. Transforming growth factor beta signal transduction. J Leukoc Biol. 2002;71:731-740. [PubMed] |
| 3. | Zimmerman CM, Padgett RW. Transforming growth factor beta signaling mediators and modulators. Gene. 2000;249:17-30. [PubMed] [DOI] |
| 6. | Woszczyk D, Gola J, Jurzak M, Mazurek U, Mykala-Ciesla J, Wilczok T. Expression of TGF beta1 genes and their receptor types I, II, and III in low-and high-grade malignancy non-Hodgkin's lymphomas. Med Sci Monit. 2004;10:CR33-37. [PubMed] |
| 7. | Weidner N. Intratumor microvessel density as a prognostic factor in cancer. Am J Pathol. 1995;147:9-19. [PubMed] |
| 8. | Chen WX, Min PQ, Song B, Xiao BL, Liu Y, Ge YH. Single-level dynamic spiral CT of hepatocellular carcinoma: Correlation between imaging features and density of tumor microvessels. World J Gastroenterol. 2004;10:67-72. [PubMed] |
| 9. | Poon RT, Ng IO, Lau C, Yu WC, Yang ZF, Fan ST, Wong J. Tumor microvessel density as a predictor of recurrence after resection of hepatocellular carcinoma: a prospective study. J Clin Oncol. 2002;20:1775-1785. [PubMed] [DOI] |
| 10. | Lin JK, Chou CK. In vitro apoptosis in the human hepatoma cell line induced by transforming growth factor beta 1. Cancer Res. 1992;52:385-388. [PubMed] |
| 11. | Kim BC, Mamura M, Choi KS, Calabretta B, Kim SJ. Transforming growth factor beta 1 induces apoptosis through cleavage of BAD in a Smad3-dependent mechanism in FaO hepatoma cells. Mol Cell Biol. 2002;22:1369-1378. [PubMed] [DOI] |
| 12. | Bedossa P, Peltier E, Terris B, Franco D, Poynard T. Transforming growth factor-beta 1 (TGF-beta 1) and TGF-beta 1 receptors in normal, cirrhotic, and neoplastic human livers. Hepatology. 1995;21:760-766. [PubMed] |
| 13. | Ueno T, Hashimoto O, Kimura R, Torimura T, Kawaguchi T, Nakamura T, Sakata R, Koga H, Sata M. Relation of type II transforming growth factor-beta receptor to hepatic fibrosis and hepatocellular carcinoma. Int J Oncol. 2001;18:49-55. [PubMed] [DOI] |