修回日期: 2005-04-20
接受日期: 2005-05-14
在线出版日期: 2005-07-15
目的: 研究胃肠因素对成人乳糖酶缺乏者出现不同程度乳糖不耐受症状的作用.
方法: 乳糖酶缺乏者(呼气H2浓度>20 μmol/mol)43例, 根据乳糖不耐受症状评分结果分为乳糖吸收不良(lactose malabsorption, LM)组和乳糖不耐受(lactose intolerance, LI)组; LI组根据有无腹泻症状又分为轻度(LIa)及重度(LIb)乳糖不耐受组.采用双标记稳定同位素13C-乳糖/2H-葡萄糖负荷试验计算受试者的乳糖消化指数、乳糖消化量和胃排空时间, 并采用H2呼气试验分析受试者摄入一定量乳糖之后的口-结肠转运时间、累积H2呼出量.
方法: LM组的乳糖消化指数和乳糖消化量(0.47±0.15和11.8±3.9 g)显著高于LI组(0.34±0.14和8.5±3.5 g)(P = 0.008), 胃排空时间和口-结肠转运时间(44.0±14.4 min 和105 min, 60-120 min)显著长于LI组(33.9±12.2 min和60 min, 30-90 min)(P = 0.021和P = 0.003); 乳糖消化指数与口-结肠转运时间之间呈显著正相关(r = 0.30, P = 0.048).而LIa组和LIb组之间以上各项指标均无显著性差异.
结论: 乳糖消化能力(主要受乳糖酶活性决定)、胃排空时间和口-结肠转运时间是引起乳糖酶缺乏者出现LI症状的主要原因, 但不是引起不同严重程度LI症状产生的主要原因, 这种症状差异的产生可能与其他因素, 如结肠代谢因素的作用有关.
引文著录: 钟燕, 黄承钰, 阴文娅. 胃肠因素对成人乳糖不耐受的作用. 世界华人消化杂志 2005; 13(13): 1618-1620
Revised: April 20, 2005
Accepted: May 14, 2005
Published online: July 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1618-1620
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1618.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1618
原发性乳糖酶缺乏(primary lactose deficiency, LD)在世界范围内普遍存在, 与人类健康密切相关.根据LD者摄入乳糖之后是否出现腹部不适症状, 又可分为乳糖不耐受(lactose intolerance, LI)和乳糖吸收不良(lactose malabsorption, LM)两种情况.我国LD和LI的发生率分为75-95%和85%左右, 成为限制人们摄入乳制品的一个重要因素[1].
流行病学显示, 大多数LD者可以耐受一定量的乳糖, 如摄入5-10 g乳糖不会发生不耐受症状.不同个体对乳糖的耐受能力不完全相同, 在同样条件下摄入等量乳糖后是否出现LI症状及其严重程度有很大差异[2-3].长期以来, 由于受研究方法的限制, 人们对LI发生的相关影响因素研究很难深入.本研究采用本课题组新近发展的双标记稳定同位素13C-乳糖/2H-葡萄糖负荷试验技术, 从小肠黏膜乳糖酶活性、乳糖吸收量、胃肠转运时间等方面对可能影响LI症状产生的胃肠道因素进行研究.
乳糖酶缺乏者(口服25 g乳糖之后呼气H2浓度值与空腹基础浓度值之差△H2 >20 μmol/mol)43例, 男21例, 女22例, 22-56岁.实验前3 d开始禁止食用富含13C-乳糖的食物, 如蔗糖、玉米、菠萝及其制品.乳糖负荷试验前1 d晚餐集中进食, 避免食用牛奶及其制品、豆制品、葱、蒜及其他富含膳食纤维的食物; 试验前至少禁食12 h, 试验开始后2 h内不能进食、饮水, 2 h后可以饮水.H2呼气仪(type 60 HP, 德国, 试验前调零并用96 μmol/mol标准H2校正); 气相色谱/质谱联用仪(Finnigan MAT, Finnigan SSQ7000, 德国); HP5980气相色谱仪(HP, 美国); 气相色谱/燃烧/同位素比质谱联用仪(IRMS, Finnigan MAT, 德国); γ-放免计数仪(ERIA Diagnostics Pasteur, 法国); 高速离心机(Eppendorf, 德国).13C-乳糖(荷兰乳制品研究所提供, 荷兰); 6, 6-2H-葡萄糖(Isotec公司, 美国); 静脉留置针(Becton Dickinson GMBH, 德国); H2收集管(BD公司, 德国); 胰岛素放免分析试剂盒(LINCO Research 公司, 美国); 96 μmol/mol标准H2(成都科分院化学所).
1.2.1 13C-乳糖/2H-葡萄糖负荷试验: 实验日清晨, 于受试者肘前静脉处插入留置针, 在给予受试底物13C-乳糖和2H-葡萄糖之前15 min抽取2 mL静脉血, 作为空白基础值.将25 g 13C-乳糖和0.5 g 6, 6-2H-葡萄糖溶于250 mL温水中, 让受试者在2 min内饮完, 在摄入底物后的2 h内每15 min通过留置针抽取2 mL静脉血, 用肝素抗凝, 置于真空血样收集管中, 并立即冰浴降温, 900 r/min离心10 min, 取血浆置于塑料离心管, -80℃保存至分析.
1.2.2 呼气的收集及H2浓度测定: 在摄入受试底物之前, 先测定呼气H2浓度2次, 取平均值作为H2浓度基础值.H2的收集和测定持续6 h, 在摄入底物后的头4 h内每15 min收集1次气体, 后2 h每30 min收集1次.要求受试者缓慢呼气, 收集末段1/3呼出气, 然后立即用H2呼气仪测定浓度; H2浓度实测值减去H2浓度基础值为各时间点H2浓度值.
1.2.3 问卷调查及症状评分: 记录受试者摄入乳糖后12 h内出现的腹部不适症状及其严重程度, 同时记录受试者的健康史、饮奶史和一般状况(年龄、身高、体重等).LI症状分腹胀、腹痛、腹泻, 其评分系数分别为2、3、4; 症状严重程度分类如下: (1)腹胀、腹痛: 0无症状, 1轻度不适, 2中度不适, 3重度不适; (2)腹泻: 0大便正常、成形, 1疏松软便, 2水样便.症状评分(SSC)为各症状评分系数与其严重程度乘积之和.
1.2.4 对象分组: 根据记录症状评分结果将实验对象分为LM组(SSC = 0)15例, 轻度LI组(有乳糖不耐受症状但无腹泻, LIa组)17例, 以及重度LI组(有腹泻症状, LIb组)11例.
1.2.5 血浆13C-葡萄糖/2H-葡萄糖分析: 采用气相色谱/同位素比质谱法分析各时间点血浆 13C-葡萄糖和2H-葡萄糖浓度[4].
1.2.6 指标计算: (1)乳糖消化指数(lactose digestion index, LDI): 计算各时间(13C-葡萄糖)/(2H-葡萄糖)吸收百分率的比值, 以45 min、60 min、75 min这3个时间点所得比值的均值作为LDI[4].(2)乳糖消化量: 以13C-乳糖的摄入总量25 g乘以个体的LDI即为乳糖消化量.(3)6 h累积H2呼出量(BHE): 某时间点的累积H2呼出量 = Σ[(某时间点H2浓度值/2+上一时间点H2浓度值/2)×两次测量时间间隔(min)/60].(4)口-结肠转运时间(OCTT): 从摄入受试底物结束到呼气H2浓度值持续超过空腹基础值5 μmol/mol的时间点作为OCTT时间[5].(5)胃排空时间(GET): 从摄入受试底物结束到血浆2H-葡萄糖浓度达到峰值的时间.
统计学处理 实验数据采用SPSS 10.0软件进行方差分析和相关分析.OCTT结果数据不符合正态分布, 因此采用秩合检验.
LM组的LDI和乳糖消化量显著高于LI组(P = 0.008); LM组的OCTT(P = 0.003)和GET(P = 0.021)显著长于LI组; LM组与LI组之间的6 h BHE没有显著性差异; LM组的平均年龄(23.0±0.5)显著低于LI组(30.0±10.0)(P = 0.001)(表1).
LIa组和LIb组之间的LDI、乳糖消化量、OCTT、GET、6 h BHE以及年龄均无显著性差异(表2).
| n | LDI | 乳糖消化量(g) | OCTT(min)1 | GET(min) | BHE(μmol/mol) | |
| LIa组 | 17 | 0.30±0.14 | 7.5±3.5 | 60(30-90) | 35.6±13.3 | 358±225 |
| LIb组 | 11 | 0.39±0.15 | 9.8±3.8 | 60(26-83) | 28.6±8.09 | 357±140 |
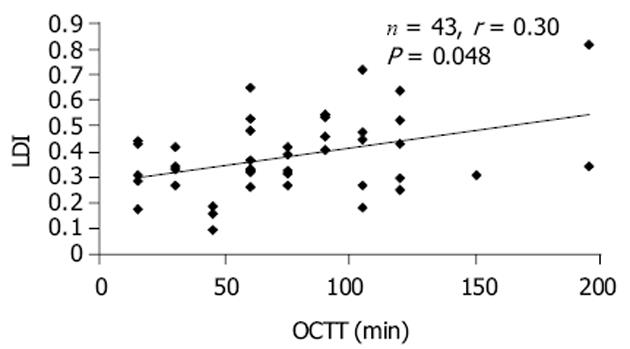
2.3 LDI与OCTT、GET以及6 h BHE之间的相关性分析 LDI与OCTT之间有显著性正相关关系(r = 0.30, P = 0.048)(图1), 未发现LDI与GET(r = -0.24, P = 0.12)、LDI与6 h BHE(r = 0.12, P = 0.46)之间有显著性相关关系.
本研究所选的43例研究对象均为具有相同基因背景的LD个体, 在摄入25 g乳糖之后, 15例(34.9%)可以耐受25 g乳糖(约相当于500 g牛奶中所含乳糖)而没有出现LI症状; 28例(65.1%)出现了程度不同的LI症状, 其中17例(39.5%)无腹泻症状, 另外11例(25.6%)有腹泻症状.该结果说明LD个体对乳糖的耐受性不同, 其中74.4%的个体在摄入25 g乳糖后不会出现严重症状, 与其他一些学者的研究结论一致[6-7].
通过对LDI和乳糖消化量的分析结果显示, LM和LI组个体的小肠黏膜都有一定量乳糖酶残留, 可以消化部分乳糖; 但两组之间在酶活性和乳糖消化能力上存在差异, LM组对象的LDI和乳糖消化量均显著高于LI组(P = 0.008).
(1)GET: GET加快会导致单位时间内进入小肠的乳糖量增多, 从而增加小肠的负荷, 并可能引起LI症状.目前常用的GET分析方法有13C-氨基乙酸(或乙酸)呼气试验, 13CO2呼气试验等, 但这些方法均比较复杂.本研究以摄入25 g 13C-乳糖和0.5 g 2H-葡萄糖之后血浆2H-葡萄糖浓度达到峰值时间作为判断GET的标准, 因为2H-葡萄糖从胃进入小肠之后不需经过消化就可以直接被吸收入血, 因此血浆浓度升高时间可以反映其从胃进入小肠的时间.本研究结果显示LM组的GET显著长于LI组(P = 0.021), 说明延长GET在一定程度上有助于改善LI症状.(2)口-结肠转运时间: 乳糖在小肠内的消化程度主要由小肠黏膜乳糖酶活性和OCTT所决定[8-9].延长OCTT可以增加乳糖与小肠内乳糖酶的接触时间, 从而有助于发挥有限的乳糖酶的消化作用.采用H2呼气试验检测OCTT的原理: 当未被小肠消化的乳糖进入结肠后, 在结肠菌群作用下发酵产生的H2通过肺呼出, 因此呼气H2浓度升高的时间可以用来代表乳糖通过小肠进入结肠的时间.本研究结果显示OCTT与LDI之间有显著性正相关关系(P = 0.048), 说明延长OCTT有改善乳糖消化的作用.导致LI组的OCTT显著快于LM组的原因不明确, 其中一个原因可能是未被消化的乳糖引起肠腔渗透压增高, 促进肠蠕动和OCTT加快的原因.以几种非消化性寡糖为底物进行试验发现吸收不良可以加速肠转运[10-11].但另一方面, LM组与LI组之间未被吸收的乳糖量相差仅有3 g左右, 从理论上讲3 g左右的差异似乎不会引起肠腔渗透压发生很大的改变, 不应该造成肠转运时间出现大的差别, 因此是否由于乳糖消化量不同引起组间肠转运的差异尚不能肯定, 还值得进一步研究.(3)结肠H2产生量: H2呼出量常被用来反映乳糖消化程度[12], 但是作为定量测量乳糖酶活性的指标尚存在争议[13].本研究中LM组的乳糖消化量高于LI组(P = 0.008), 6 h BHE低于后者但无显著性差异(P>0.05), 提示结肠产H2量少与LI症状的产生有关, 有利于避免由于产气过多引起的腹胀和排气增多症状.
通过对LIa和LIb组的胃肠指标分析, 显示两组之间的LDI、乳糖消化量、GET、OCTT和6 h BHE均没有显著性差异, 提示以上胃和小肠因素可能不是引起LIa组与LIb组出现不同严重程度LI症状的原因, 而可能与其他因素有关, 如结肠菌群对乳糖的代谢水平.Clausen et al[14]的研究结果也显示, 给予实验对象一定量乳果糖之后, 只有部分个体而非全部个体出现腹泻症状; 而且如果LI个体持续摄入一段时间乳糖之后, LI症状往往会减轻, 因为我们知道小肠乳糖酶活性是不可被诱导的[15], 因此这种适应性的产生也可能与结肠代谢因素的作用有关[16].
以上研究结果充分表明, 小肠黏膜乳糖酶活性、乳糖在小肠内被消化吸收程度、胃排空时间、肠转运时间等胃和小肠因素是乳糖酶缺乏者是否产生乳糖不耐受症状的重要原因, 但出现乳糖不耐受症状严重程度的差异可能与未被消化吸收的乳糖在结肠内的进一步代谢有关, 如结肠菌群对乳糖的发酵过程.
编辑: 王谨晖 审读:张海宁
| 1. | Matthews SB, Waud JP, Roberts AG, Campbell AK. Systemic lactose intolerance: A new perspective on an old problem. Postgrad Med J. 2005;81:167-173. [PubMed] [DOI] |
| 2. | Vonk RJ, Priebe MG, Koetse HA, Stellaard F, Lenoir-Wijnkoop I, Antoine JM, Zhong Y, Huang CY. Lactose intolerance: analysis of underlying factors. Eur J Clin Invest. 2003;33:70-75. [PubMed] [DOI] |
| 3. | Swallow DM. Genetics of lactase persistence and lactose intolerance. Annu Rev Genet. 2003;37:197-219. [PubMed] [DOI] |
| 4. | Vonk RJ, Stellaard F, Priebe MG, Koetse HA, Hagedoorn RE, De Bruijn S, Elzinga H, Lenoir-Wijnkoop I, Antoine JM. The 13C/2H-glucose test for determination of small intestinal lactase activity. Eur J Clin Invest. 2001;31:226-233. [PubMed] [DOI] |
| 5. | Zhong Y, Yin W, Huang C, Vonk RJ. Study on the expired gas of subjects with lactose intolerance by using H2/13CO2 breath test. Weisheng Yanjiu. 2002;31:180-183. [PubMed] |
| 6. | Sibley E. Genetic variation and lactose intolerance: detection methods and clinical implications. Am J Pharmacogenomics. 2004;4:239-245. [PubMed] [DOI] |
| 7. | Jarvinen RM, Loukaskorpi M, Uusitupa MI. Tolerance of symptomatic lactose malabsorbers to lactose in milk chocolate. Eur J Clin Nutr. 2003;57:701-705. [PubMed] [DOI] |
| 8. | Labayen I, Forga L, Gonzalez A, Lenoir-Wijnkoop I, Nutr R, Martinez JA. Relationship between lactose digestion, gastrointestinal transit time and symptoms in lactose malabsorbers after dairy consumption. Aliment Pharmacol Ther. 2001;15:543-549. [PubMed] [DOI] |
| 9. | Di Stefano M, Veneto G, Malservisi S, Strocchi A, Corazza GR. Lactose malabsorption and intolerance in the elderly. Scand J Gastroenterol. 2001;36:1274-1278. [PubMed] [DOI] |
| 10. | Priebe MG, Wachters-Hagedoorn RE, Stellaard F, Heiner AM, Elzinga H, Vonk RJ. Oro-cecal transit time: influence of a subsequent meal. Eur J Clin Invest. 2004;34:417-421. [PubMed] [DOI] |
| 11. | Burge MR, Tuttle MS, Violett JL, Stephenson CL, Schade DS. Potato-lactulose breath hydrogen testing as a function of gastric motility in diabetes mellitus. Diabetes Technol Ther. 2000;2:241-248. [PubMed] [DOI] |
| 12. | Casellas F, Malagelada JR. Applicability of short hydrogen breath test for screening of lactose malabsorption. Dig Dis Sci. 2003;48:1333-1338. [PubMed] [DOI] |
| 13. | Di Stefano M, Missanelli A, Miceli E, Strocchi A, Corazza GR. Hydrogen breath test in the diagnosis of lactose malabsorption: accuracy of new versus conventional criteria. J Lab Clin Med. 2004;144:313-318. [PubMed] [DOI] |
| 14. | Clausen MR, Jorgensen J, Mortensen PB. Comparison of diarrhea induced by ingestion of fructooligosaccharide Idolax and disaccharide lactulose: role of osmolarity versus fermentation of malabsorbed carbohydrate. Dig Dis Sci. 1998;43:2696-2707. [PubMed] [DOI] |
| 15. | Lee SY, Madan A, Furuta GT, Colgan SP, Sibley E. Lactase gene transcription is activated in response to hypoxia in intestinal epithelial cells. Mol Genet Metab. 2002;75:65-69. [PubMed] [DOI] |
| 16. | Pribila BA, Hertzler SR, Martin BR, Weaver CM, Savaiano DA. Improved lactose digestion and intolerance among African-American adolescent girls fed a dairy-rich diet. J Am Diet Assoc. 2000;100:524-528. [PubMed] [DOI] |