修回日期: 2005-05-20
接受日期: 2005-05-25
在线出版日期: 2005-07-15
目的: 在大肠杆菌中表达乙型肝炎病毒(HBV)前-X蛋白,并进行纯化和鉴定.
方法: 通过聚合酶链式反应(PCR)获得HBV前-X基因,将前-X克隆至PET32a+,构建原核表达重组质粒,在大肠杆菌中诱导表达,表达产物进行SDS-聚丙烯酰胺凝胶电泳(PAGE),考马斯亮蓝染色.采用凝胶电泳回收纯化.经Western blot.
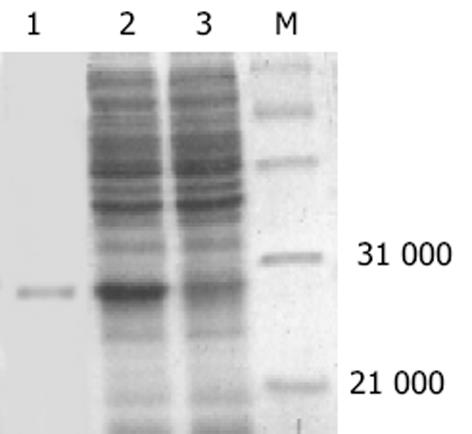
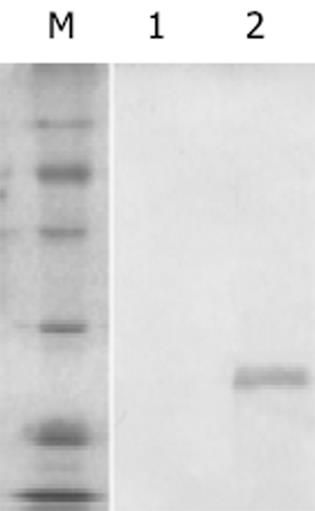
结果: 成功扩增获得HBV的前-X编码基因片断,并构建大肠杆菌表达载体.表达载体转化的大肠杆菌经过IPTG的诱导,裂解,SDS-PAGE,结果显示得到了目的蛋白Mr27 000.以抗-His的单克隆抗体进行的western blot杂交实验,结果表明表达、纯化的目的蛋白具有特异性免疫反应识别.
结论: 成功表达HBV的前-X蛋白,对于研究HBV的前-X蛋白的免疫原性和生物学特性奠定了坚实的基础.
引文著录: 王春花, 成军, 郎振为, 李蕴茹, 闫杰, 张黎颖. 乙型肝炎病毒前-X在大肠杆菌中的表达和纯化. 世界华人消化杂志 2005; 13(13): 1612-1614
Revised: May 20, 2005
Accepted: May 25, 2005
Published online: July 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1612-1614
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1612.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1612
乙型肝炎病毒(HBV)是一种嗜肝部分双链DNA病毒,不仅引起急、慢性病毒性肝炎,而且与肝纤维化(LF)、肝细胞癌(HCC)的发生、发展密切相关[1].1979年Gelibert et al首次报告了HBV DNA的全基因序列,并确定了4个主要的开放读码框架(ORF)[2-3].HBV基因组只有3.2 kb,其结构特点是结构基因与调节基因序列之间重叠,甚至结构基因序列之间重叠,HBV DNA序列的利用率之高实属罕见[4-12].最近我们课题组对中国HBV流行株的全基因序列进行克隆和序列分析,提出了HBV DNA编码基因序列中存在一个新的ORF前X基因序列的理论[13-14],并重新确定了X区启动子的位置,提出全X基因在HBV基因组中的新位置,在国内外引起广泛关注,但是该理论的研究工作目前只是初步在基因水平证实前X基因序列的真实存在,特别是关于前X基因具有完整的ORF的编码蛋白序列的理论主要是建立在生物信息学的应用分析之上,如果能从蛋白水平在临床实验资料中进一步验证前X是一种编码蛋白,那么对前X编码基因的真实性将更有说服力,这将改写HBV DNA编码基因序列研究的历史.
由于前X编码蛋白是一种新型的功能未知的蛋白,不存在商品化的检测试剂盒,为了制备抗体用于临床标本的检测,我们自己尝试在原核系统中进行表达,获得了大量高效表达的重组抗原,通过Western-blotting证实,具有良好的免疫原性,为下一步免疫动物制备多克隆抗体应用于免疫组织化学和酶联免疫吸附的检测奠定了实验基础.
质粒和菌株: pMD-18T载体购自Takara,表达载体pET32a+和大肠杆菌E.coliBL21、E.coliXL1均为本室保存; pcDNA3.1(-)-前X由本室构建.主要试剂: IPTG购自Promega公司,高保真PCR系统(Elongasemix enyme)购自Invitrogen公司,小量质粒抽提及胶纯化回收试剂盒购自QIAGEN公司,T4DNA连接酶及限制性内切酶均购自Takara公司,其余化学试剂均为国产分析纯和生化试剂.DNA序列测定由上海博亚公司完成.
1.2.1 前-X的 PCR扩增: 根据报道的前X蛋白基因序列[13],设计序列特异性引物 P1、P2,P1: GGATCCATGGGGCTT GGCTATTGG,P2: AAGCTTGGAAAGGAGGTGTATTTC,在P1-5'端含有BamHI酶切位点,P2-5'端含有HindⅢ酶切位点.利用pcDNA3.1(-)-前X为模板,PCR技术扩增获得该新基因的全长序列.
1.2.2 重组表达质粒的构建: 将纯化的目的基因连接至pMD-18T载体,经测序确定序列后,用BamHI和HindⅢ从克隆载体酶切目的基因片段,琼脂糖凝胶电泳纯化,与经BamHI和HindⅢ酶切pET32a+表达质粒连接,转化大肠杆菌E.coli XL1,小量提取质粒酶切鉴定.
1.2.3 重组蛋白的表达和包涵体纯化: 将鉴定为阳性的质粒转化大肠杆菌E.coli BL21,挑取单菌落,37℃振摇培养 12 h,以1∶5 稀释,37℃振摇培养2 h,加入IPTG至终浓度 1 mmol/L.同时设阴性对照,继续37℃振摇培养4 h.对经 120 g/L SDS-PAGE电泳证实的表达菌株,进行大量诱导,超声裂解破碎,分别收集裂解上清和沉淀,将沉淀用包涵体洗液清洗一次,溶于 8 mol/L尿素(PH8.0)中,采用凝胶电泳回收的方法进行纯化.
1.2.4 重组蛋白的抗原性检测: Western blot检测: 以His抗体 1∶3 000稀释作为第一结合抗体,第二结合抗体为兔抗鼠 IgG,由中山公司生产,以 1∶5 000 稀释.
将重组阳性质粒转入大肠杆菌E.coli BL21,经IPTG诱导得到表达.表达产物进行SDS-PAGE(120 g/L),考马斯亮蓝染色.结果表明其表达产物主要以包涵体形式存在,Mr27 000,纯化后的包涵体未显示其他杂带(图2).蛋白印迹试验表明,表达的重组蛋白与His抗体可产生特异性结合,在Mr27 000左右有明显杂交信号(图3).
1979年,Gelibert et al首次报告了HBV基因组的全序列,并定位了4个ORF.我国学者于1984年报道了大陆HBV株(adr)的序列[15].目前在美国国立卫生研究院(NIH)的核苷酸序列数据库(GenBank)中,存储了200多个HBV全基因组序列,但之后学者对4个ORF分区的界定并无异议,沿用至今.我们课题组[13-14]利用LA-PCR技术扩增了中国HBV流行株DNA全基因序列,在分析所获得的5个克隆的过程中,在X区之前发现还存在一个ORF,长度168 bp,编码56 aa,Mr6 200,有15个疏水氨基酸,24个极性氨基酸.应用DNASIS软件的蛋白分析功能分析了前-X基因的完全表达产物,前-X区较以往认为的X蛋白多出一个小的亲水区.前-X区编码多肽含有5个C,可能形成多个二硫键,易于产生新的二级结构.前-X多肽含有24个极性氨基酸,形成一个亲水功能域,可能影响到整个蛋白的空间构象.根据针对前-X多肽的氨基酸组成分析,发现该区域含有多个S,可能是磷酸化的重要区域,与细胞内信号转导有关.我们应用2种方法来证实前X的真实存在.其一是在GenBank中选择不同血清型的HBV基因组全序列,应用DNASIS软件重新确定其ORF,结果发现甘人宝et al[15]发现的HBV基因组序列中存在前-X区ORF.其他亚型不表达前-X区多是由于前-X区起始密码子ATG发生替换突变所致,其他亚型的克隆表现为TTG(X04615),或CTG(克隆X02763、Z35717和G329640).另一adr亚型克隆D12980保留了第一起始密码子ATG,但在两个起始密码子之间由于发生替换突变,而终止了前-X多肽的表达.初步推定前-X区起始密码子处发生的替换突变可能是血清型特异性的.其二是利用NIH网站的BLAST软件,将前-X区编码氨基酸序列输入后进行同源性搜索,结果发现在已经存入GenBank中的序列中,有19个克隆中含有的氨基酸序列与本研究获得的序列有较高的同源性,分别为来自2组报道,其中2个克隆是来自同一序列的不同解释,另17个克隆均来自日本学者对HCC患者体内存在的HBV基因组分析所获得.将克隆的氨基酸序列与18例相关克隆比较,发现同源性为85-94%.这些克隆的共性为: 第一,均为adr亚型; 第二,均克隆自HCC患者.综合上述两种方法证实的结果,可以肯定前-X区是实际存在的.
从蛋白水平和临床资料中证实前X是一种编码蛋白,是支持该理论的关键点所在,由于前X编码蛋白是一种新型的功能未知的蛋白,不存在商品化的检测试剂盒,因而表达纯化前X编码蛋白制备多克隆抗体应用于临床检测是必经之路.大肠杆菌作为目前应用最广泛的原核表达系统,表达目的蛋白具有快速、高效、经济等很多优点[16].pET32a+含有一段辅助蛋白基因,该辅助蛋白包括Trx,His和S等标签序列,有助于提高目的蛋白的表达效率,即对表达产物进行纯化和检测,Mr18 000-20 000,在大多数情况下不会影响被修饰蛋白的免疫原性、结构和功能.由此,我们选用pET32a+作为表达载体,并且上游引物中碱基的设计与载体相匹配,表达蛋白时使辅助蛋白融合到目的蛋白的N端.应用此设计,在大肠杆菌中获得了高效表达的融合蛋白,表达蛋白以包涵体形式存在.SDS-PAGE电泳显示融合辅助蛋白的表达产物Mr27 000,这与预测的前X蛋白大小相吻合,并且通过WB检测证实此融合蛋白包含His组氨酸标签,从而间接证实了前X的表达.外源蛋白高水平表达过程中容易形成无活性的包涵体[17],这是原核表达系统的一个缺陷,但以包涵体形式表达的蛋白容易纯化,且保留免疫原性,可不经复性作为检测抗体诊断试剂盒的包被抗原.因不考虑复性,所以将包涵体经高浓度尿素溶解后,采用从已染色的凝胶中电洗脱法纯化回收目的蛋白.这种方法既可确保蛋白纯度,又相对简便、经济.
本研究在基因水平已证实前X区存在前提下,成功构建了前X的原核表达载体,在大肠杆菌中表达纯化了具有免疫原性的前X蛋白,为下一步制备多抗奠定了实验基础,为下游的临床检测提供了将基础实验研究与临床验证相结合的桥梁,并且前X蛋白的功能如果得到进一步证实,也将对HBV感染的检测、疫苗设计、HBV进入肝细胞机制(受体学说)、表面抗原的表达过程及功能、宿主抗感染机制、HCC产生机制研究均产生重大影响.
编辑: 王谨晖 审读:张海宁
| 2. | Gelibert F, Mandart E, Fitoussi F, Tiollais P, Charnay P. Nucleotide sequence of the hepatitis B virus genome (subtype ayw) cloned in E. coli. Nature. 1979;281:646-650. [PubMed] [DOI] |
| 3. | Charnay P, Mandart E, Hampe A, Fitoussi F, Tiollais P, Galibert F. Localization on the viral genome and nucleotide sequence of the gene coding for the two major polypeptides of the hepatitis B surface antigen (HBsAg). Nucleic Acids Res. 1979;7:335-346. [PubMed] [DOI] |
| 4. | 董 菁, 成 军, 王 勤环, 皇甫 竞坤, 施 双双, 张 国庆, 洪 源, 李 莉, 斯 崇文. 乙型肝炎病毒DNA序列异质性及准种特点的研究. 中华医学杂志. 2002;82:81-85. |
| 5. | 董 菁, 成 军, 王 勤环, 施 双双, 皇甫 竞坤, 王 刚, 洪 源, 李 莉, 斯 崇文. 乙型肝炎病毒前C/C基因准种与变异特点的研究. 解放军医学杂志. 2002;27:122-123. |
| 6. | 董 菁, 成 军, 王 勤环, 王 刚, 施 双双, 刘 妍, 夏 小兵, 李 莉, 张 国庆, 斯 崇文. 乙型肝炎病毒C基因启动子区准种与变异 特点的研究. 中华实验和临床病毒学杂志. 2002;16:264-266. |
| 9. | 董 菁, 李 进, 施 双双, 皇甫 竞坤, 成 军, 王 勤环, 洪 源, 王 业东, 李 莉, 斯 崇文. 乙型肝炎病毒基因组准种与变异特点的研究. 解放军医学杂志. 2002;27:116-118. |
| 12. | 刘 妍, 董 菁, 皇甫 竞坤, 成 军, 韩 萍, 牟 劲松, 李 克, 钟 彦伟. 乙型肝炎病毒核心启动子区基因异质性及对其转录活性的影响. 解放军医学杂志. 2002;27:128-130. |
| 14. | 杨 倩, 董 菁, 成 军, 刘 妍, 洪 源, 王 建军, 王 琳, 张 树林. 乙型肝炎病毒基因组中前-X-编码基因启动子序列的 确定及转录活性的鉴定. 解放军医学杂志. 2003;28:765-767. |
| 16. | Swartz JR. Advances in Escherichia coli production of therapeutic proteins. Curr Opin Biotechnol. 2001;12:195-201. [PubMed] [DOI] |
| 17. | Kiefhaber T, Rudolph R, Kohler HH, Buchner J. Protein aggregation in vitro and in vivo: a quantitative model of the kinetic competition between folding and aggregation. Biotechnology (N Y). 1991;9:825-829. [PubMed] [DOI] |