修回日期: 2005-05-20
接受日期: 2005-05-25
在线出版日期: 2005-07-15
目的: 应用抑制性消减杂交(SSH)技术构建乙型肝炎病毒(HBV)前-X基因反式激活基因差异表达的cDNA消减文库, 克隆前-X反式激活相关基因, 了解该段基因的可能生物学功能.
方法: 构建表达质粒pcDNA3.1(-)-前-X, 转染HepG2细胞, 以空载体pcDNA3.1(-)转染的HepG2细胞为对照; 提取转染后细胞的mRNA, 反转录为cDNA.cDNA经RsaI酶切后, 将实验组cDNA分成两组, 分别与两种不同的接头衔接, 再与对照组cDNA进行两次消减杂交及两次抑制多聚酶链反应(PCR), 将产物与pGEM-Teasy载体连接, 构建cDNA消减文库, 并转染大肠杆菌进行文库扩增, 随机挑选克隆PCR扩增后进行测序及同源性分析.
结果: 成功构建前-X基因反式激活基因差异表达的cDNA消减文库.文库扩增后得到45个白色克隆, 进行菌落PCR分析, 均得到200-1 000 bp插入片段.挑取含有插入片段的30个克隆进行测序, 并通过生物信息学分析获得13种已知功能基因序列.
结论: 应用SSH技术成功构建了前-X基因反式激活基因差异表达的cDNA消减文库.该文库的建立为阐明该基因生物学功能提供理论依据.
引文著录: 杨倩, 张黎颖, 成军, 洪源, 刘妍, 王琳, 董菁, 张树林. 应用抑制性消减杂交技术克隆乙型肝炎病毒前-X蛋白反式激活基因. 世界华人消化杂志 2005; 13(13): 1609-1611
Revised: May 20, 2005
Accepted: May 25, 2005
Published online: July 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1609-1611
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1609.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1609
乙型肝炎病毒(HBV)为3.2 kb部分双链的DNA病毒, 其基因组结构紧密, 特点为结构基因与调节基因序列之间重叠, 甚至结构基因序列之间重叠.1979年Gelibert et al首次报告了HBV DNA的全基因序列并确定4个主要的开放读码框架(ORF): P、前-S/S、前-C/C和X.研究者对这一界定沿用至今.关于这一紧密DNA结构中是否存在新的编码序列, 一直没有进行系统的研究.在1990年代曾有日本学者报道在X基因上游存在一段新的基因, 但并未对该基因的真实性及生物学功能进行研究[1].我们课题组通过分子流行病学研究、上游启动子活性鉴定, 确定了前-X基因存在的真实性, 并利用分子生物学技术对其功能进行了研究[2-4].为了研究HBV感染肝细胞之后, 前-X基因编码的前-X蛋白对于肝细胞的基因表达谱的影响, 我们应用抑制性消减杂交(SSH)技术对于表达和不表达前-X蛋白的肝母细胞瘤细胞系HepG2的基因表达类型进行了差异比较.
肝母细胞瘤细胞系HepG2细胞及大肠杆菌DH5α(本室保存), pcDNA3.1(-)真核表达载体(Invitrogen), FuGENE6转染试剂(Roche), TRIZOL提取试剂(LIFE TECHNOLOGIES), poly A T tract mRNA Isolation system Ⅲ试剂盒(Promega), PCR-Select cDNA Subtraction试剂盒(Clontech), 50×PCR Enzyme Mix、Advantage PCR Cloning试剂盒(Clontech), High Pure PCR Product Purification试剂盒(Promega), pGEM-Teasy载体(Promega).真核表达质粒pcDNA3.1(-)-前X由本室构建.DNA序列测定由上海申友公司完成.
1.2.1 真核表达载体的细胞转染及mRNA提取: 用FuGENE6转染试剂将2 μg pcDNA3.1(-)-前-X及pcDNA3.1(-)空载体分别转染35 mm平皿HepG2细胞, 48 h后收获细胞.使用QuikPrePmico mRNA Purification试剂盒从HepG2细胞中直接提取重组表达质粒及空载体的HepG2细胞的mRNA, 经分光光度计分别进行定量分析.
1.2.2 消减杂交文库的建立: 采用PCR-Select cDNA Subtraction Kit, 常规SSH方法按说明书进行: 以转染了重组表达质粒及空载体的HepG2细胞mRNA为模板逆转录合成双链cDNA(dscDNA), 并分别标记为Tester和Driver, dscDNA经RsaⅠ(一种识别4碱基序列的内切酶)消化, 产生相对较短的平端片段, 纯化酶切产物.将Tester的dscDNA分为两份, 分别连接试剂盒提供的特殊设计的寡核苷酸接头Adapter 1和Adapter 2, 然后与过量的Driver dscDNA进行杂交; 合并两种杂交产物后再与Driver dscDNA作第2次杂交; 然后将杂交产物做选择性PCR扩增, 使Tester dscDNA中特异性表达或高表达的片段得到特异性扩增.
1.2.3 消减文库扩增及克隆分析: 扩增产物与pGEM-Teasy载体连接, 转化DH5α感受态细菌, 在含氨苄青霉素的LB/X-gal/IPTG培养板上, 37℃培养18 h.挑取白色菌落, 增菌, 以pGEM-Teasy载体多克隆位点两端T7/SP6引物进行菌落PCR扩增, 证明含有插入片段后(200-1 000 bp), 测序.应用生物信息学将测得序列与GenBank数据库进行在线同源性分析(http://www.ncbi.nlm.gov/blast/blast.cgi).
紫外分光检测显示, 转染了真核表达质粒及空载体的HepG2细胞提取mRNA分别为3.2 μg和3.6 μg, A260/A280 = 1.79. 20 g/L琼脂糖凝胶电泳mRNA为大于0.5 kb清晰慧尾片状条带, 证实mRNA质量完全满足进行消减杂交的要求.
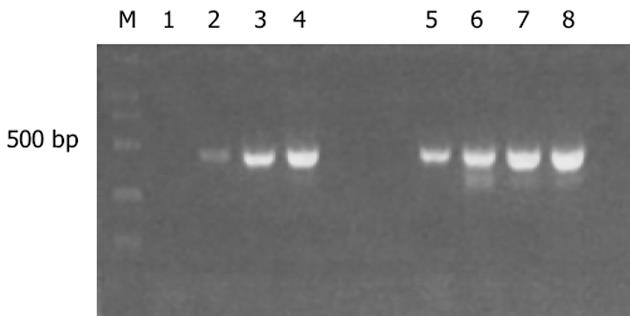
以消减及未消减PCR产物为模板, 用G3PDH引物进行PCR扩增, 分别在18、23、28、33次循环结束时从体系中吸取5 μL进行电泳鉴定.结果显示: 与未消减组PCR产物相比, 消减组PCR产物中G3PDH基因产物大大减少, 说明所构建的消减文库具有很高的消减效率(图1).
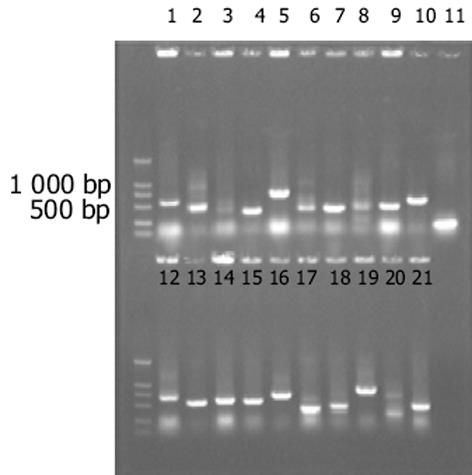
杂交产物经两轮PCR扩增后, 菌落PCR扩增结果显示为200-1 000 bp大小不等的插入片段, 所获得的85个克隆中几乎均含有插入片段, 这些条带可能代表差异表达的基因片段(图2).
SSH技术是一种以抑制PCR反应为基础, 将标准化测试cDNA单链步骤和消减杂交步骤合为一体的技术[5-6].抑制消减杂交技术对高、低丰度的差异表达基因都能有效分离, 在分离稀少基因方面比cDNA消减杂交、代表性差异分析、mRNA差异显示方法具有明显优势; 一次SSH反应可同时分离到几十到几百个差异表达基因[7-8].
应用软件的蛋白质分析功能分析了前-X基因的完全表达产物.前-X区编码多肽含有5个C, 可能形成多个二硫键, 易于产生新的二级结构.前-X多肽含有24个极性氨基酸, 形成一个亲水功能域, 可能影响到整个蛋白的空间构象.根据针对前-X多肽的氨基酸组成分析, 发现该区域含有多个S, 可能是磷酸化的重要区域, 与细胞内信号转导有关.我们利用SSH技术分别对前-X和全-X对人肝癌细胞系基因表达谱的改变进行了研究, 力图阐述这个新基因的功能.成功构建前-X基因真核表达质粒, 转染HepG2细胞, 利用SSH技术对差异性表达基因进行同源性分析后发现, 上调表达基因包括核糖体, 转膜蛋白等[9-10].转膜蛋白参与肿瘤细胞的转移和细胞间的黏附.上调表达胎盘绒毛细胞中的mRNA, 有3个相同克隆, 是否与HBV垂直传播有关, 值得进一步探讨.
NEDD5是近年来发现的哺乳动物septin蛋白家族中的一个成员, 具有GTPase酶活性.类似于酵母和果蝇的septin蛋白, 与细胞浆移动移动相关.Kinoshita et al[11]研究发现鼠NEDD5基因编码一个41.5 ku的GTP酶, 类似于酵母及果蝇的细胞浆移动必须蛋白-septin蛋白.在细胞分裂间期和后期, NEDD5聚集成纤维状或粒状结构, 有赖于细胞的生长状态.富含NEDD5的纤维可被微注射GTPγS和缺乏GTP结合活性的NEDD5突变体破坏, 提示GTP的水解需要NEDD5的集合装配.富含NEDD5的纤维也可以与肌动蛋白束和局灶性黏附复合物相互作用, 也可被细胞松弛素D、C3酵素及血清饥饿所破坏, 认为NEDD5在细胞间期与基于肌动蛋白的细胞骨架系统由功能性相互作用.从细胞分裂后期至末期, NEDD5则聚积在收缩环附近, 直到最后形成中间体.Vega et al[12]研究神经细胞中NEDD5与胞外复合物之间的关系, 以及NEDD5在分化的pc12细胞中的突触生长中的角色发现, 当应用神经生长因子诱导分化时, 内源性NEDD5在未分化的pc12细胞中富集在核周, 成放射状向外形成锥形.NEDD5与其他septin蛋白家族成员相同, 可与小鼠脑细胞裂解物中的胞外复合物及微管蛋白共沉淀.GTPase缺陷的NEDD5过表达可促使PC12细胞异常突触的生长.这一结果表明NEDD5与其他septin蛋白一起共同与囊泡外复合物及微管蛋白相互作用, 推测NEDD5的GTPase活性可能是神经突生长的重要因素.总之, NEDD5可能为神经细胞极化所必需, 也许在神经细胞分化过程中通过促进囊泡外复合物的功能起作用.目前HBV感染后只有在引起肝性脑病时患者才会出现神经精神症状, 但是在之前有没有神经系统的病变基础, 目前很少有人报道, 而且肝性脑病的发生机制目前仍然处于研究当中, 本文发现前X-蛋白可以激活NEDD5基因的表达, 提示有必要对肝性脑病的发病机制, 以及HBV感染者的神经系统是否存在潜在的或前期的病变进行研究.
总之, 本研究对于前-X基因的分析鉴定, 为前-X和全-X功能的研究, 为进一步了解HBV的发病机理提供了新的方向.
编辑: 王谨晖 审读: 张海宁
| 1. | Takahashi K, Akahane Y, Hino K, Ohta Y, Mishiro S. Hepatitis B virus genomic sequence in the circulation of hepatocellular carcinoma patients: comparative analysis of 40 full-length isolates. Arch Virol. 1998;143:2313-2326. [PubMed] [DOI] |
| 5. | Yokota N, Mainprize TG, Taylor MD, Kohata T, Loreto M, Ueda S, Dura W, Grajkowska W, Kuo JS, Rutka JT. Identification of differentially expressed and developmentally regulated genes in medulloblastoma using suppression subtraction hybridization. Oncogene. 2004;23:3444-3453. [PubMed] [DOI] |
| 6. | Majda BT, Meloni BP, Rixon N, Knuckey NW. Suppression subtraction hybridization and northern analysis reveal upregulation of heat shock, trkB, and sodium calcium exchanger genes following global cerebral ischemia in the rat. Brain Res Mol Brain Res. 2001;93:173-179. [PubMed] [DOI] |
| 7. | Su ZZ, Kang DC, Chen Y, Pekarskaya O, Chao W, Volsky DJ, Fisher PB. Identification of gene products suppressed by human immunodeficiency virus type 1 infection or gp120 exposure of primary human astrocytes by rapid subtraction hybridization. J Neurovirol. 2003;9:372-389. [PubMed] [DOI] |
| 8. | Kiss C, Nishikawa J, Dieckmann A, Takada K, Klein G, Szekely L. Improved subtractive suppression hybridization combined with high density cDNA array screening identifies differentially expressed viral and cellular genes. J Virol Methods. 2003;107:195-203. [PubMed] [DOI] |
| 9. | Hashida H, Takabayashi A, Tokuhara T, Hattori N, Taki T, Hasegawa H, Satoh S, Kobayashi N, Yamaoka Y, Miyake M. Clinical significance of transmembrane 4 superfamily in colon cancer. Br J Cancer. 2003;89:158-167. [PubMed] [DOI] |
| 10. | Solmi R, De Sanctis P, Zucchini C, Ugolini G, Rosati G, Del Governatore M, Coppola D, Yeatman TJ, Lenzi L, Caira A. Search for epithelial-specific mRNAs in peripheral blood of patients with colon cancer by RT-PCR. Int J Oncol. 2004;25:1049-1056. [PubMed] |
| 11. | Kinoshita M, Kumar S, Mizoguchi A, Ide C, Kinoshita A, Haraguchi T, Hiraoka Y, Noda M. Nedd5, a mammalian septin, is a novel cytoskeletal component interacting with actin-based structures. Genes Dev. 1997;11:1535-1547. [PubMed] [DOI] |
| 12. | Vega IE, Hsu SC. The septin protein Nedd5 associates with both the exocyst complex and microtubules and disruption of its GTPase activity promotes aberrant neurite sprouting in PC12 cells. Neuroreport. 2003;14:31-37. [PubMed] [DOI] |