修回日期: 2005-05-20
接受日期: 2005-06-01
在线出版日期: 2005-07-15
目的: 研究CCl4致肝硬化门静脉高压大鼠肠道黏膜通透性变化.
方法: 以镧为示踪剂观察肠道黏膜通透性在CCl4致肝硬化门静脉高压组和对照组大鼠的变化, 采用透射电镜观察镧在肠道黏膜内的通透情况, 同时检测两组大鼠肠道细菌和内毒素移位的情况.
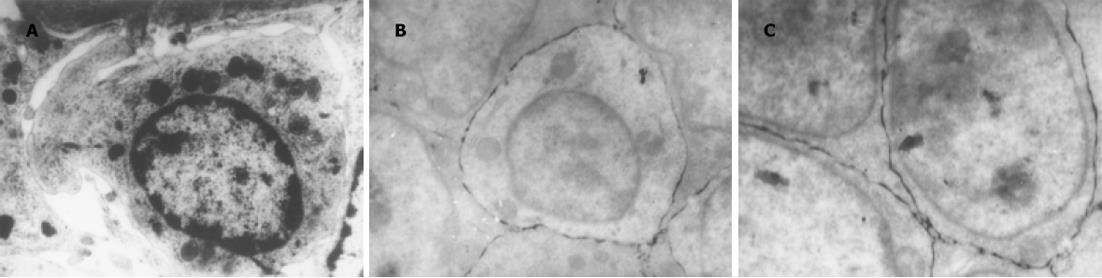
结果: 内毒素测定: 门静脉高压组大鼠体静脉血(0.083±0.012 EU/mL)、门静脉血(0.126±0.012 EU/mL)、腹水中的内毒素水平(0.062±0.012 EU/mL)均较对照组(0.046±0.009 EU/mL)明显升高(P<0.05).细菌培养: 门静脉高压组肠系膜淋巴结的细菌检出率显著高于对照组(85% vs 20%, P<0.05).腹水中细菌的检出率门静脉高压组显著高于对照组(41% vs 0, P<0.01).透射电子显微镜观察: 门静脉高压大鼠肠黏膜的通透性明显增加, 镧呈线状沉积在肠道黏膜的上皮细胞之间, 并向下沉积到黏膜细胞下面的固有层; 而对照组大鼠没有出现这样的变化.
结论: 门静脉高压症时肠黏膜上皮细胞之间, 而不是上皮细胞本身的通透性增高, 可能是导致细菌和内毒素的移位的途径.
引文著录: 姚国相, 沈忠义, 薛新波, 杨镇. CCl4致肝硬变门静脉高压大鼠肠黏膜通透性的变化. 世界华人消化杂志 2005; 13(13): 1606-1608
Revised: May 20, 2005
Accepted: June 1, 2005
Published online: July 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1606-1608
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1606.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1606
虽然目前很多学者已经认同应激和危重患者可以发生肠道内细菌及其成分的移位, 即细菌移位.国外一些研究认为在肝硬化门静脉高压时也可以发生细菌移位, 但是对于在肝硬化门静脉高压时发生细菌移位的具体机制, 特别是在肝硬化门静脉高压时肠道黏膜通透性的变化上的研究, 目前的报道较少[1-3].
关于细菌移位的途径, 一些研究报道细菌及其产物主要是通过肠道黏膜上皮细胞进入下方的间质; 我们以往采用肝前门静脉结扎的方法发现, 肠道黏膜上皮细胞之间的通透性明显增强; 本研究我们进一步了解CCl4致肝硬化门静脉高压症肠道黏膜上皮通透性的变化[4-6].
本研究通过建立肝硬化门静脉高压大鼠的动物模型, 以镧为示踪剂在透射电镜下观察肠黏膜屏障的通透性改变, 同时测定其细菌和内毒素移位的情况.
健康成年Sprague-Dawley大鼠, 共60只, 重量在250-300 g.动物习惯实验室环境6 d后进行实验研究.此期间自由进食和饮水.主要试剂和仪器: 内毒素试剂盒, 硝酸镧, 巧克力麦康凯琼脂和透视电子显微镜.
1.2.1 动物模型的建立: 随机取30只大鼠作为肝硬化门静脉高压组, 另外30只作为对照组.肝硬化门静脉高压组大鼠每天在浅的乙醚麻醉下灌胃.初次CCl4剂量为20 μL, 而后根据每次灌胃48 h后的体重计算下一次灌胃剂量.当腹水出现后, 剂量减为40 μL/wk; 如果腹水消失, 剂量要相应增加.对照组30只大鼠进行同样的灌胃但用的是蒸馏水[7].
1.2.2 标本的采取和检测: 当腹水出现4 wk后, 在乙醚麻醉下, 严格无菌操作, 采用腹部正中切口开腹.从门静脉和体静脉取血放入无热源试管中, 进行内毒素的测定; 并各取上述血0.5 mL立即放入血培养瓶中进行培养.留取腹水、肠系膜淋巴结、肝脏和脾称重、匀浆, 而后取上清液进行细菌培养; 腹水进行内毒素测定.所有的标本均进行需氧培养3-5 d, 采用常规方法鉴定培养基中细菌的种类[8].而后取末端回肠, 用乳酸林格氏液漂洗后, 将小块组织立即放入含40 mg/L硝酸镧的20 mg/L戊二醛中固定液中浸泡1 h.随后切割成1 mm3的小块.随后在上述固定液中冲洗3次, 每次10 min.再在用二甲砷酸钠配制的10 mg/L锇酸中固定1 h, 锇酸中也含有硝酸镧.逐级酒精脱水, EPON812包埋.超薄切片不再染色, 在透射电镜下观察[9-10].
统计学处理 χ2检验用于比较细菌检出率, 内毒素的比较用方差分析.P<0.05为有显著性差异.
门静脉高压组大鼠在剖腹后均观察到肝脏表面有明显结节形成, 肝叶有变形和缩小.均有明显的腹水形成, 脾脏明显肿大.
门静脉高压组大鼠体静脉血(0.083±0.012 EU/mL)、门静脉血(0.126±0.012 EU/mL)、腹水中的内毒素水平(0.062±0.012 EU/mL)均较对照组(0.046±0.009 EU/mL)明显升高.各组与对照组之间有显著性差异(P<0.05).
门静脉高压组肠系膜淋巴结的细菌检出率显著高于对照组(85% vs 20%, P<0.05).腹水中细菌的检出率门静脉高压组显著高于对照组(41% vs 0, P<0.01).
目前认为创伤和应激等情况下机体容易出现肠道黏膜通透性增高而导致细菌和内毒素移位.近来一些文献报告门静脉高压症时机体也可以出现细菌和内毒素的移位, 但是具体发生的机制没有深入的研究[11].另外, 相当多的动物研究采用的是肝前门静脉结扎方法制成门静脉高压的动物模型, 采用肝纤维化的方法制成门静脉高压动物模型是否发生细菌和内毒素的移位, 目前的研究较少[12].因为采用CCl4制成的动物模型在腹水出现后继续用药容易造成动物死亡, 我们在研究中采用调整用药的办法, 研究中没有动物死亡.我们的动物模型更加确切的模拟了人肝硬化门静脉高压症[13].
我们的研究显示, 门静脉高压的大鼠门静脉、体静脉和腹水中内毒素水平均高于对照组, 肠系膜淋巴结中的细菌检出率也高于对照组.提示在肝硬化门静脉高压症的情况下确实可以发生细菌和及其组成成分(内毒素)的移位.
重金属镧目前是研究黏膜屏障的一种有效手段, 一般是在体外对黏膜屏障通透性进行研究.与其他的一些研究肠黏膜屏障的方法比, 具有直接和简便的优点.在接下来透射电镜下的观察发现, 镧沉积在上皮细胞之间以及上皮细胞下面的固有细胞层, 因为镧的直径为4 nm, 正常情况下不能通过细胞和细胞间隙, 如果已经通过, 说明其通透性明显升高.本文是首次报道在肝硬化门静脉高压症时肠道黏膜通透性变化的研究.本研究显示: 肝硬化门静脉高压时肠黏膜屏障的通透性增强主要在肠黏膜上皮细胞间, 而不是如某些报告所描述的上皮细胞本身的通透性增高.接下来在上皮细胞层下面的固有层中也出现了镧的沉积, 而微静脉和微淋巴管均从固有层里收集液体进入循环, 所以说在肝硬化门静脉高压症时肠道黏膜的通透性升高在上皮细胞之间[14-15].
肝硬化门静脉高压时肠黏膜屏障的通透性增强的原因有以下几个方面: (1)门静脉高压症可能因为门静脉系统的压力升高引起肠壁的水肿和充血而引起通透性的增强.(2)淋巴引流不畅导致末梢的微淋巴管压力升高, 引起细胞水肿, 导致上皮细胞之间的通透性增强.(3)肠道淤血后肠管内的细菌过度繁殖.通透性增强后使得活细菌或细菌的成分, 如内毒素或细菌DNA容易通过黏膜进入循环之中, 引起一系列病理生理改变[16-17].
总之, 门静脉高压症时肠黏膜上皮细胞之间, 而不是上皮细胞本身的通透性增高, 可能是导致细菌和内毒素的移位的途径.
编辑: 王谨晖 审读: 张海宁
| 1. | Thalheimer U, Triantos CK, Samonakis DN, Patch D, Burroughs AK. Infection, coagulation, and variceal bleeding in cirrhosis. Gut. 2005;54:556-563. [PubMed] [DOI] |
| 2. | Wiest R, Garcia-Tsao G. Bacterial translocation (BT) in cirrhosis. Hepatology. 2005;41:422-433. [PubMed] [DOI] |
| 3. | Garcia-Tsao G, Wiest R. Gut microflora in the Pathogenesis of the complications of cirrhosis. Best Pract Res Clin Gastroenterol. 2004;18:353-372. [PubMed] [DOI] |
| 5. | Chiva M, Guarner C, Peralta C, Llovet T, Gomez G, Soriano G, Balanzo J. Intestinal mucosal oxidative damage and bacterial translocation in cirrhotic rats. Eur J Gastroenterol Hepatol. 2003;15:145-150. [PubMed] [DOI] |
| 6. | Sola R, Soriano G. Why do bacteria reach ascitic fluid? Eur J Gastroenterol Hepatol. 2002;14:351-354. [PubMed] [DOI] |
| 7. | Cirera I, Bauer TM, Navasa M, Vila J, Grande L, Taura P, Fuster J, Garcia-Valdecasas JC, Lacy A, Suarez MJ. Bacterial translocation of enteric organisms in Patients with cirrhosis. J Hepatol. 2001;34:32-37. [PubMed] [DOI] |
| 8. | Caly WR, Strauss E. A prospective study of bacterial infection in patients with cirrhosis. J Hepatol. 1993;18:353-3589 Sheer TA, Runyon BA. Spontaneous bacterial peritonitis. Dig Dis 2005; 23: 39-46. [PubMed] |
| 9. | Ramachandran A, Prabhu R, Thomas S, Reddy JB, Pulimood A, Balasubramanian KA. Intestinal mucosal alterations in experimental cirrhosis in the rat: role of oxygen free radicals. Hepatology. 2002;35:622-629. [PubMed] [DOI] |
| 10. | Deitch EA. Simple intestinal obstruction causes bacterial translocation in man. Arch Surg. 1989;124:699-701. [PubMed] [DOI] |
| 11. | Wiest R, Cadelina G, Milstien S, McCuskey RS, Garcia-Tsao G, Groszmann RJ. Bacterial translocation up-regulates GTP-cyclohydrolase I in mesenteric vasculature of cirrhotic rats. Hepatology. 2003;38:1508-1515. [PubMed] [DOI] |
| 12. | Arendt T. Penetration of lanthanum through the main pancreatic duct epithelium in rats following exposure to infected human bile. Dig Dis Sci. 1991;36:75-81. [PubMed] [DOI] |
| 13. | Runyon BA, Borzio M, Young S, Squier SU, Guarner C, Runyon MA. Effect of selective bowel decontamination with Norfloxacin on spontaneous bacterial Peritonitis, translocation, and survival in an animal model of cirrhosis. Hepatology. 1995;21:1719-1724. [PubMed] |
| 14. | Alexander JW, Boyce ST, Babcock GF, Gianotti L, Peck MD, Dunn DL, Pyles T, Childress CP, Ash SK. The Process of microbial translocation. Ann Surg. 1990;212:496-511. [PubMed] [DOI] |
| 15. | Deitch EA, Bridge RM. Effect of stress and trauma on bacterial translocation from the gut. J Surg Res. 1987;42:536-542. [PubMed] [DOI] |
| 16. | Cole GT, Seshan KR, Pope LM, Yancey RJ. Morphological aspects of gastrointestinal tract invasion by Candida albicans in the infant mouse. J Med Vet Mycol. 1988;26:173-185. [PubMed] [DOI] |