修回日期: 2005-05-15
接受日期: 2005-05-25
在线出版日期: 2005-07-15
目的: 用多种细胞因子联合诱导大肠癌患者外周血单个核细胞为细胞因子诱导的杀伤(cytokine-induced killer, CIK)细胞, 并了解其在体外的增殖能力及免疫表型的变化.
方法: 用Ficoll Hypaque淋巴细胞分离液分离获取10例大肠癌患者外周血单个核细胞, rhIFN-γ, rhIL-2, Anti-CD3mAb共孵育.分别在第0, 4, 7, 10, 13 d计细胞数, 并通过流式细胞术检测细胞免疫表型.
结果: 大肠癌患者外周血单个核细胞与IFN-γ, IL-2, Anti-CD3mAb共孵育4, 7, 10, 13 d, 细胞数分别增加2.69±0.9, 14.1±3.7, 23.0±5.0和31.2±3.0倍.CD3+, CD4+, CD8+和CD3+CD16+ CD56+细胞在培养第13 d分别从(62.8±7.6)%, (31.5±5.8)%, (44.9±8.2)%和(1.9±0.9)%增加到(90.6±9.0)%, (48.0±6.3)%, (57.3±9.0)%和(41.0±12.7)%.
结论: rhIFN-γ, rhIL-2和Anti-CD3mAb能诱导大肠癌患者外周血单个核细胞为CIK细胞, 体外增殖力强, 是以CD3+CD16+CD56+为主的异质细胞群.
引文著录: 撒亚莲, 华映坤, 宋建新, 严新民, 贾玲, 董虹, 沈涛. 多种细胞因子联合诱导大肠癌患者外周血单个核细胞为CIK细胞的免疫表型. 世界华人消化杂志 2005; 13(13): 1592-1594
Revised: May 15, 2005
Accepted: May 25, 2005
Published online: July 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1592-1594
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1592.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1592
Schmidt Wolf于1991年首次报道外周血单个核细胞在多种细胞因子刺激下活化为细胞因子诱导杀伤细胞(cytokine-induced killer cells, CIK细胞)[1].近年的研究表明CIK细胞是介导细胞毒活性最强的免疫效应细胞, 兼有T淋巴细胞强大的杀瘤活性和NK细胞的非主要组织相容性复合物(MHC)限制的杀瘤效应, 故又称为NKT细胞[2].大肠癌是最常见的肿瘤之一, 也是最常见的肿瘤死亡原因之一.直到现在, 手术仍然是其主要的治疗方式, 大约50%的术后患者在5年内出现转移[3].免疫效应细胞能够识别并清除肿瘤细胞, 据报道在肿瘤术后常规治疗赋予细胞过继免疫治疗能降低复发率[4].在CIK免疫效应细胞用于临床治疗之前, 我们需要证实来源于大肠癌患者外周血单个核细胞的CIK细胞在体外的增殖能力和免疫表型的变化, 为CIK细胞过继免疫治疗提供可靠的理论依据.
10例大肠癌患者均为云南省第一人民医院2003-09/2004-10住院经手术后病检确诊病例, 其中男性9例, 女性1例, 年龄为49-73岁, 平均年龄为65.8岁.RPMI-1640从Invitrogen(GIBCO, 美国)公司购买.胎牛血清(fetal boving serum, FBS)从Hyclone(美国)公司购买.重组人干扰素γ(recombinant human interferonγ, rhIFN-γ)购自上海生物制品研究所(中国).重组人白介素2(recombinant human interleukin-2, rhIL-2)购自深圳科兴生物制品有限公司(中国).鼠抗人CD3单克隆抗体(monoclonal antibody CD3, Anti-CD3mAb)购自Beckman公司(法国).
1.2.1 CIK细胞的分离和培养: 取大肠癌患者外周静脉血12-15 mL, 用Ficoll Hypaque淋巴细胞分离液分离, 收集界面层的单个核细胞, 洗涤2次后, 将细胞按1×109/L数量悬浮于含100 mL/L FBS的RPMI-1640完全培养基中, 添加终浓度为3×106 U/L rhIFN-γ, 置37℃, 50 mL/L CO2培养箱(Forma Therapeutics Inc., USA)中培养.24 h后添加终浓度为20 μg/L Anti-CD3mAb和1.5×106 U/L rhIL-2.每3 d更换培养液一次, 并补充上述细胞因子.在培养0, 4, 7, 10, 13 d时, 对细胞进行计数.
1.2.2 CIK细胞的免疫表型: 在培养第13 d收集CIK细胞, 用平衡液洗细胞后, 用FITC或PE标记的CD3, CD4, CD8, CD16/CD56孵育细胞, 30 min, 4℃.洗去多余的抗体, 用流式细胞仪(Coulter Epics-XL, Beckman-coulter Epics-XL3, Immuno-PREP, USA)检测阳性细胞数.
统计学处理 数据以均数±标准差(mean±SD)表示.
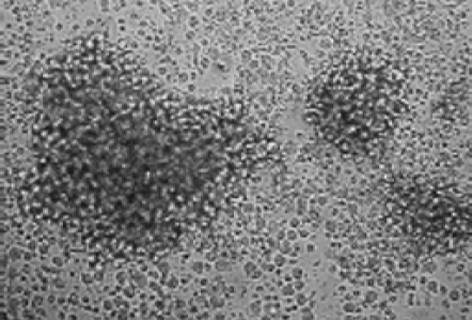
CIK细胞形态似外周血淋巴细胞, 但体积稍大.在培养3 d后, 细胞增殖, 呈团, 可观察到不规则形的细胞.细胞体积增大, 胞质少、胞核大、圆.有时可观察到细胞分裂相.在培养5-7 d, 细胞团更大, 并悬浮在培养液中(图1).
在培养第1-3 d细胞没有明显增殖.4-5 d可观察到细胞呈团、集落样生长, 数量明显增多.在培养4, 7, 10, 13 d细胞数量分别增加2.7±0.9, 14.1±3.7, 23.0±5.0和31.2±3.0倍.
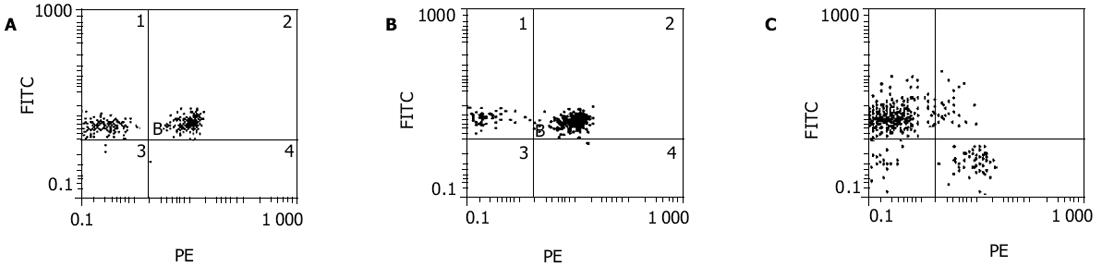
在培养第13 d, CD3+, CD4+, CD8+和CD3+CD16+CD56+细胞分别从(62.8±7.6)%, (31.5±5.8)%, (44.9±8.2)%和(1.9±0.9)%增加到(90.6±9.0)%, (48.0±6.3)%, (57.3±9.0)%和(41.0±12.7)%(图2).
CIK细胞是一组非MHC和非T细胞受体限制性的免疫活性细胞, 其主要效应细胞是以CD3+CD16+CD56+为主的异质细胞群[5-6].CIK细胞是目前认识到的细胞毒活性最强的免疫效应细胞, 回输体内后达到杀灭癌细胞、抑制肿瘤生长及清除残留微小病灶的作用[7-8].由于CIK细胞对正常人体细胞、免疫系统没有任何毒副作用, 而且对多重耐药的肿瘤敏感.因此, CIK细胞过继免疫治疗被公认为继手术、放疗、化疗之后的第四种新型肿瘤治疗模式之一.我们在体外通过rhIFN-γ, rhIL-2和Anti-CD3mAb联合诱导活化大肠癌患者外周血单个核细胞为CIK细胞, 探讨了其增殖能力以及免疫表型的变化, 为临床肿瘤患者过继免疫治疗提供理论依据.
在培养第1 d 加入rhIFN-γ, 预诱导细胞表达IL-2受体、促进细胞增殖及分泌细胞因子.次日加入rhIL-2 和Anti-CD3mAb联合诱导促进T淋巴细胞增殖并加强T淋巴细胞的细胞毒作用.健康状况下, 外周血CIK细胞大约为1-5%, 而我们的研究表明, 大肠癌患者外周血单个核细胞在rhIFN-γ, rhIL-2和Anti-CD3mAb联合作用下培养13 d, 细胞数量增加31.2倍, CD3+CD16+CD56+T细胞扩增近23倍.可以看出, CIK细胞是一种增殖活力强的免疫效应细胞.据报道, 其他细胞因子IL-1, IL-2, IL-7, IL-12, IL-15等[9-10]的不同组合也可诱导单个核细胞为CIK细胞.但我们的操作方法简便, 且细胞因子rhIFN-γ, rhIL-2为上市药品.总之, 本文联合应用多种细胞因子活化大肠癌患者外周血单个核细胞为CIK细胞, 其体外增殖力强, 是以CD3+CD16+CD56+为主的异质细胞群.该研究为临床开展大肠癌患者CIK细胞过继免疫治疗奠定理论基础.
编辑: 张海宁
| 1. | Peeters M, Haller DG. Therapy for early-stage colorectal cancer. Oncology. 1999;13:307-315. [PubMed] |
| 2. | Blattman JN, Greenberg PD. Cancer immunotherapy: a treatment for the masses. Science. 2004;305:200-205. [PubMed] [DOI] |
| 3. | Yamaguchi Y, Ohshita A, Kawabuchi Y, Ohta K, Shimizu K, Minami K, Hihara J, Miyahara E, Toge T. Adoptive immunotherapy of cancer using activated autologous lymphocytes-current status and new strategies. Hum Cell. 2003;16:183-189. [PubMed] [DOI] |
| 4. | Schmidt-Wolf IG, Negrin RS, Kiem HP, Blume KG, Weissman IL. Use of a SCID mouse/ hum an lym phoma model to evaluate cytokine- induced killer cells with potentantitum or cell activity. J Exp Med. 1991;174:139-149. [PubMed] [DOI] |
| 5. | Wang FS, Liu MX, Zhang B, Shi M, Lei ZY, Sun WB, Du QY, Chen JM. Antitumor activities of human autologous cytokine-induced killer (CIK) cells against hepatocellular carcinoma cells in vitro and in vivo. World J Gastroenterol. 2002;8:464-468. [PubMed] [DOI] |
| 6. | Linn YC, Hui KM. Cytokine-induced killer cells: NK-like T cells with cytotolytic specificity against leukemia. Leuk Lymphoma. 2003;44:1457-1462. [PubMed] [DOI] |
| 7. | Hongeng S, Petvises S, Worapongpaiboon S, Rerkamnuaychoke B, Pakakasama S, Jootar S. Generation of CD3+ CD56+ cytokine-induced killer cells and their in vitro cytotoxicity against pediatric cancer cells. Int J Hematol. 2003;77:175-179. [PubMed] [DOI] |
| 8. | Schmidt-Wolf IG, Lefterova P, Mehta BA, Fernandez LP, Huhn D, Blume KG, Weissman IL, Negrin RS. Phenotypic characterization and identification of effector cells involved in tumor cell recognition of cytokine-induced killer cells. Exp Hematol. 1993;21:1673-1679. [PubMed] |
| 9. | Zoll B, Lefterova P, Csipai M, Finke S, Trojaneck B, Ebert O, Micka B, Roigk K, Fehlinger M, Schmidt-Wolf GD. Generation of cytokine-induced killer cells using exogenous interleukin-2, -7 or-12. Cancer Immunol Immunother. 1998;47:221-226. [PubMed] [DOI] |
| 10. | Li Y, Huang SL, Wu YF, Wei J, Bao R, Zhou DH. Expansion of CIK/NK cells from cord blood by using different combinations of stem cell factor, FLT3 ligand and interleukin 2, 7, 15 in vitro. Zhongguo Shiyan Xueyexue Zazhi. 2004;12:350-354. [PubMed] |