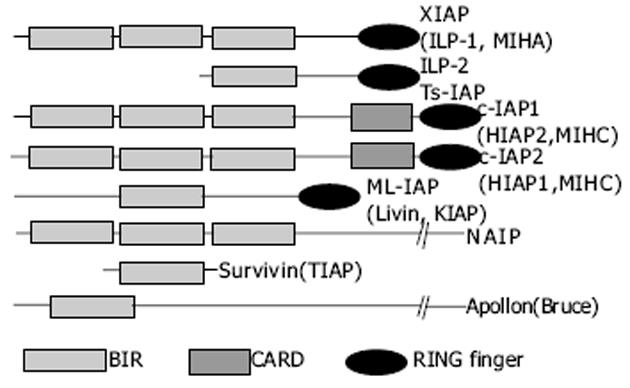
6 Survivin
Survivin是一种新近发现的结构独特的IAPs成员.具有抑制细胞凋亡和调节细胞周期和细胞分裂的双重功能.主要功能是通过抑制Caspase-3, Caspase-7而阻断细胞凋亡; 还与微管蛋白相互作用调控细胞有丝分裂以及参与血管形成.主要表达于胚胎和发育的胎儿组织, 同时高表达于绝大多数肿瘤组织和转化细胞, 而在终末分化成熟的正常成人组织中无表达.Survivin可能是一种癌基因, 参与肿瘤的发生发展过程.提示他是一个有潜在价值的肿瘤标志物, 与肿瘤诊断、预后均密切相关[9-10].针对Survivin设计了一系列的拮抗剂, 抑制肿瘤生长, 增强肿瘤细胞对化疗药物的敏感性, 因此该基因有可能成为肿瘤治疗的新靶点.下文着重讨论survivin的分子结构、生物学功能及与其他IAPs 的不同之处和在肿瘤治疗中的可能地位[9].
6.1 Survivin的发现与蛋白结构及表达
Survivin基因早在1997年由耶鲁大学的Altieri研究组发现[11], 他们用效应细胞蛋白酶受体-1(effector cell protease receptor-1, EPR-1)cDNA作探针从人类基因组P1文库中通过杂交筛选获得, Survivin与EPR-1位于同一染色体, 二者转录方向相反, 互为天然反义核酸.但由于表达时间上的差异, 导致他们在自然状态下相互作用的可能性非常有限.Survivin是迄今发现的最强的凋亡抑制因子, 其抑制细胞凋亡的作用远大于Bcl-2家族成员.
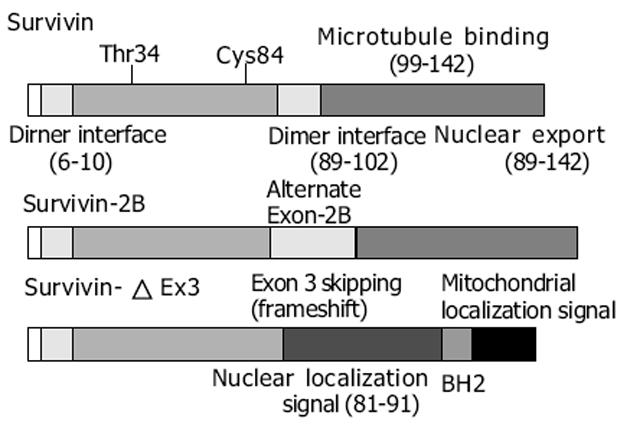
鼠Survivin基因定位于染色体11E2的端粒区.鼠Survivin基因与人类Survivin基因均含有4个外显子, 但其cDNA可编码在距ATG起始区-32、-36及-40位分别有3个转录起始位点, 编码3种不同的Survivin蛋白.最长的开放阅读框来自于全部4个外显子, 第二个cDNA含有内含子2, 编码121个氨基酸的蛋白, 缺乏羧基端螺旋功能区.以前体mRNA剪接去除外显子2, 可获得第3个含有40个氨基酸的蛋白, 缺乏BIR功能区和羧基端螺旋功能区, 因此也缺乏对Caspase-3的抑制作用.人类Survivin研究也发现了2种具有不同抗凋亡特性的新的Survivin的剪接变构体, 一种是缺乏外显子3(Survivin-△Ex3), 另一种保留了部分内含子2作为隐性外显子(Survivin-2B)(图3).2种序列的变化使其编码蛋白的结构也有显著差异, 包括对BIR区的结构修饰.通过转染实验研究2种剪接变构体对凋亡的调控, 显示Survivin-△Ex3保留了抗凋亡特性, 而Survivin-2B的抗凋亡能力明显降低, 其原因可能是Survivin-2B获得的外显子改变了BIR功能域.人类Survivin基因定位于染色体17q25, 靠近端粒, 包含4个外显子和3个内含子, 全长14.7 kb, 转录产物为1.9 kb.Survivin蛋白是IAP家族中最小的成员, 仅由142个氨基酸残基构成, 分子量只有16.5 ku.结构上与其他IAP蛋白略有不同, Survivin蛋白只包含2个特定的结构: N-端含有一个单拷贝的BIR结构域, 并且存在一个由Cys-Pro-Thr三氨基酸组成的插入片段, 将BIR结构域分成2个二等分的模块, 这一插入片段是Survivin所特有的, 其他潜在重要性目前尚不清楚, 具体功能还有待进一步研究.该BIR区域可以通过抑制Caspase-3和Caspase-7的前体或直接抑制Caspase-3和Caspase-7本身的活性来发挥抗凋亡作用.BIR结构中心是一个由3条反平行的肽链组成的β片层(与XIAP的BIR2相似, 中心都是大β片层), 周围是4个短α螺旋.BIR结构中心的β片层面积大, 富含酸性氨基酸, 是Survivin蛋白配体结合区域, 当该区域被磷酸化后, 表面电荷更多, 与配体结合能力更强.在β片层中残基Thr34-Pro-Glu-Arg被认为是CDK结合位点.突变体T34A失去抗凋亡功能.BIR另一个特点是Zn2+处于Survivin蛋白BIR单拷贝上的Cys57、Cys60、His77和Cys84构成的四面体内, 以配位键将此4个氨基酸残基连结.这个结构对Survivin蛋白抗凋亡功能很重要, 因为研究发现, Survivin蛋白突变体C84A(Cys84突变为Ala84)不具备抗凋亡功能, 而Pro26突变为Ala或Leu64突变为Ala则功能正常.Survivin蛋白另一个显著特点是C-端是由42个氨基酸的高电荷区所形成的疏水α-螺旋卷曲结构(coiled coil)-α6.α6 长约65 A (1 A = 10-10 m), 由C端40个残基组成, 有11圈螺旋, 靠近BIR的4圈螺旋与BIR通过氢键和疏水键连结, 形成空间相对固定的稳定结构, 剩下的7圈螺旋远离BIR.C端α螺旋上的残基126-142构成C端疏水域, 调节Survivin与纺锤体上的γ微管蛋白结合.C端不包含IAP家族其他成员所具有的环指结构, 该结构具有蛋白泛肽化降解信号的作用.研究发现Survivin蛋白单体结合成蝴蝶结样的对称二聚体, 这种二聚体化是Survivin抗凋亡功能所必需的.两个Survivin蛋白通过BIR相互聚集, 两边的α6形成110°夹角, 这就使二聚体有一个弧形的、广阔的结合空间.二聚体内部单体之间的结合也很有趣, 在结合部位两侧残基94-99形成分子间β片层结构.由于Survivin蛋白单体和二聚体的稳定性以及抗凋亡功能的不同, 二聚体连结处也是干扰Survivin蛋白功能的靶点之一.Survivin蛋白与中心粒微管蛋白的结合对于Survivin蛋白发挥抗凋亡促增殖作用也是必须的, 切断C端α螺旋上的残基126-142, 虽然二聚体仍然可以形成, BIR也正常折叠, 但是Survivin蛋白无法定位于中心粒, 无法使CDK4(周期蛋白依赖性蛋白激酶)、P21和Caspase-3在微管组装中心聚集, 从而失去调控凋亡和细胞周期的功能.在Survivin的启动子区5'端缺少典型的TATA序列, 而是含有一个典型的CpG岛结构.在外显子1的上游大约200 nt处有GC富集区.启动子区含有2个AP2位点、3个NF-κB位点和1个Sp1位点, 大约60-80%人和鼠Survivin基因的转录依赖于Sp1位点的完整性.该区还有3个细胞周期依赖元件(cell cycle-depenent elements, CDEs)和一个细胞周期基因同源区(cell cycle gene homology region, CHR).其中-51区的CHR和-57区的CDE对Survivin调控细胞周期很重要.CDE盒的缺失使Survivin基因的细胞周期依赖性表达消失, 影响细胞的生存和导致肿瘤的发生.另外, 经序列分析发现, Survivin在Thr21, Ser88和Thr127含有3个蛋白激酶C(PKC)磷酸化作用点, 在Thr48和Thr97有两个酪氨酸蛋白酶作用点, 在Ser81有一个蛋白激酶A(PKA)作用点, 这些特殊位点在调节细胞凋亡中的作用还有待进一步研究.与其他IAPs不同, Survivin基因表达不受TNFα/NF-κB信号转导系统的影响[12-14].
Survivin严格以细胞周期(G2/M期)依赖性方式高表达.并通过与有丝分裂纺锤体结合而发挥抗凋亡作用.进一步研究发现这种表达调控主要发生在转录水平, 由位于Survivin基因-6, -12, -171的序列GGCGG以及-42的ATTTGAA)进行调控.这些区域是调节G2/M期细胞周期依赖性基因表达的媒介.在Hela细胞的实验研究发现Survivin在G1期的表达基本检测不到, 在S期细胞的表达增加6倍, 而在G2/M期的表达则超过了40倍.一旦失去以上顺式作用元件的Survivin基因在G2/M期的表达同G1期无显著差异.随着细胞周期的运动, Survivin蛋白的表达调控与亚细胞定位也发生相应改变.在分裂间期, Survivin蛋白定位于中心粒, 分裂前期、中期定位于着丝粒; 后期定位于赤道板(midbodies), 末期又定位于中心粒.进一步研究发现: 在分裂间期, Survivin蛋白主要与中心粒表面的γ微管蛋白结合, γ微管蛋白的主要功能是与α, β-微管蛋白异二聚体中的β亚单位结合, 使微管在临近细胞核的特定区域即微管组装中心(MTOC)形成.以上Survivin蛋白的表达调控与亚细胞定位研究提示Survivin蛋白的功能可能是使细胞周期能够顺利得以进行的必要条件, 而且他在细胞内可能参与中心体的装配, 在细胞周期纺锤体组装检查点(spindle assembly checkpoint)机制中发挥重要功能.与其他的IAPs在各种正常成人组织中的广泛表达不同, 不同组织仅仅表现为表达水平的差别, 生理状态下, 在成人除子宫内膜组织、胎盘和胸腺组织中发现存在不同程度的Survivin基因表达外, 大多数组织, 如正常分化成熟组织具有高增殖指数的细胞区域, 如皮肤基底层的角质形成细胞、肠腺窝上皮细胞和正常骨髓细胞, 均检测不到Survivin基因表达, 相反通过原位杂交和蛋白印迹实验提示, 14-21 wk的胎儿中Survivin在不同部位(肾小管、肺腺泡、胰腺、子宫内膜腺、表皮、胸腺髓质、脊索神经元)的组织中均可以明显检测到, 这表明Survivin基因在人类发育过程中起着某些重要作用.研究显示绝大多数人类恶性肿瘤细胞和组织中均存在Survivin表达, 这一普遍分布现象表明Survivin在癌症中可能处于失控的表达状态[15-18].
6.1.1 Survivin蛋白在神经胶质瘤的表达: Adida et al[19]用免疫组化分析了成神经细胞瘤survivin的表达情况以及阳性表达与临床预后、临床分级、组织学分类的关系.选取了72例成神经细胞瘤病例, Survivin阳性表达率为47%(34/72).组织学形态较差组的Survivin阳性表达率较高, 为73.9%(17/23), 而组织学形态较佳组Survivin阴性率较高, 为60%(15/25).2例自发消退的成神经纤维瘤Survivin表达均为阴性.认为suvivin的表达和成神经细胞瘤的恶性程度正相关, 也和肿瘤的组织形态有关.
6.1.2 Survivin蛋白在非小细胞性肺癌(NSCLC)的表达: Monzo et al[20]用RT-PCR方法分析83个NSCLC标本, 发现71例(85.5%)肿瘤标本阳性.12例表达阴性的病例比71例表达阳性的病例在生存时间上有明显差异, 即Survivin表达阴性患者预后明显好于表达阳性者.但Survivin表达和年龄、性别、吸烟、肿瘤大小、淋巴转移和病理组织学之间无明显关系.
6.1.3 Survivin蛋白在乳腺癌的表达: Tanaka et al[21]用免疫组化法显示, 167例Ⅲ期乳腺癌中Survivin阳性表达118例(70.7%), 而癌旁组织表达均为阴性.Survivin表达阳性的乳腺癌与Survivin表达阴性的乳腺癌相比, 前者凋亡率是0.62±0.52%, 显著低于后者1.27±1.37%(P<0.0001), 提示survivin的表达可以作为预后较差的标志.在乳腺癌组织中, Survivin基因的表达与Bcl-2基因的表达及凋亡指数的下降具有高度相关性, 由于Survivin与Bcl-2分别作用于凋亡通路的不同点, 对凋亡抑制可以产生协同作用, 因此二者的同时表达提示肿瘤预后不良.而Survivin表达与年龄、绝经状况、肿瘤大小、临床分期、淋巴结转移、ER状况、静脉侵犯、肿瘤组织学类型和复发均无显著关系.
6.1.4 Survivin蛋白在消化系统肿瘤的表达: Lu et al[22]用免疫组化分析了174例Ⅰ-Ⅲ期胃癌, 其中60例(34.5%)阳性, 癌旁正常组织均无表达.Survivin表达阳性的胃癌与Survivin表达阴性的胃癌相比, 凋亡率明显降低.在胃癌中, 癌细胞胞核Survivin阳性与良好预后、发病年龄小、血管侵犯发生率低有关, 但胞质阳性与肿瘤进展或预后无相关性, 提示Survivin在胃癌细胞核中的表达在阻止肿瘤进展上可能有一定的作用, 但Survivin表达阳性与肿瘤大小、浸润深度、淋巴结转移均无显著关系.Kawasaki et al[23]报道了Survivin在结直肠癌的表达情况, 其中91例(53.2%)阳性, 癌旁正常组织均无表达.Survivin表达阳性与肿瘤大小、深度、淋巴管或静脉侵犯、淋巴结转移、组织学分级、Duke's分期、癌肿复发均无显著关系, Survivin的表达上调与直肠癌凋亡指数下降、总体存活率缩短、预后不良和复发率增加有关, 在Ⅱ期结、直肠癌患者中, Survivin表达阳性患者根治术后5 a生存率明显低于表达阴性者, 可以作为预后不良的重要指标, Kawasakiza et al[24]在另一项研究中指出结直肠癌中Survivin表达与P53无明显相关性.并且在大肠腺瘤轻度不典型增生至高度不典型增生直至癌的演变过程中, Survivin表达逐渐增加, 其中高度增生不良腺瘤Survivin的阳性率与腺癌无明显差异.其表达不仅与凋亡指数负相关, 而且与增殖指数和微血管密度成正相关.Ikeguchi et al[25]研究指出Survivin阳性的肝癌患者5 a无病生存率(19%)明显低于其阴性患者(39%), 而且57%的肝癌复发患者有Survivin表达, 提示Survivn 的表达可作为肝细胞癌患者独立的预后因子.
6.1.5 Survivin蛋白在泌尿系统肿瘤中的表达: 我们知道目前临床用于检查膀胱癌的方法是膀胱镜检和尿细胞学检测.前者具有侵入性、不适感, 且价格贵的缺点, 而后者检测特异性虽高, 但敏感性却只有40%-60%、尤其在低分化病变中更低.Smith et al[26]对158例尿液研究发现仅在膀胱癌患者尿液中可检测出Survivin.膀胱癌患者尿中检测出Survivin, 可能与膀胱移行细胞癌细胞易脱落到尿中有关.在大规模病例中检测尿液Survivin蛋白的表达证实该方法诊断膀胱癌的敏感性为100%, 特异性为95%, 为膀胱癌诊断提供了一个简单、非侵入性的检测手段.Swana et al[27]利用免疫组化法研究36例膀胱癌Survivin表达, Survivin总阳性表达率为78%(28/36), 其中Ⅰ级膀胱癌阳性表达率65%(13/20), Ⅱ级90%(9/10), Ⅲ级100%(6/6), 而正常膀胱黏膜无表达.同时膀胱癌由于其80%的复发率而很难治愈, 一项相关研究发现膀胱癌Survivin表达与肿瘤复发有关.在Ⅰ级膀胱癌患者中, 不表达Survivin的患者复发间隔为35.5±16.2 mo, 而表达Survivin的患者复发间隔为10.5±6.2 mo, 二者有显著性差异(P<0.001), 说明Survivin的表达与膀胱癌的复发密切相关, 而在该实验中, 包括Bcl-2及p53的表达在内, 没有任何其他的分子指标能表现出类似的预后作用.Takamizawa et al[28]在对小儿肾癌的研究中发现Survivin表达均较正常肾组织高, 其中初发性肾癌Survivin阳性表达率为18%, 复发性肾癌为50%.
6.1.6 Survivin蛋白在生殖系统肿瘤的表达: Hattori et al[29]检测Survivin在卵巢癌表达, 其阳性率约为86%, 研究发现Survivin在卵巢透明细胞腺癌的表达水平比卵巢浆液性腺癌高, 并且前者原发灶的Survivin水平高于转移灶, 但后者无此现象, 提示Survivin的表达影响卵巢透明细胞腺癌和浆液性腺癌的进展.此外Saitoh et al[30]检测了34株宫颈癌细胞株和25例宫颈癌标本以及2株子宫内膜癌细胞株和17例子宫内膜癌标本, 结果发现, 所有细胞株和标本均有survivin表达, 并与凋亡指数的下降密切相关, 表明Survivin的抗凋亡作用参与了宫颈癌的发生及发展过程.
6.1.7 Survivin在淋巴造血组织系统肿瘤的表达: 在100%的急性骨髓白血病(AML)的细胞株可检测到Survivin表达, 相反经过全反视维甲酸处理明显降低HL-60, OCI-AML3, MB-4细胞的Survivin水平, 表明Survivin在骨髓白血病高表达并受全反视维甲酸的抑制.Survivin在50-60%高度恶性非霍奇金淋巴瘤有表达, 而在低度恶性非霍奇金淋巴瘤无表达.Adida et al[31-32]用免疫组织化学方法研究弥散性大细胞淋巴瘤, 发现60%的患者有survivin蛋白表达, 在阳性组, 5 a生存率低于阴性组, Survivin可作为弥漫性大细胞性B细胞淋巴瘤(DLBCL)预后的参考指标.
6.1.8 Survivin在其他系统与组织肿瘤及癌前病变的表达: Grossman et al[33]研究指出在皮肤肿瘤中有81%基底细胞癌、92%鳞状细胞癌、所有鲍温氏病和HAK(hypertrophic actinic keratosis)有Survivin表达, 提示Survivin可能参与了基底细胞癌和鳞状细胞癌的发病和进展.该作者用免疫组化检测30例恶性黑色素瘤时发现, 转移者的15例均为阳性, 浸润者的15例中有13例阳性.癌灶附近的正常黑色素细胞或其他正常细胞均为阴性.Koch et al[34]发现所有嗜铬细胞瘤和副神经节瘤均有Survivin的表达, 但尚不足以作为鉴别良性和恶性嗜铬细胞瘤和副神经节瘤的可靠指标.此外Survivin蛋白还被发现存在于结肠息肉、乳腺炎、角化皮炎等一些癌前损伤组织中, 这提示Survivin的表达出现在恶性转化前期, 可能具有促进这些损伤恶性转化的作用.以上研究均表明Survivin高表达于恶性肿瘤, 可作为肿瘤诊断和预后的一个有价值的指标.肿瘤细胞表达Survivin除了可以使肿瘤血管内皮细胞对化疗药物产生抵抗不至于受化疗药物诱导的凋亡的影响, 同时研究发现Survivin的表达可被血管内皮生长因子(vascular endothelial growth factor, VEGF)上调, 有研究[35]用血管内皮细胞生长因子、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)以及血管形成素1(angiopoietin-1)等有丝分裂原刺激静息的内皮细胞, 可以诱导Survivin的表达上调10-19倍之多.有丝分裂原还可刺激培养的内皮细胞Survivin表达快速增加, 在6-10 h即达高峰.提示Survivin蛋白在肿瘤血管形成过程中的表达可能对肿瘤细胞的浸润、迁移起重要作用.因此, 可以认为Survivin是一种癌基因在肿瘤组织中高表达而参与肿瘤的发生和发展.
6.2 Survivin的生物学功能及其在肿瘤细胞中的作用机制
Survivin蛋白同时具有共同调控细胞周期和细胞凋亡的双重功能[36-43].首先Survivin对于细胞周期的调控方面: 细胞周期的运动受细胞周期调节因子的控制, 在肿瘤细胞中一方面是由于细胞周期正调控因子过表达, 如周期蛋白(Cyclin, 主要是Cyclin D1, Cyclin E1)和周期蛋白依赖性蛋白激酶(cyclin dependent kinases, 主要是CDK4, CDK6).CyclinD的主要功能是激活CDK4、CDK6, 使细胞渡过G1期进入S期.另一方面是细胞周期负调控因子低表达, 如细胞周期蛋白依赖性激酶抑制蛋白(cyclin-dependent kinase inhibitor, CKI, 主要INK4, KIP1).CKI通过与CDK结合, 抑制CDK的活性, 阻止细胞增殖分化.如P21蛋白可以抑制增殖细胞核抗原(proliferating-cell nuclear antigen, PCNA)而抑制CDK的促进作用.细胞周期运动的过程实际上是细胞增殖的过程.在这一过程中, 细胞核型和体积也随之发生变化.对于那些具有快速增殖特点的细胞, 对细胞周期负调控因子(P21蛋白)进行抑制是必须的.有丝分裂开始时, Survivin与有丝分裂纺锤体的微管蛋白特异性结合, 维持有丝分裂的进行, 此反应过程受微管动力学的调节.研究表明, 无Survivin表达的细胞可形成卵裂沟和收缩环, 但不能完成正常的细胞质流动过程, 因此导致多核细胞的形成.Survivin和INCEN(inner centromere protein)在微管组装、卵裂沟形成、细胞质流动等协同事件中发挥重要作用.Survivin并可通过与CDK4/p16(INK4a)和CDK2/cyclineE复合体活化的竞争性作用来启动细胞周期.我们知道所有生物的生长和发育都离不开细胞忠实地繁殖, 要实现这一点要求细胞基因组必须能够精确地复制, 并且在两个子代细胞中均匀分配.Survivin 主要在G2/M期表达, 具有严格的细胞周期依赖性.G2/M期控制点负责保持遗传的准确性, 如果增殖细胞的DNA复制不能与中心体的加倍相一致就会不可避免地出现细胞倍型的改变, 产生多核现象, 从而造成染色体核型的改变, 而后者在癌细胞中是很常见的.这种染色体的改变导致其不稳定, 使已经突变的肿瘤抑制基因的表型表达或使癌基因过表达, 即Survivin有助于肿瘤细胞逃离G2-M期检控点而达到无限增生, 从而促使肿瘤的发生.
Survivin可能除了参与细胞有丝分裂在微管系统中起重要作用, 而且他还参与胞质分裂.近年来Survivin与细胞分裂的关系以及Survivin亚细胞定位问题日益受到人们重视.我们知道Aurora B是最先被发现的参与调节纺锤体微管两极与着丝粒的连接的蛋白, 功能是调节染色体的分离和胞质分裂.Wheatley et al[39,43]人采用酵母双杂交实验检测获得了Survivin与Aurora B和内部着丝粒蛋白INCENP直接结合的证据, 并且发现这种结合异常稳定, 同时发现Aurora B的激酶活性受Survivin的结合和细胞周期依赖的磷酸化调节.又有研究提示Survivin在细胞周期中能刺激Aurora B的激酶活性, 帮助Aurora B正确的与其底物结合, 这可能是Survivin发挥其功能的机制.Survivin基因缺失小鼠的表型: 在胚胎开始发育的前3.5 d可造成微管集群的严重缺损、有丝分裂纺锤体的缺陷、多核细胞的大量产生及在4.5 d发生胚胎致死性变化.Terada et al[38]认为Survivin可能是染色体过客蛋白(passenger protein), 染色体过客蛋白是指那些在细胞分裂过程中从着丝粒转移到纺锤体赤道面的蛋白, 他们在细胞分裂中参与染色体的浓缩和分离, 在有丝分裂结束时, 参与胞质分裂的完成.认为Survivin在分裂中期定位于染色体的着丝粒, 而后期处于中心纺锤体的中间带上, 在细胞分裂时又在中间体上, 即是一种过客蛋白.近来研究对于有丝分裂点处抗凋亡路径的潜在进化来源提出了一些令人感兴趣的线索.在线虫封闭与Survivin同源的IAP分子BIR-1导致了胚胎致死性表型.这可能并不是由于凋亡调节的紊乱, 而是由于胞质分裂缺陷所致, 胚胎不能完成细胞分化造成了多核细胞的堆积.上述表型通过人Survivin过表达部分得到逆转, 提示了这个机制具有很强的进化保守性.占优势的Survivin在细胞内与中心体结合, 提示Survivin可能参与胞质分裂.近来几个实验室正在做一系列实验, 若封闭了其他IAPs包括Survivin, 除了引起自发凋亡外是否也可见到胞质分裂缺陷[41].
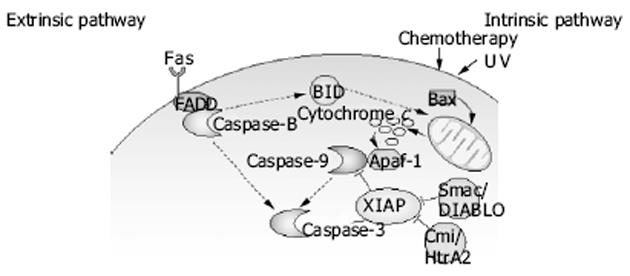
Survivin蛋白对于细胞凋亡的调节, 大致来说有两种途径--外源性途径和内源性途径.外源性凋亡途径又称死亡受体途径, 是通过细胞膜上的死亡受体(如TNF受体、Fas)激活, 使细胞发生凋亡, 该途径的启动酶是Caspase-8; 内源性凋亡途径又称线粒体途径, 该途径的启动酶是Caspase-9, 执行酶是Caspase-3.具体是DNA损伤信号通过Bcl-2家族提高线粒体膜的通透性, 使线粒体释放出促凋亡的细胞色素C, 后者与前体Caspase-9、Apaf-1组成凋亡体, 导致前体Caspase-9激活, 分解死亡底物, 完成细胞凋亡过程.处于凋亡途径的下游阶段.Survivin蛋白主要通过抑制前面提到的Caspases-3, 7.Survivin还作用于细胞周期调节因子CDK4, 使CDK2/cyclin E活化并使Rb磷酸化.Survivin/CDK4复合物的形成, 使p21从p21/CDK4复合物中释放出来, 一方面使细胞周期免受P21蛋白的抑制.另一方面作用于procaspase-3, 形成procaspase-3/p21复合物, 抑制procaspase-3激活, 我们知道caspase-3是死亡受体途径及线粒体途径介导的凋亡过程中必需的死亡因子, 处于凋亡途径的下游阶段, 因此Survivin得以发挥其抗凋亡作用, 同时Survivin过度表达使得P21解离而使活化Cdk4, 细胞进入增殖周期.细胞失去了正常增殖周期中凋亡"开关"(checkpoint)的限制, 大量细胞无限增殖, 增殖与凋亡平衡打破, 造成凋亡减少, 最后导致肿瘤的发生.就Survivin蛋白是否与Caspase-3直接发生相互作用仍还存在着争议.反对者认为, 与XIAP的BIR2相比, Survivin蛋白没有N端环状结构, 而此结构正是XIAP抑制Caspase-3的关键部位, 且实验中发现Survivin蛋白与Caspase-3无直接关系.另有实验表明Survivin抗凋亡作用也可抑制Caspase-9而实现的.在果蝇的研究中证实Survivin可以通过与SMAC相结合, 抑制SMAC拮抗IAP而发挥抗凋亡的作用.
Survivin在有丝分裂中的作用: 有丝分裂前期Survivin与纺锤体微管相结合, 在分裂的中后期, 与纺锤丝全长捆绑, 直到分裂末期依附于中心体上.通过体外共沉淀试验, 这一独特的现象被定量观察.研究发现, 在连续的微管的聚合和解聚过程中, 重组Survivin与聚合微管以一种特殊的、浓度依赖的、可饱和的方式相结合, 这一反应通过微管力学来调节.在分裂间期细胞, Survivin积聚在中心体上, 因此Survivin可能是微管组织中心的元件.Survivin与微管相结合对于其抗凋亡功能的实现是必需的.在诱变实验中, 缺少C末端带电荷的卷曲螺旋状结构和截短的Survivin在体外均不能与泰素和聚合微管竞争性结合, 在体内亦不能与转染细胞的有丝分裂纺锤体结合.上述Survivin突变体的过表达不能保护泰素介导的NIH3T3成纤维细胞的凋亡, 这些研究提示Survivin装配在有丝分裂装置上, Survivin末端带电荷的螺旋区是其抗凋亡功能所必需的.可见Survivin不仅通过与下游凋亡效用因子Caspase-3和Caspase-7结合对其活性产生直接抑制效应, 还通过与纺锤体纤维的结合, 间接抑制Caspase对纺锤体的水解作用, 有利于保护有丝分裂细胞器的完整性, 抑制细胞凋亡.
总之, Survivin具有控制纺锤体检查点和凋亡检查点双重作用.肿瘤组织过表达Survivin可以避开凋亡检查点, 使细胞进行异常的有丝分裂.同时Survivin的过表达对抗多种广泛的凋亡诱导因素, 如化疗药物足叶已甙和泰素和放疗所引起的凋亡.由此可以理解Survivin高表达的肿瘤对于临床放化疗均不敏感的分子机制.
6.3 Survivin是肿瘤治疗的新靶点[
44]
细胞凋亡是化疗和放疗介导杀伤肿瘤细胞的主要机制, 抑制细胞凋亡从而促使肿瘤细胞的存活力增强是肿瘤细胞的共同特征.肿瘤细胞对凋亡的抑制有利于逃避机体的免疫监视及细胞毒性药物治疗进而产生对化疗药物耐药, 是肿瘤形成、发展和对化疗药物耐药的重要机制.其耐药机制除了肿瘤细胞能过度表达mdrl编码的P糖蛋白增加化疗药物排除, 还在于能抵抗药物诱导的凋亡, 即哺乳动物细胞内存在IAPs, 在肿瘤细胞中这些凋亡抑制蛋白水平升高显然是肿瘤形成、发展和对化疗药物耐药的重要机制之一.由于Survivin在肿瘤组织中选择性高表达, 抑制Survivin足以诱导肿瘤细胞自发性凋亡, 这是其他抑制凋亡的基因所不具备的特点, 我们知道Bcl-2基因是通过阻止细胞色素c从线粒体向胞质释放而抑制凋亡作用, 这一环节处在Caspase级联反应上游.而Survivin基因是通过直接作用于细胞凋亡途径中的终末效应酶-Caspase-3, 7来发挥作用的.而且抑制bcl-2只能提高细胞对凋亡的敏感性, 但不足以诱导凋亡, 因此Survivin已经成为倍受关注的抗肿瘤治疗的新靶点.以Survivin蛋白为靶点的拮抗分子纷纷研究出来, 如应用反义Survivin降低细胞凋亡的阈值, 促使肿瘤细胞凋亡增加、RNA干涉Survivin基因的表达、设计Survivin突变体以及特异性抗体免疫治疗, 这些策略具有良好的靶向性、特异性及安全性.
6.3.1 反义Survivin的寡核苷酸: Ambrosini et al[45]首先将具有反义Survivin功能的EPR-1 cDNA置于金属硫因(metallthionein)诱导的启动子下游, 转染Hela细胞, 结果与对照载体相比, 在稳定的转化细胞中, Survivin反义核酸的表达能够快速诱导细胞凋亡, 同时伴有靶细胞增殖的下降.Olie et al[46]设计反义Survivin寡核苷酸对肺腺癌细胞株的作用, 发现Caspase-3活性提高, 凋亡细胞增加以及腺癌细胞对化疗药物敏感性增加.Mesri et al[47]利用Survivin反义寡核苷酸作用于人脐静脉内皮细胞, 发现Survivin反义寡核苷酸能诱导毛细血管网迅速退化.VEGF在肿瘤血管中的抗EC凋亡作用主要是通过诱导EC的Survivin表达来完成的.反义Survivin治疗可特异性抑制VEGF抗EC的凋亡作用, 而EC移行作用不受影响, 从而促进肿瘤EC凋亡和肿瘤血管退化.
6.3.2 Survivin显性负突变(dominant-negative mutant)体诱导细胞凋亡: Survivin的多肽序列中, 34位氨基酸为苏氨酸, 是细胞周期素依赖蛋白激酶P34-cdc2的磷酸化位点, 该位点的磷酸化对维持Survivin的凋亡抑制功能非常重要, 以丙氨酸取代后的人工突变体(T34A)可以使凋亡抑制功能丧失, Mesri et al[48]发现, PAd-T34A(复制缺陷的腺病毒携带编码Survivin突变体)感染乳腺癌、宫颈癌、前列腺癌、肺癌、大肠癌等细胞株, 导致细胞色素C从线粒体释放, 促进caspase-3活化引起肿瘤细胞凋亡, 而PAd-T34A不影响纤维母细胞、内皮细胞、平滑肌细胞等处于增殖状态的正常人类细胞的生存能力; PAd2T34A诱导肿瘤细胞的凋亡与紫杉酚一样有效, 而比阿霉素引起的肿瘤细胞凋亡的效能更强, 而且可以促进紫杉酚诱导的细胞凋亡作用, 裸鼠动物实验也进一步证实PAd-T34A可导致肿瘤体积的缩小.该研究同时显示PAd-T34A可以促进肿瘤血管内皮细胞的凋亡.Grossman et al[49]应用Survivin突变(T34A)的腺病毒转染多种黑色素瘤细胞株, 引起细胞自发性凋亡, 促进化疗药物顺铂诱导的细胞凋亡, 并且裸鼠动物实验也表明该突变体可以抑制接种黑色素瘤细胞株的免疫缺陷鼠肿瘤体积的增大.除了T34A Survivin突变体可以诱导细胞凋亡外, 另外还有C84A(Cys84/Ala)突变体, 他与野生型Survivin蛋白竞争中心粒, 抑制野生型Survivin蛋白与中心粒的结合, 从而剥夺野生型Survivin蛋白的抗凋亡促增殖的双重功能.最终导致细胞凋亡和细胞分裂缺陷, 出现多核细胞和多极点细胞.除了对Survivin-34位苏氨酸进行干预外, Li et al[50-51]将鼠的Survivin基因62位点的SP1结合区破坏后, G2/M期50%的转录活性被特异性抑制.而破坏169位点的SP1结合区, G2/M期转录活性几乎全被抑制.研究表明Survivin及bcl-2在肿瘤细胞内的大量表达都与SP1依赖转录调控有关.如能通过反义核酸手段来破坏肿瘤细胞内的SP1结合区, 可引起肿瘤细胞内包括Survivin和Bcl-2在内多种基因的表达异常, 必将导致肿瘤细胞走向凋亡.
6.3.3 免疫治疗: Survivin被认为是肿瘤相关抗原, 广泛存在于肿瘤中.当Survivin可溶性重组蛋白被树突状细胞(DC)呈递时, Survivin多肽和主要组织相容性复合体Ⅰ(major histocompatibility complex Ⅰ, MHCⅠ)形成的复合物能在体外诱导特异性CD8+细胞毒性T细胞, 从而杀伤肿瘤细胞, Pisarev et al[52-53]报道了相关的研究, 但临床价值还有待进一步证实.
6.3.4 RNA干扰Survivin的表达技术[54-56]: RNA干扰(RNA interference, RNAi)是指在生物体细胞内, 外源性或内源性的双链RNA(double-stranded RNA, dsRNA)引起与其同源的mRNA特异性的降解, 因而抑制Survivin基因的转录和表达, 具有高度特异性、高效性的特点.Li et al[54-56]利用RNA干扰技术设计针对Survivin的dsRNA来抑制Survivin基因的转录和表达, 实验取得一定的成功.总之, 以Survivin为靶点很可能是一种理想的肿瘤治疗策略.不但可以提高抗肿瘤疗效, 而且能弥补其他治疗措施的不足, 在临床肿瘤治疗中可能有广阔的应用前景.
总之, IAPs作为一种重要的细胞凋亡调节因子, 一方面发挥抑制细胞凋亡的功能, 另一方面该家族部分成员发挥其他与细胞凋亡不太直接相关的多种生物学功能, 如调节细胞周期和有丝分裂等.Survivin基因自从被发现后, 作为一种新的凋亡抑制因子引起国内外学者的广泛关注, 围绕Survivin的分子生物学特点、生物学功能, 特别是在细胞凋亡和细胞周期中的作用进行了一系列研究, 根据现有的资料, 其抗凋亡的作用及在肿瘤发生、发展中的作用已经逐步得到肯定.对于肿瘤的诊断、治疗、预后方面都有重要意义, 尤其在肿瘤基因治疗中可能有广泛的应用价值和前景.然而仍有许多关于Survivin的细节问题不清楚, Survivin如何实现对细胞凋亡和细胞周期的双重检测点的调控, Survivin细胞内定位的复杂性的具体环节, Survivin的选择剪接和剪接异构体又是如何调节细胞凋亡的? 这些问题均需要进一步研究和探讨, 为肿瘤的诊断和治疗奠定坚实的理论基础.