修回日期: 2005-04-28
接受日期: 2005-05-06
在线出版日期: 2005-07-15
目的: 克隆人脐静脉内皮细胞谷氧还蛋白(glutaredoxin, Grx)编码区的cDNA序列并进行序列测定, 构建原核表达载体并在大肠杆菌BL21(DE3)中表达.
方法: 从人脐静脉内皮细胞中提取总RNA, 采用RT-PCR技术, 获得该基因编码区的cDNA, 并重组入原核克隆表达载体pRSETA, 构建重组质粒pRSET-Grx, 通过菌落PCR筛选及限制性内切酶鉴定, 选择阳性克隆并测序.将测序正确的重组质粒pRSET-Grx转化大肠杆菌BL21(DE3), 用IPTG诱导表达.
结果: 将所得序列与GenBank提供的序列(NM002064)比较, 测出的序列在核苷酸序列上有一处碱基不同, 但在氨基酸序列上与已知序列一致.经IPTG诱导4-5 h后, 150 g/L SDS-PAGE 分析, 表达出Mr16000的蛋白.
结论: 从人脐静脉内皮细胞中成功地获得Grx编码区的cDNA, 成功构建了原核融合表达载体pRSET-Grx并获得表达.
引文著录: 张春晶, 周宏博, 邹朝霞, 董钦, 于海涛. 人谷氧还蛋白基因的分子克隆及表达. 世界华人消化杂志 2005; 13(13): 1558-1561
Revised: April 28, 2005
Accepted: May 6, 2005
Published online: July 15, 2005
AIM: To clone and sequence glutaredoxin (Grx) cDNA from human umbilical endothelium cells, and to express it in E.coli BL21 (DE3).
METHODS: The total RNA was extracted from human umbilical endothelium cells. Grx cDNA was obtained by reverse transcription polymerase chain reaction (RT-PCR), and then cloned into pRSETA vector to construct recombinant pRSET-Grx. The products were transformed into E.coli (JM109). The positive transformant was identified by bacterium-specific PCR and digestion of restriction endonucleases. The positive clones were purified and sequenced, then transfected into E.coli BL21 (DE3). The expression of Grx was induced by IPTG.
RESULTS: Compared the cDNA sequence we obtained with that in GenBank (NM002064), there was one difference in the base pairs, but the amino acid sequence was identical. The recombinant Grx was expressed after induced by IPTG for 4-5 hours, and the apparent Mr16000 were confirmed by 150 g/L SDS-PAGE.
CONCLUSION: Recombinant human Grx gene was successfully cloned and expressed in E.coli.
- Citation: Zhang CJ, Zhou HB, Zou CX, Dong Q, Yu HT. Molecular cloning and expression of human glutaredoxin gene. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1558-1561
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1558.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1558
谷氧还蛋白(glutaredoxin, Grx), 又称巯基转移酶(thioltransferase), 是广泛存在于原核、真核生物中的一种小分子蛋白质, Mr11800[1].Grx是一种多效性细胞因子, 具有多种生物学功能, 如核糖核苷酸还原酶的辅酶、脱氢抗坏血酸还原酶活性、参与氧化应激作用、抗凋亡作用等[2-4].日前, Grx在体内具有广泛的抗氧化作用已很肯定.Grx系统参与维持细胞的氧化还原状态, 提供细胞质内的还原环境; Grx系统对活性氧导致的细胞氧化应激损伤有阻抗和治疗的作用, 即Grx可通过恢复细胞中一些含有半胱氨酸残基的抗氧化蛋白和转录因子的活性来阻抗氧化应激损伤[5].另外Grx的抗氧化作用还表现在他的基因表达在细胞受到氧化应激之后增加, 目前已经有Grx在心血管疾病、脑血管疾病、白内障等病理状态下高表达的报道[6-9].由此可见, Grx的清除自由基和抗氧化作用, 使其在治疗心脑等器官缺血再灌注损伤性疾病上有重要价值.Grx因其能作为一种自由基清除剂减少自由基对组织细胞的损伤, 近年来已成为国际上研究的热点.由于脐静脉内皮细胞是心血管系统中受氧化应激作用的第一层屏障, 易受到氧化应激损伤, 而脐静脉内皮细胞中Grx的克隆表达及是否参与氧化应激调控作用的研究尚属空白.因此我们根据GenBank提供的人Grx编码区的cDNA序列, 应用RT-PCR方法成功克隆获得人脐静脉内皮细胞Grx编码区cDNA基因, 并进行了序列测定分析和初步表达, 为进一步研究Grx的功能及其与氧化应激的关系奠定了基础.
人脐静脉内皮细胞(ECV304), 购自中国典型培养物保藏中心; Trizol, RNA提取Kit, 限制性内切酶RT-PCR试剂盒(逆转录酶Kit), T4连接酶, 快速连接TM试剂盒, Tag酶, pRSETA载体购于Invitrogen公司; DNA MarkerX174, DL15 000, 质粒提取Kit购自Promega公司; 小量胶回收试剂盒购自上海华舜生物工程有限公司; 大肠杆菌JM109和BL21(DE3)由本室储存; 引物由上海博亚生物技术公司合成.
按GenBank发表的人Grx基因开放阅读框(ORF)全长序列, 用Primer 5.0软件设计上游引物5'-CTGGATCCGGCATGGCTCAAGAGTT-3', 5'端设有BamHⅠ酶切位点; 下游引物5'-CGGAATTCGGGCCTG TTCTGTGGTTACTG-3', 5'端设有EcoRⅠ酶切位点.将人脐静脉内皮细胞按常规培养在含100 mL/L新生牛血清的RPMI1640培养基中, 于37℃, 含50 mL/L二氧化碳条件下培养, 当细胞生长旺盛并贴壁后, 0.2 g/L EDTA消化, 重新悬浮细胞接种于25 mL培养瓶中, 待细胞融合, 用于实验.按RNA提取Kit说明书操作, 得到总RNA, 并经15 g/L琼脂糖凝胶电泳鉴定.RT-PCR扩增按逆转录酶Kit说明书操作, 用锚定引物Oligo(dT) 20反转录合成第一条链.将所获得的cDNA片段, 置-20℃或-70℃冻存备用.取逆转录产物进行常规PCR扩增, 扩增参数为94℃, 2 min; 94℃, 30 s; 57℃, 30 s; 72℃, 45 s; 30个循环后, 72℃延伸10 min.琼脂糖凝胶电泳分析RT-PCR结果.
将扩增的PCR产物用限制性内切酶BamHⅠ和EcoRⅠ双酶切后, 用小量胶回收试剂盒回收.将质粒pRSETA双酶切后的回收产物做CIP处理并回收.然后按载体: 目的基因 = 1∶3连接线性质粒载体pRSETA和人Grx基因片段.连接产物转化用CaCl2法制备的感受态E.coli JM109细胞, 并将转化菌涂在含有Amp+的琼脂糖平板上, 37℃倒置培养.挑取单克隆菌落培养, 先经PCR鉴定再提取质粒DNA用限制性内切酶BamHⅠ, EcoRⅠ双酶切鉴定.将含有重组质粒的菌液送到上海生工生物工程技术服务有限公司进行目的基因单项序列测定.把构建得到的重组pRSET-Grx质粒转化到宿主菌BL21(DE3)上, 在100 mg/L的LB培养基中, 37℃倒置培养, 在OD600达到0.7时, 加入IPTG至0.5 mmol/L, 并在37℃诱导4-5 h, 以150 g/L SDS-PAGE鉴定表达产物.
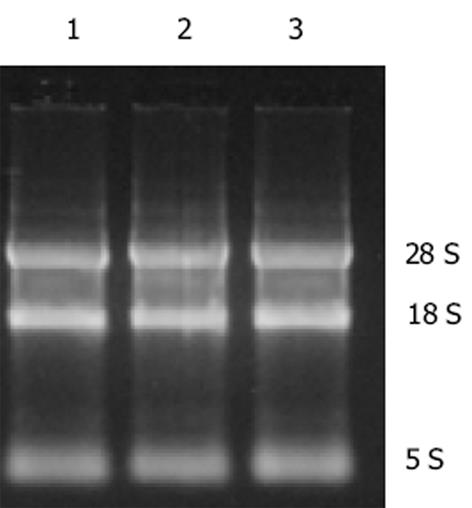
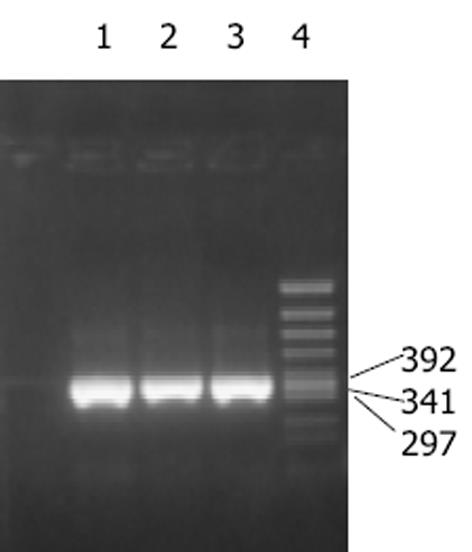
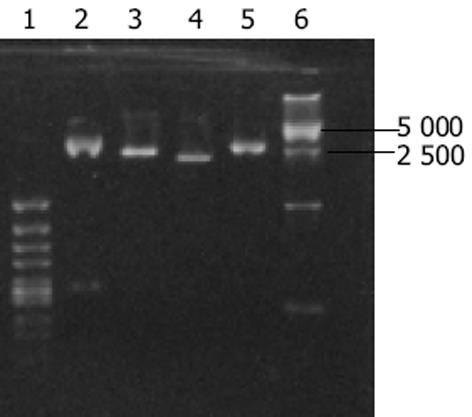
根据核糖体RNA的电泳条带判断RNA的提取质量.图1中可见28S和18S RNA 条带亮度显示抽提的总RNA纯度很高.28S∶18S = 2∶1, 表明RNA无降解, 并利用核酸计算器测得A260/A280 = 1.85, 浓度为162 g/L.PCR产物经15 g/L琼脂糖凝胶电泳, 并以PCR Marker(X174)为分子标准参照物, 可见PCR产物约在392bp和341 bp之间(图2), 与预期370 bp的目的片段位置基本一致.克隆构建的重组质粒命名为pRSET-Grx.理论上重组质粒应为3 230 bp, 双酶切可得到2 860 bp, 370 bp两个片段.采用PCR方法扩增阳性克隆后双酶切鉴定, 15 g/L琼脂糖凝胶电泳(图3)显示, BamHⅠ, EcoRⅠ双酶切后重组质粒切出两条带, 切出片段大小均与理论值相符, 系阳性克隆.
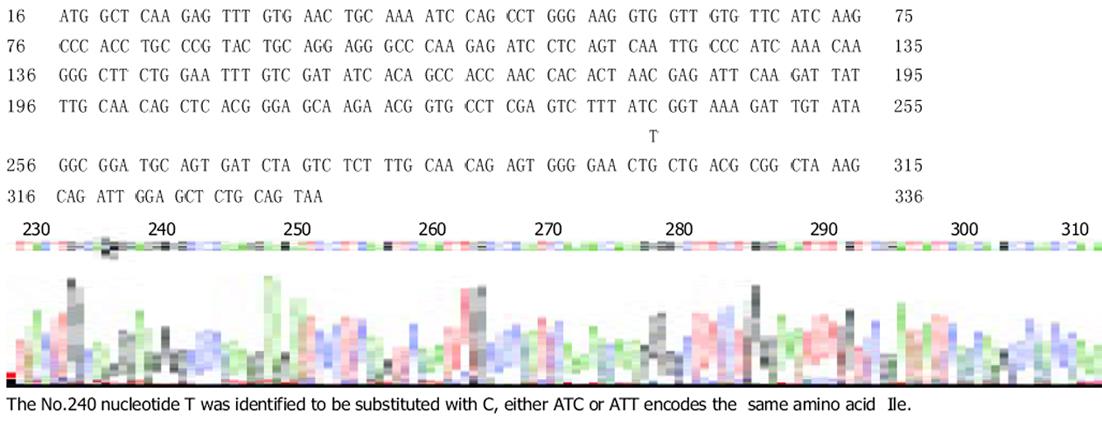
测定的基因序列长370 bp, ORF为320 bp, 部分序列测序图谱结果见图4.用Dnasis和Pmsis软件程序与GenBank Data Base中发表的人Grx基因序列进行同源性分析比较, 同源性为99.7%, 碱基序列只有1处不同, 即240T-C(前者为人皮肤细胞Grx基因), 但相应氨基酸序列(Ile)没有发生改变.
将筛选的重组克隆子转化大肠杆菌BL21(DE3), 获得重组表达菌株, 经0.5 mmol/LIPTG, 37℃诱导培养4-5 h, 其150 g/L SDS-PAGE结果(图5)可见, 表达产物的Mr16000.由于人的谷氧还蛋白含107个氨基酸, Mr11800, 由于pRSET-Grx表达载体5'端带有用于表达蛋白纯化的多聚His标签, 维持目的基因稳定转录的T7噬菌体基因10起动子、用于表达抗体检测的抗原决定基因及肠激酶裂解识别位点等标记, 因此谷氧还蛋白的融合蛋白的Mr15840, SDS-PAGE结果与理论值相符.
由于血管内皮细胞具有复杂的生物学功能, 在国内外医学界逐渐引起重视, 目前研究最多的是脐静脉内皮细胞.血管内皮细胞具有活跃的分泌与代谢功能, 他在调节血管功能、维持心血管生理稳态中起着重要作用.血管内皮也是多种心血管疾病或危险因素作用的重要靶器官, 组成人体的脐静脉内皮细胞除受到内源性氧化应激损伤外, 还受到血液系统中的氧化性物质的作用.血管内皮细胞功能障碍时, 导致NO分泌异常, 与高血压、高血脂症、缺血再灌注的损害和动脉粥样硬化等许多心血管疾病的发生发展有密切关系[10].
有文献报道, 在活性氧引起的损伤中, 蛋白质氧化损伤先于核酸[11], 蛋白发生羰基化和糖基化, 从而失去生物活性.已有研究证明, 关于蛋白活性的修复, 除机体内小分子物质发挥作用外, 主要依赖于巯基-二硫键氧化还原酶家族, 而Grx是这个家族的重要组分[12], 他是利用GSH作为辅酶来催化体内氧化状态的蛋白质上的二硫键还原为巯基, 恢复蛋白质结构和功能, 修复蛋白质活性的抗氧化酶, 对维持体内稳定的氧化还原状态及对活性氧所导致的氧化应激损伤有阻抗和治疗作用[13].最近研究发现, Grx是机体内能特异、高效的还原谷胱甘肽化蛋白的一种酶蛋白[14-15], Grx特异的恢复氧化应激损伤产生的谷胱甘肽化蛋白活性的能力可能会使其成为热点药物.目前, 细胞内Grx抵御过氧化氢作用的研究国外已有很多报道[6-9], 但是关于Grx本身抵御过氧化氢作用的研究, 至今未见报道.因此, 该蛋白的原核克隆、高效表达及观察Grx保护细胞免受氧化应激损伤作用的研究, 将对于人类氧化应激相关疾病的预防和治疗有重要的意义.目前, 根据本研究的实验结果, 我们正在进行Grx的优化表达、纯化及体外抗氧化活性的研究, 以便为Grx生物学功能研究及今后的临床应用提供重要的理论依据.另外, 本实验经30个PCR循环, 370 bp的基因序列中有一处碱基与已知序列的不同, 是PCR过程中的错误参入还是人脐静脉内皮细胞中Grx编码区的cDNA序列就是如此, 还有待进一步论证.但本实验中出现的不同碱基没有影响氨基酸的排序, 因此, 即使是错配也不必去做更正.
编辑: 潘伯荣 审读: 张海宁
| 1. | Holmgren A. Hydrogen donor system for Escherichia coli ribonucleoside-diphosphate reductase dependent upon glutathione. Proc Natl Acad Sci USA. 1976;73:2275-2279. [PubMed] [DOI] |
| 2. | Daily D, Vlamis-Gardikas A, Offen D, Mittelman L, Melamed E, Holmgren A, Barzilai A. Glutaredoxin protects cerebellar granule neurons from dopamine-induced apoptosis by activating NF-kappa B via Ref-1. J Biol Chem. 2001;276:1335-1344. [PubMed] [DOI] |
| 3. | Song JJ, Rhee JG, Suntharalingam M, Walsh SA, Spitz DR, Lee YJ. Role of glutaredoxin in metabolic oxidative stress. Glutaredoxin as a sensor of oxidative stress mediated by H2O2. J Biol Chem. 2002;277:46566-46575. [PubMed] [DOI] |
| 4. | Landino LM, Moynihan KL, Todd JV, Kennett KL. Modulation of the redox state of tubulin by the glutathione/glutaredoxin reductase system. Biochem Biophys Res Commun. 2004;314:555-560. [PubMed] [DOI] |
| 5. | Bandyopadhyay S, Starke DW, Mieyal JJ, Gronostajski RM. Thioltransferase (glutaredoxin) reactivates the DNA-binding activity of oxidation-inactivated nuclear factor I. J Biol Chem. 1998;273:392-397. [PubMed] [DOI] |
| 6. | Prieto-Alamo MJ, Jurado J, Gallardo-Madueno R, Monje-Casas F, Holmgren A, Pueyo C. Transcriptional regulation of glutaredoxin and thioredoxin pathways and related enzymes in response to oxidative stress. J Biol Chem. 2000;275:13398-13405. [PubMed] [DOI] |
| 7. | Ragbavacbari N, Krysan K, Xing K, Loum F. Regulation of thioltransferase expression in human lens epithelial cells. Investg Ophthalmol Vis Sci. 2001;42:1002-1008. [PubMed] |
| 8. | Okuda M, Inoue N, Azumi H, Seno T, Sumi Y, Hirata Ki, Kawashima S, Hayashi Y, Itoh H, Yodoi J, Yokoyama M. Expression of glutaredoxin in human coronary arteries: its potential role in antioxidant protection against atherosclerosis. Arterioscler Thromb Vasc Biol. 2001;21:1483-1487. [PubMed] [DOI] |
| 9. | Sahlin L, Wang H, Stjernholm Y, Lundberg M, Ekman G, Holmgren A, Eriksson H. The expression of glutaredoxin is increased in the human cervix in term pregnancy and immediately post-partum, particularly after prostaglandin-induced delivery. Mol Hum Reprod. 2000;6:1147-1153. [PubMed] [DOI] |
| 10. | Schwartz EA, Bizios R, Medow MS, Gerritsen ME. Exposure of human vascular endothelial cells to sustained hydrostatic pressure stimulates proliferation. Involvement of the alphaV integrins. Circ Res. 1999;84:315-322. [PubMed] [DOI] |
| 11. | 陈 媛, 周 玫. 自由基医学基础与病理生理. 第一版. 北京: 人民卫生出版社 2002; 14-35. |
| 12. | Jung CH, Thomas JA. S-glutathiolated hepatocyte proteins and insulin disulfides as substrates for reduction by glutaredoxin, thioredoxin, protein disulfide isomerase, and glutathione. Arch Biochem Biophys. 1996;335:61-72. [PubMed] [DOI] |
| 13. | Holmgren A. Antioxidant function of thiodoxin and glutaredoxin systems. Antioxid Redox Signal. 2000;2:811-820. [PubMed] [DOI] |
| 14. | Rebrin I, Kamzalov S, Sohal RS. Effects of age and caloric restriction on glutathione redox state in mice. Free Radic Biol Med. 2003;35:626-635. [PubMed] [DOI] |
| 15. | Yoshitake S, Nanri H, Fernando MR, Minakami S. Possible differences in the regenerative roles played by thioltransferase and thioredoxin for oxidativeely damaged proteins. J Biochem (Tokyo). 1994;116:42-46. [PubMed] [DOI] |