修回日期: 2004-11-28
接受日期: 2004-12-09
在线出版日期: 2005-07-15
目的: 探讨高脂饮食大鼠脂肪性肝炎模型肝脏线粒体损伤和三磷酸腺苷(ATP)储备的改变.
方法: SD大鼠随机分为模型组(n = 48)和对照组(n = 24), 分别给予高脂饲料和标准饲料喂养, 分批于实验8、12、16和24 wk处死.常规检测血清生化和肝匀浆ATP含量, 光镜和电镜观察肝脏组织学改变.
结果: 与对照组相比, 模型组肝脏8 wk时肝脂肪变明显, 表现为单纯性脂肪肝, 12-24 wk进展为脂肪性肝炎; 模型组肝脏ATP含量呈减低趋势, 16-24 wk时较对照组减低约1/3(P<0.05); 电镜下8wk模型组大鼠肝细胞线粒体肿胀、增大, 部分内膜嵴粒脱落, 16 wk和24 wk大鼠线粒体内有类圆形结晶样物质沉积.
结论: 高脂饮食大鼠脂肪性肝炎模型的肝细胞存在线粒体损伤和ATP储备的减低.
引文著录: 丁晓东, 范建高, 徐正婕, 郑晓英, 田丽艳, 王国良. 高脂饮食性脂肪性肝炎大鼠肝脏线粒体损伤和ATP储备改变. 世界华人消化杂志 2005; 13(13): 1524-1528
Revised: November 28, 2004
Accepted: December 9, 2004
Published online: July 15, 2005
AIM: To investigate the mitochondrial injury and change in adenosine triphosphate (ATP) storage in a rat model of nonalcoholic steatohepatitis (NASH) induced by fat-rich diet.
METHODS: Seventy-two male SD rats were randomly divided into two groups. The control group (n = 24) was fed with normal diet; the model group (n = 48) was fed with fat-rich diet, which is consisted of 10% lard oil + 2% cholesterol. 6 or 12 rats were sacrificed at the 8th, 12th, 16th and 24th wk of the experiment. Serum biochemical parameters were measured by a commercial laboratory. The hepatic histologic change was evaluated by light microscopy and transmission electron microscopy. The ATP content was measured by luciferin-luciferase method.
RESULTS: Simple fatty liver was observed in the model group at the 8th wk. From the 12th wk to 24th wk, the liver gradually progressed to steatohepatitis. The ATP content of the liver was reduced in the model group compared with normal group at the 16th wk [(2.97±0.48)10-8 μmol/g vs (2.25±0.55)10-8 μmol/g, P = 0.0 361, t = 2.354] and the 24th wk [(2.97±0.48)10-8 μmol/g vs (1.99±0.66)10-8 μmol/g, P = 0.0 053, t = 3.439]. Markedly abnormal morphology was observed in the hepatocyte mitochondria in model group, including swelling, rounding, loss of cristae, and stacks of intramitochondrial paracrystalline inclusion bodies.
CONCLUSION: The hepatocytic mitochondria in NASH were injured and the storage of ATP was reduced, which may contribute to the pathogenesis of NASH.
- Citation: Ding XD, Fan JG, Xu ZJ, Zeng XY, Tian LY, Wang GL. Hepatocyte Mitochondrial Injury and the Change of Adenosine Triphosphate Storage in Rat Nonalcoholic Steatohepatitis. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1524-1528
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1524.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1524
随着非酒精性脂肪性肝炎(nonalcoholic steatoh-epatitis, NASH)发病率的增高[1-4], 针对NASH的研究越来越多.能量供应超过机体需要时, 大量转化为脂肪蓄积在机体内, 当超过外周脂肪组织的蓄积能力后, 易脂解为游离脂肪酸(free fatty acids, FFA)进入血液, 运输到肝脏, 经过β氧化转化为三磷酸腺苷(adenosine triphosphate, ATP)储备在肝细胞内.线粒体在β氧化中发挥核心作用, 如果线粒体损伤导致脂肪酸代谢障碍, FFA便酯化为三酰甘油(triglyceride, TG)蓄积在肝脏, 导致肝细胞内脂滴增多, 发生肝细胞脂肪变.为此, 我们动态观察NASH形成过程中肝脏线粒体超微形态改变和ATP储备情况, 以明确他们在NASH发病中的作用.
雄性SD大鼠72只, 购自中科院上海实验动物中心斯莱克公司, 体质量150(140-160)g.胆固醇, 上海生化试剂商店.猪油, 自备.血清生化指标通过Bayer 1650全自动生化分析仪检测.荧光素酶-荧光素、标准ATP粉剂和荧光素酶系缓冲液: 中科院上海植物生理研究所.低温离心机: Sigma公司, TR-16R.透射电子显微镜: 飞利浦透射电镜CM120.FG-100型发光光度计: 中科院上海植物生理研究所.SD大鼠正常喂养1 wk后, 随机分为2组.对照组24只用普通饲料喂养, 模型组48只以20 g/kg胆固醇+100 g/kg猪油+880 g/kg标准大鼠用饲料构成的高脂饲料喂养.实验开始后8、12、16和24 wk分别处死6只对照组和12只模型组大鼠.所有大鼠处死前夜禁食, 以氯胺酮麻醉, 腹主动脉采血后取肝, 称量肝脏湿质量, 之后迅速从肝脏切取1块肝组织, 中性甲醛固定后制备石蜡切片, 同时一小块肝脏标本标记后液氮罐中冷冻保存, 并取2 mm3的肝脏组织一块戊二醛固定后行电镜检查.
血清ALT、AST、TG和总胆固醇(TC), 采用全自动生化分析仪检测.肝组织石蜡切片HE染色观察肝病理学变化, 根据肝小叶内含脂滴细胞数/总细胞数之比值, 对肝细胞脂肪变进行分级[5-6].肝脏炎症活动度计分(hepatic histologic activity scores of inflammation, HAI)标准分为汇管区炎症(P)、小叶内炎症(L)、碎屑样坏死(PN)、桥接坏死(BN)4项, 计分公式为P+L+2(PN+BN)[7].肝脏经戊二醛固定后, 由LKB V型超薄切片机切片, 枸橼酸铅色片染色, 透射电镜观察肝细胞超微结构的改变, 尤其是线粒体的变化.ATP测定所有试剂均用重蒸蒸馏水配制, 溶液为: (1)腺苷酸提取液(Tris·HCl 20 mmol/L, MgSO4 2 mmol/L); (2)荧光素酶系缓冲液: 每只粉剂用50 mL重蒸水溶解, 内含50 mmol/L甘氨酰甘氨酸(pH = 7.6)、10 mmol/L MgSO4、1 mmol/L EDTA缓冲液.ATP的标准曲线: 将ATP配成1×10-10-5×10-5 mol/L的6管应用液进行测定, 以相对发光强度的log值与ATP浓度绘制标准曲线.荧光素酶-荧光素法测定ATP: 取肝组织0.1-0.15 g, 加入1 mL腺苷酸提取液中, 匀浆后沸水中加热3 min, 然后以4 000 rcf/min离心3 min, 取上清液0.4 mL.检测时将肝匀浆液0.1 mL加入重蒸馏水0.1 mL稀释, 置入2 mL的比色杯中, 放入FG-200型发光光度计的暗室中, 从暗室盖的小孔中快速注入荧光素酶系缓冲液0.8 mL, 所记录之发光曲线的初始峰值即为检测样品光强, 测定温度为25℃, 测定电压为0.5 mV.根据所得光强(测定曲线上所占的小格数)后, 在标准曲线上查出ATP值.
统计学处理 计量资料用mean±SD表示, 组间比较采用Student t检验, P<0.05为差别有统计学意义, P<0.01, 为差别有显著性统计学意义, 所有统计采用SPSS11.01(Chicago, USA)软件完成.
实验过程中2组大鼠体质量、肝质量和腹腔内脂肪含量均呈进行性增加.从8 wk开始模型组大鼠体质量、肝指数(肝脏湿重/体质量)和腹腔内脂肪指数(腹腔内脂肪含量/体质量)均显著高于对照组(P<0.05), 24 wk升高最明显(P<0.01, 表1).与对照组相比, 在第8-12 wk部分模型组大鼠血清ALT水平明显升高, 16 wk时模型组大鼠血清ALT均值显著增高(P<0.05), 24 wk时增高更为明显(P<0.01); 血清AST水平在造模12 wk开始显著升高(vs对照组P<0.01), 至造模16 wk达高峰.两组大鼠血清TG水平在造模8-16 wk时差异不明显, 但在24 wk时, 模型组与对照组相比明显升高(P<0.05).血清TC水平自造模8 wk始呈增高趋势, 12 wk时差别有统计学意义(P<0.05), 16-24 wk时升高更为明显(P<0.01, 表2).
| 分组 | n | 体质量(g) | 肝重(g) | 脂肪质量(g) | 肝指数 | 脂肪指数 |
| 正常组8 wk | 6 | 367±34 | 11.0±1.3 | 10.3±1.2 | 0.030±0.003 | 0.028±0.002 |
| 高脂组8 wk | 12 | 403±27a | 13.3±1.5b | 12.0±1.2b | 0.033±0.003a | 0.030±0.003 |
| 正常组12 wk | 6 | 403±28 | 12.2±1.0 | 12.1±2.3 | 0.029±0.001 | 0.030±0.004 |
| 高脂组12 wk | 12 | 445±43a | 16.6±1.9b | 14.5±2.0a | 0.037±0.002a | 0.033±0.002 |
| 正常组16 wk | 6 | 469±40 | 14.8±1.0 | 14.0±1.8 | 0.031±0.001 | 0.030±0.002 |
| 高脂组16 wk | 12 | 531±46a | 20.1±1.5a | 17.4±0.7b | 0.038±0.006 | 0.033±0.002a |
| 正常组24 wk | 6 | 508±33 | 15.1±1.3 | 14.8±2.3 | 0.030±0.002 | 0.029±0.003 |
| 高脂组24 wk | 12 | 573±45a | 23.8±1.5b | 19.9±2.1 | 0.042±0.004b | 0.035±0.005a |
| 分组 | n | ALT(nkat/L) | AST(nkat /L) | TC(mmol/L) | TG(mmol/L) |
| 正常组8 wk | 6 | 487±25 | 2 000±283 | 1.18±0.18 | 0.60±0.14 |
| 高脂组8 wk | 12 | 492±32 | 2 050±167 | 1.51±0.10 | 0.66±0.18 |
| 正常组12 wk | 6 | 728±90 | 1 750±200 | 1.02±0.10 | 0.75±0.17 |
| 高脂组12 wk | 12 | 864±87 | 2 534±267b | 1.83±0.39a | 0.81±0.12 |
| 正常组16 wk | 6 | 628±43 | 2 134±217 | 1.20±0.38 | 0.74±0.10 |
| 高脂组16 wk | 12 | 1 614±150a | 2 951±350b | 2.10±0.16b | 0.83±0.13 |
| 正常组24 wk | 6 | 768±157 | 2 000±183 | 1.27±0.61 | 0.71±0.12 |
| 高脂组24 wk | 12 | 2 070±193b | 2 700±183b | 2.33±0.21b | 1.10±0.24a |
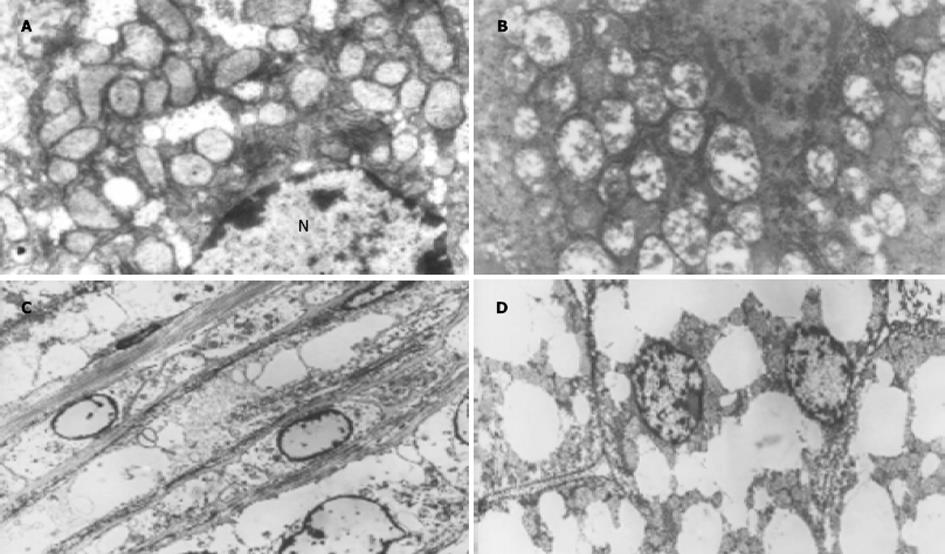
光镜下, 肝组织HE染色显示造模8 wk大鼠肝脏即有弥漫性肝细胞脂肪变性, 以肝腺泡III区最为明显, 87.5%(10/12)达脂肪肝诊断标准, 41.7%(5/12)肝脏小叶内出现轻度炎症细胞浸润和散在的点状坏死.造模12 wk大鼠呈中-重度脂肪肝, 且HAI积分显著高于造模8 wk大鼠(P<0.01, t = 3.2); 所有大鼠均可见到小叶内炎症, 炎症细胞以单个核细胞为主, 伴点状和/或小灶性坏死, 部分标本见数个炎症坏死灶融合成片, 汇管区亦可见到以单个核细胞为主的炎症细胞浸润.16 wk时, 大鼠肝脏内往往数个坏死灶融合成片, 1例出现碎屑样坏死, 1例出现桥接坏死, 汇管区炎症也较重.造模24 wk大鼠仍呈中-重度脂肪肝, 肝脏炎症仍然较重(vs 12 wk模型组P<0.01, t = 8.864, 表3), 与16 wk高脂组相比, 其小叶内炎症略有减轻, 其中1例(1/12)汇管区炎症加剧.透射电镜下, 与正常肝细胞相比(图1A)模型组大鼠肝细胞内充满大量脂滴, 肝细胞核被胞质内积聚的大脂滴推挤, 从肝细胞中央区被推到细胞的周边(图1D).肝细胞线粒体结构异常, 表现为线粒体增大、肿胀、线粒体内嵴粒脱落、减少, 且随着造模时间延长, 线粒体损害加重, 部分线粒体内可以看到类圆形高密度结晶样物质沉积(图1B).模型组24 wk标本电镜下肝脏内发现胶原纤维沉积(图1C).
对照组大鼠肝脏ATP含量为(2.97±0.48)×10-8 μmol/g, 模型组肝脏ATP含量随着造模时间延长呈逐渐下降趋势, 16 wk模型组与对照组相比具有统计学意义(P = 0.036, t = 2.354), 24 wk模型组ATP含量进一步下降, 与对照组比较ATP含量降低约33%, 且差异具有明显的统计学意义(P = 0.005, t = 3.439).相关分析显示, 对照组肝脏ATP含量与体质量之间呈负相关(r = -0.81, P<0.05), 模型组肝脏ATP含量与体质量的相关性不明显(r = 0.35, 0.1<P<0.2); 无论模型组还是对照组大鼠肝指数与肝脏ATP含量之间均没有明显的相关性.
通过高脂饲料喂养雄性SD大鼠, 对肝脏病理变化进行了动态观察, 结果与我们以前造模情况基本吻合, 实验动物出现超质量、高胆固醇血症、中-重度脂肪肝伴以小叶内为主的炎症坏死, 从而通过高脂饲料成功建立了普通SD大鼠的NASH模型[8-10].肝脏是机体能量代谢和转换的中枢器官.线粒体是体内中、长链脂肪酸β氧化的核心细胞器, 其在代谢脂肪酸的过程中产生大量ATP, 为ATP合成的主要细胞器.ATP含量决定了细胞对应激的反应能力, 如果其含量降低, 会导致细胞对应激的反应不足, 引起肝脏的严重损伤, 因此组织中ATP水平是反映组织细胞功能状态及其生命力的重要参数之一[11-12].为此我们动态观察了NASH大鼠模型肝细胞超微结构的改变, 尤其是线粒体形态的改变, 并测定了肝脏ATP的含量, 探讨二者在NASH发病中的可能作用.电镜检查显示, NASH模型组肝细胞中充满大量脂滴, 导致胞核移向细胞边缘, 伴肝细胞线粒体肿胀、变圆、体积增大, 细胞内膜嵴粒部分脱落.随着造模时间的延长, 肝细胞线粒体损伤逐渐加重, 造模16 wk起部分线粒体内见类圆形高密度沉积物.这与国外报道的NASH肝脏线粒体损伤的程度相近, 此时往往同时伴有线粒体ATP合成酶亚单位减少、线粒体产生ROS增多等[13-21].
对肝脏ATP含量的测定结果表明, NASH模型组肝脏ATP储备降低1/3左右.进一步的相关分析显示, 实验大鼠体质量与肝脏ATP含量具有一定的相关性, 这主要见于正常对照组肝脏, 而模型组则没有发现二者之间具有相关性.这一结果与Cortez-Pinto et al[22]在NASH患者所得出的结果相似, 作者发现正常人群肝脏ATP储备与体质量指数(body mass index, BMI)关系密切, BMI越大, 其肝脏ATP含量越低.而发生NASH后的患者, 尽管肥胖, 但其肝脏中ATP储备与BMI的负相关性不明显, 这可能与NASH肝脏ATP储备本身就减少有关.肝脏能量储备不足容易导致肝脏对再次打击的耐受力降低.Cortez-Pinto et al[22]对肝活检证实的8例NASH患者用果糖静脉注射诱发短暂的中等度肝脏ATP耗竭, 注射后15 min二者ATP含量均降到最低值, 60 min时对照组ATP含量恢复到注射前水平; 而此时NASH组ATP含量没有恢复到注射前水平, 直到实验结束其与对照组恢复后的ATP含量相比仍有显著的统计学差异, 说明NASH患者肝脏遭受中等度果糖注射应激后, 其ATP储备恢复能力降低.作者同时发现对照组ATP储备恢复程度与BMI呈负相关, 提示肥胖者肝细胞对应激反应能力不足.Vendemiale et al[23]进行的实验发现脂肪肝大鼠肝细胞线粒体上F0-F1 ATP合成酶的β-F1催化亚单位较对照组减少30%, 其线粒体内ATP含量亦明显降低; 对两组禁食18 h后, 实验组的β-F1亚单位较禁食前明显减少, 而对照组无明显变化, 说明ATP合成的β-F1亚单位减少与肝脏ATP储备降低具有一定的相关性.Caracini et al[24]用ob/ob大鼠诱导的脂肪肝模型进行缺血再灌注试验发现门静脉结扎15 min后, 对照组肝细胞ATP含量降低30%, 而ob/ob大鼠则高达60%, 恢复灌注60 min后对照组ATP含量恢复到缺血前水平, 而ob/ob大鼠则有2只死亡, 存活的4只其ATP含量明显低于基线时的水平.这些实验和我们的实验说明, 脂肪变的肝脏的确存在ATP储备降低, 使肝脏耐受二次打击(如手术、缺血灌注损伤、禁食和果糖应激等)的能力降低.总之, 我们的研究结果提示, 高脂饮食NASH大鼠存在肝脏肝细胞线粒体结构的损伤和ATP储备的减低, 并可能参与NASH的发生和发展.
编辑: 潘伯荣 审读: 张海宁
| 1. | Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002;346:1221-1231. [PubMed] [DOI] |
| 2. | James O, Day C. Non-alcoholic steatohepatitis: another disease of affluence. Lancet. 1999;353:1634-1636. [DOI] |
| 3. | Chitturi S, Farrell GC, George J. Non-alcoholic steatohepatitis in the Asia-Pacific region: future shock? J Gastroenterol Hepatol. 2004;19:368-374. [PubMed] [DOI] |
| 4. | Sanyal AJ; American Gastroenterological Association. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002;123:1705-1725. [DOI] |
| 8. | Lieber CS, Leo MA, Mak KM, Xu Y, Cao Q, Ren C, Ponomarendo A, DeCarli LM. Model of nonalcoholic steatohepatitis. Am J Clin Nutr. 2004;79:502-509. [PubMed] |
| 9. | Fan JG, Zhong L, Xu ZJ, Tia LY, Ding XD, Li MS, Wang GL. Effects of low-calorie diet on steatohepatitis in rats with obesity and hyperlipidemia. World J Gastroenterol. 2003;9:2045-2049. [PubMed] [DOI] |
| 11. | Johns DR. Seminars in medicine of the Beth Israel Hospital, Boston. Mitochondrial DNA and disease. N Engl J Med. 1995;333:638-644. [PubMed] |
| 12. | Fromenty B, Robin MA, Igoudjil A, Mansouri A, Pessayre D. The ins and outs of mitochondrial dysfunction in NASH. Diabetes Metab. 2004;30:121-138. [PubMed] [DOI] |
| 13. | Caldwell SH, Swerdlow RH, Khan EM, Iezzoni JC, Hespenheide EE, Parks JK, Parder WD Jr. Mitochondrial abnormalities in non-alcoholic steatohepatitis. J Hepatol. 1999;31:430-434. [PubMed] [DOI] |
| 14. | Sanyal AJ, Campbell-Sargent C, Mirshahi F, Rizzo WB, Contos MJ, Sterling RK, Luketic VA, Shiffman ML, Clore JN. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology. 2001;120:1183-1192. [PubMed] [DOI] |
| 15. | Pessayre D, Fromenty B, Mansouri A. Mitochondrial injury in steatohepatitis. Eur J Gastroenterol Hepatol. 2004;16:1095-1105. [PubMed] [DOI] |
| 16. | Le TH, Caldwell SH, Redick JA, Sheppard BL, Davis CA, Arseneau KO, Iezzoni JC, Hespenheide EE, AI-Osaimi A, Peterson TC. The zonal distribution of megamitochondria with crystalline inclusions in nonalcoholic steatohepatitis. Hepatology. 2004;39:1423-1429. [PubMed] |
| 17. | Perez-Carreras M, Del Hoyo P, Martin MA, Rubio JC, Martin A, Castellano G, Colina F, Arenas J, Solis-Herruzo JA. Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis. Hepatology. 2003;38:999-1007. [PubMed] [DOI] |
| 18. | Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest. 2004;114:147-152. [PubMed] [DOI] |
| 19. | Baffy G, Zhang CY, Glickman JN, Lowell BB. Obesity-related fatty liver is unchanged in mice deficient for mitochondrial uncoupling protein 2. Hepatology. 2002;35:753-761. [PubMed] [DOI] |
| 20. | Sreekumar R, Rosado B, Rasmussen D, Charlton M. Hepatic gene expression in histologically progressive nonalcoholic steatohepatitis. Hepatology. 2003;38:244-251. [PubMed] [DOI] |
| 21. | Pessayre D, Berson A, Fromenty B. Mitochondria in Steatohepatitis. Semin Liver Dis. 2001;21:57-69. [PubMed] [DOI] |
| 22. | Cortez-Pinto H, Chatham J, Chacko VP, Arnold C, Rashid A, Diehl AM. Alterations in liver ATP homeostasis in human nonalcoholic steatohepatitis: a pilot study. JAMA. 1999;282:1659-1664. [PubMed] [DOI] |
| 23. | Vendemiale G, Grattagliano I, Caolo C. Mitochondrial oxidative injury and energy metabolism alteration in rat fatty liver: effect of the nutritional status. Hepatology. 2001;33:808-815. [PubMed] [DOI] |
| 24. | Caracini P, Nardo B, Domenicali M, Turi P, Vici M, Simoncini M, De Maria N, Trevisani F, Van Thiel DH, Derenzini M. Ischmia-reperfusion injury in rat fatty liver: role of nutritional status. Hepatology. 1999;29:1139-1146. [PubMed] [DOI] |