修回日期: 2005-04-07
接受日期: 2005-04-09
在线出版日期: 2005-07-15
目的: 探讨基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)、基质金属蛋白酶抑制剂- 2(TIMP-2)、基质金属蛋白酶抑制剂- 1(TIMP-1)在不同性质的大肠黏膜中的表达情况及MMP-2/TIMP-2、MMP-9/TIMP-1与大肠腺瘤向大肠癌转变的相关性及临床意义.
方法: 用酶联免疫吸附试验(ELISA)的方法对MMP-2, MMP-9及其抑制剂TIMP-2、TIMP-1在大肠腺瘤轻、中、重度不典型增生以及大肠腺癌中进行定量检测.
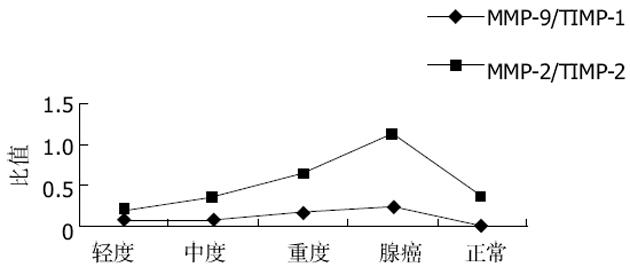
结果: MMP-2在大肠腺瘤重度不典型增生与中含量明显高于轻、中度不典型增生及正常大肠黏膜(91.391±23.551 vs 19.461±8.836, 42.313±14.094, 27.330±8.405, P <0.05); MMP-9在正常肠黏膜中未见表达, 在大肠腺瘤轻中重度不典型增生及大肠癌中表达依次增强, 两两间有显著性差异(11.260±4.104 vs 31.520±7.433 vs 57.803±19.060 vs 202.17±33.344, P<0.05); TIMP-2重度不典型增生组与正常大肠黏膜有显著性差异(136.279±19.539 vs 81.363±26.252, P<0.05); MMP-2/TIMP-2比率在腺瘤轻、中度不典型增生, 重度不典型增生及大肠腺癌中两两之间均有显著性差异(0.206±0.128 vs 0.360±0.129 vs 0.665±0.100 vs 1.136±0.300, P<0.05); TIMP-1在腺瘤轻中度不典型增生中表达与大肠腺癌中表达有显著性差异(227.413±208.497, 654.854±339.005 vs 1136.271±607.029 P<0.05); MMP-9/TIMP-1比率在腺瘤轻中度不典型增生, 重度不典型增生及大肠腺癌中两两之间均无显著性差异(P>0.05).
结论: MMP-2可能是大肠腺瘤向大肠腺癌转变过程中的早期事件.MMP-9可作为区别大肠肿瘤良恶性的一项重要指标.MMP-2/TIMP-2比率与大肠腺瘤恶变有相关性, 而MMP-9/TIMP-1的比率与大肠腺瘤向大肠腺癌的转变无相关性.MMP-2、MMP-9的定量监测可以作为大肠腺瘤向大肠腺癌转变过程中重要的生物学指标.
引文著录: 汪丽燕, 乔镇, 关景明, 吕丽燕, 张春燕. 基质金属蛋白酶-2,9及其抑制剂与大肠腺瘤癌变的关系. 世界华人消化杂志 2005; 13(13): 1514-1518
Revised: April 7, 2005
Accepted: April 9, 2005
Published online: July 15, 2005
AIM: To investigate the expression of matrix metalloproteinase-2 (MMP-2), MMP-9, tissue inhibitor of metalloproteinase-2 (TIMP-2) and TIMP-1 colorectal mucous tissues with different types, and to explore the clinical significance of MMP-2/TIMP-2, MMP-9/TIMP-1 in the progression of colorectal neoplasm into colorectal carcinoma.
METHODS: The expression of MMP-2, MMP-9 and their inhibitors TIMP-2, TIMP-1 were detected in the mild, moderate and severe dysplasia of colorectal neoplasm and colorectal carcinoma by enzyme linked immunosorbent assay (ELISA).
RESULTS: The expression of MMP-2 in the severe dysplasia of colorectal neoplasm significantly higher than that in the mild and moderate ones and normal mucosa (91.391±23.551 vs 19.461±8.836, 42.313±14.094, 27.330±8.405, P<0.05). MMP-9 was not expressed in normal colorectal mucosa, but its expression was successively in mild (11.260±4.104), moderate (31.520±7.433) and severe (57.803±19.060) dysplasia as well as in colorectal carcinoma (202.17±33.344). Marked difference was detected between any two of them (P<0.05). TIMP-2 was differently expressed between severe dysplasia and normal colorectal mucosa (136.279±19.539 vs 81.363±26.252, P<0.05). The ratio of MMP-2 to TIMP-2 was significantly different between mild, moderate and severe dysplasia and colorectal carcinoma (0.206±0.128 vs 0.360±0.129 vs 0.665±0.100 vs 1.136±0.300, P<0.05). TIMP-1 expression was obviously decreased in mild and medium dysplasia as compared with that in colorectal carcinoma (227.413±208.497, 654.854±339.005 vs 1136.271±607.029, P<0.05). The ratio of MMP-9 to TIMP-1 showed no marked difference between mild, moderate and severe dysplasia and colorectal carcinoma (P>0.05).
CONCLUSION: MMP-2 may be an important marker in the progression of colorectal neoplasm into colorectal carcinoma. MMP-9 can be applied to differentiate benign tumors from malignant ones. The ratio of MMP-2 to TIMP-2 is associated with colorectal neoplasm's progression into carcinoma, but the ratio of MMP-9 to TIMP-1 isn't. MMP-2 and MMP-9 may be used as valuable biological markers for predicting progression of colorectal neoplasm into carcinoma.
- Citation: Wang LY, Qiao Z, Guan JM, Lv LY, Zhang CY. Roles of MMP-2, MMP-9 and their inhibitors in progression of colorectal neoplasm into colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1514-1518
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1514.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1514
大肠癌的发生、发展是一个分子、细胞、组织形态学伴随生化改变的渐变、递增过程.腺瘤性息肉组织学由轻到重的不典型增生癌变过程已为许多学者认同, 故腺瘤性息肉已成为研究癌变的专用对象.文献报道[1-9], 基质金属蛋白酶-2, 基质金属蛋白酶-9的高表达与许多恶性肿瘤的浸润、转移及血管生成密切相关.目前对MMP的研究主要集中在肿瘤侵袭转移中的作用的认识, 本实验集中研究了MMP在大肠癌前病变即大肠腺瘤轻、中、重度增生中的表达情况.为预防大肠癌, 有效治疗大肠癌前病变提供理论依据.
研究材料取自2003-2004年本院外科住院患者手术切除的大肠标本, 经过病理组织学诊断为大肠腺瘤伴轻、中、重度不典型增生8例、大肠腺癌(腺瘤与腺癌同时存在)8例及手术切除标本中正常组织8例.年龄38-76岁, 新鲜组织置液氮3 h后防于-70℃保存, 待制备组织匀浆.主要试剂MMP-2、9, TIMP-1、2试剂盒购自上海森雄科技实业有限公司.
用ELISA法在大肠的正常组织、大肠腺瘤、大肠癌组织中定量检测MMP-2、MMP-9、TIMP-1, 2的蛋白含量, 全部操作严格按照说明书进行.
统计学处理 采用SPSS10.0软件包进行统计学分析.ELISA实验结果以mean±SD表示, 运用Dunnet'c检验, P<0.05为有统计学意义.
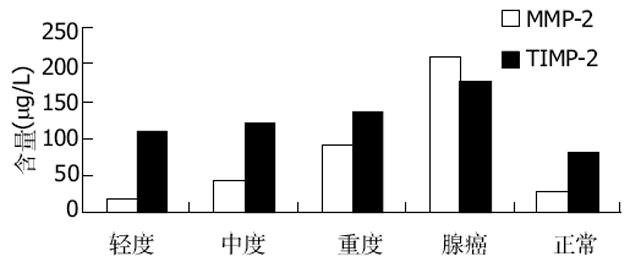
MMP-2大肠腺瘤轻、中、重度不典型增生、大肠癌中的含量依次增高; 大肠腺瘤组中的轻、中度不典型增生组与正常组无显著性差异(P>0.05), 与重度不典型增生组有显著性差异(P<0.05), 与大肠癌组比有显著性差异(P<0.05); 重度不典型增生腺瘤与正常组有显著性差异(P<0.05), 与大肠癌组无显著性差异(P>0.05)(表1, 图1).
TIMP-2在正常大肠黏膜、大肠腺瘤轻、中、重度不典型增生、大肠癌中的含量依次增高; 大肠腺瘤组中的轻、中度不典型增生组与重度不典型增生组、大肠癌组及正常组均无显著性差异(P>0.05); 重度不典型增生组与正常组有显著性差异(P<0.05), 与大肠癌组无显著性差异(P>0.05)(表1, 图1).
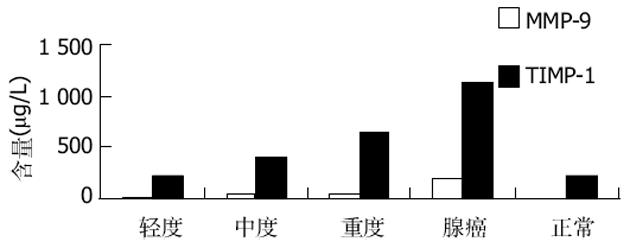
MMP-9在正常大肠黏膜、大肠腺瘤轻、中、重度不典型增生、大肠癌中的的含量依次增高; MMP-9在正常大肠黏膜中几乎没有检测到; 大肠腺瘤组中的轻、中、重度不典型增生组、大肠癌组两两间均显著性差异(P<0.05)(表2, 图2).
TIMP-1在正常大肠黏膜、大肠腺瘤轻、中、重度不典型增生、大肠癌中的含量依次增高; 腺瘤组中的轻度不典型增生组与比大肠癌组有显著性差异(P<0.05); 其他各组间均无显著性差异(P>0.05)(表2, 图2).
MMPs是在1962年被发现的一组锌离子依赖性内肽酶, 是由24种MMP构成的超家族[10].各种MMP间具有一定的特性.目前对MMP的研究主要集中在肿瘤侵袭转移中作用的认识, 本实验集中研究了MMP在大肠癌前期病变即大肠腺瘤轻、中、重度不典型增生中的表达情况.
肿瘤的发生、发展是一个多基因多步骤的复杂过程[11-12], 这个过程中有细胞外基质及基膜的降解.MMP-2、MMP-9是一种明胶酶(gelatinase), 主要水解底物是变性胶原及细胞外基质BM的主要成分Ⅳ型胶原和Ⅴ型胶原等.而Ⅳ型胶原和Ⅴ型胶原是细胞外基质及基膜的主要成分, 与肿瘤的发生、发展密切相关[13-18].MMP-2, MMP-9的除了降解细胞外基质外, 还有促进新生血管形成, 调节细胞黏附的作用.MMP-2、MMP-9分子质量分别为72 ku, 以酶原形式分泌到细胞外, 经活化才具有活性.本实验结果显示MMP-2在大肠腺瘤重度不典型增生中含量明显高于轻、中度不典型增生及正常大肠黏膜(P<0.05), 但与大肠癌组无显著性差异(P>0.05).说明MMP-2可能是大肠腺瘤向大肠腺癌转变过程中的早期事件.MMP-9在正常肠黏膜中未见表达, 在大肠腺瘤轻、中、重度不典型增生及大肠癌中表达依次增强, 两两比较有显著性差异(P>0.05).提示MMP-9可作为区别大肠肿瘤良恶性的一项指标.腺瘤重度不典型增生被认为是癌前病变.Liotta et al[19]认为: 当肿瘤处于癌前病变时期, 其基底膜的连续性就已经出现了局部破损, 这可能与一些非正常的分泌型酶被合成有关.本研究推测这些分泌型的酶中可能会MMP-2、MMP-9的存在.细胞外基质(ECM)在细胞与细胞之间起机械支持和连接作用, 同时也是细胞和细胞之间信号传递的桥梁.MMPs可以通过分解ECM成分来调节其降解和重组之间的动态平衡, 使基质中已存在的生物活性物质释放或激活而参与组织和细胞的生长、增殖、分化, 进而影响细胞和组织器官的各种形态和功能[20].MMP的表达异常可能导致某些特殊信号被消除、某些隐含信号被显现, 破坏了细胞外基质的平衡性, 导致大肠腺瘤向大肠腺癌转变.文献[21-24]报道MMP-2可以激活MMP-9, 本实验结果显示正常大肠黏膜中有少量的MMP-2的表达, 而没有MMP-9的表达, 是否可以推测随着大肠腺瘤不典型增生程度的增加直到发展成大肠腺癌的过程中MMP-2诱导了MMP-9的表达.无论是良性肿瘤还是恶性肿瘤其生长都依赖于血管供应营养.血管的发生是肿瘤生长的前提条件.新生血管的形成在肿瘤发生、发展过程中有重要作用.文献[21]报道MMP-2、MMP-9在血管形成中均起了重要作用, 新生血管的形成极大的依赖于基质金属蛋白酶的活性.MMP-9能上调肿瘤血管化的程度是血管发生启动系统中重要的一员[22-27].从本实验可以推断腺瘤可能通过增加MMP的表达诱导血管生成促进腺瘤生长, 加重不典型增生的程度, 在大肠腺瘤向大肠腺癌的转变过程中起促进作用.
TIMPs是MMPs的天然抑制剂, 是由体内细跑分泌、能抑制MMPs活性的一类蛋白酶抑制剂, 可与MMPs的酶原与活化形式相结合.TIMP能抑制已激活的MMP的活性, 能阻止或延缓酶原型MMP转变为激活型MMP的过程, 能抑制肿瘤新生血管的生长[28].TIMP-1是一个由184个氨基酸组成的糖蛋白, 分子质量为28.5 ku, 可与活化的MMP形成复合体, 降低细胞外基质的降解, 抑制肿瘤转移.TIMP-2是一个非糖化的由194个氨基酸组成的蛋白质, 分子质量为21 ku.TIMP-2, TIMP-2可抑制MMP-2的活性, 对除MMP-3、MMP-9以外的MMP家族其他成员的活性也有抑制作用, 能阻断所有被激活的MMP的水解酶活性.本实验研究结果显示TIMP-2大肠腺瘤轻、中、重度不典型增生、大肠癌中的含量依次增高; 大肠腺瘤组中的轻、中度不典型增生组与重度不典型增生组、大肠癌组及正常组均无显著性差异(P>0.05); 重度不典型增生组与正常组比有显著性差异(P<0.05), 与大肠癌组无显著性差异(P>0.05); MMP-2/TIMP-2比率在大肠腺瘤组中的轻、中度不典型增生组与重度不典型增生及大肠癌组有显著性差异(P<0.05), 与正常组比无显著性差异(P>0.05); 腺瘤组中的重度不典型增生与正常组及大肠癌组均有显著性差异(P<0.05).这说明在不同性质的大肠黏膜中随着MMP-2的增加TIMP-2也在增加, 这可能是MMP-2表达增强的一种内在需求导致其抑制剂表达也随之增强, 但TIMP-2的表达强度弱于MMP-2, 最终导致二者失衡, 而在大肠癌的发生发展中发生作用.说明MMP-2/TIMP-2比率与大肠腺瘤向大肠腺的癌转变有相关性.TIMP-1在正常大肠黏膜、大肠腺瘤轻、中、重度不典型增生、大肠癌中的含量依次增高; 腺瘤组中的轻度不典型增生组与比大肠癌组比有显著性差异(P<0.05); 其他各组间均无显著性差异(P>0.05), 这说明腺瘤重度不典型增生中某些异型细胞的生物学行为已经接近于恶性肿瘤细胞的生物学行为, 进一步提示临床对大肠腺瘤进行全瘤活检的重要性及意义.MMP-9/TIMP-1比率在正常大肠黏膜、大肠腺瘤轻, 中, 重度、大肠癌中依次增高; 大肠腺瘤组中的轻、中、重度不典型增生组与正常组比有显著性差异(P<0.05), 其他各组间均无显著性差异(P>0.05).这说明而MMP-9/TIMP-1的比率与大肠腺瘤向大肠腺癌转变过程有相关性.
本实验通过对MMP-2、MMP-9及MMP-2/TIMP-2、MMP-9/TIMP-1的研究进一步揭示了基质金属蛋白酶及其抑制剂在大肠腺瘤向大肠腺癌转变过程中的作用, 有助于我们对癌前病变进展为癌的分子机制有更深入的了解, 为临床制定合理的综合治疗方案提供可靠的理论依据.但在大肠腺瘤向大肠腺癌转变过程除了有MMP-2、MMP-9表达含量的变化, MMP-2/TIMP-2、MMP-9/TIMP-1比率的失衡, 可能还有MMP-2、MMP-9的活性改变, 是他们中的某一种改变起决定性的作用, 还是他们间的相互协调起决定性的作用, 值得我们去进一步探讨研究.
编辑: 王谨晖 审读: 张海宁
| 1. | Takahashi M, Oka N, Naroda T, Nishitani MA, Kanda K, Kanayama HO, Kagawa S. Prognostic significance of matrix metalloproteinases-2 activation ratio in renal cell carcinoma. Int J Urol. 2002;9:531-538. [PubMed] [DOI] |
| 2. | Takahashi Y, Kitadai Y, Ellis LM, Bucana CD, Fidler IJ, Mai M. Multiparametric in situ mRNA hybridization analysis of gastric biopsies predicts lymph node metastasis in patients with gastric carcinoma. Jpn J Cancer Res. 2002;93:1258-1265. [PubMed] [DOI] |
| 4. | Riedel F, Gotte K, Bergler W, Hormann K. Inverse correlation of apoptotic and angiogenic markers in squamous cell carcinoma of the head and neck. Oncol Rep. 2001;8:471-476. [PubMed] [DOI] |
| 5. | Kabashima A, Maehara Y, Kakeji Y, Baba H, Koga T. Sugimachi K. Clinicopathological features and overexpression of matrix metalloproteinases in intramucosal gastric carcinoma with lymph node metastasis. Clin Cancer Res. 2000;6:3581-3584. [PubMed] |
| 6. | Chamber AF, Matrisian LM. Changing views of the role of matrix metalloproteinases in metastasis. J Natl Cancer Inst. 1997;89:1260-1270. [PubMed] [DOI] |
| 7. | Hirvonen R, Talvensaari-Mattila A, Paakko P, Turpeenniemi-Hujanen T. Matrix metalloproteinase-2 (MMP-2) in T (1-2) N0 breast carcinoma. Breast Cancer Res Treat. 2003;77:85-91. [PubMed] [DOI] |
| 8. | Matsuyama Y, Takao S, Aikou T. Comparison of matrix metalloproteinase expression between primary tumors with or without liver metastasis in pancreatic and colorectal carcinomas. J Surg Oncol. 2002;80:105-110. [PubMed] [DOI] |
| 9. | Kabashima A, Yao T, Sugimachi K, Tsuneyoshi M. Relationship between biologic behavior and phenotypic expression in intramucosal gastric carcinomas. Hum Pathol. 2002;33:80-86. [PubMed] [DOI] |
| 10. | Roeb E, Matern S. Matrix metalloproteinases and colorectal cancer. Med Klin (Munich). 2003;98:763-770. [PubMed] [DOI] |
| 11. | Meyer T, Hart IR. Mechanisms of tumor metastasis. Eur J Cancer. 1998;34:214-221. [PubMed] [DOI] |
| 12. | Kleiner DE, Stetler-Stevenson WG. Matrix metalloprote inases and metastasis. Cancer Chemother Pharmacol. 1999;43:s42-s51. [PubMed] [DOI] |
| 13. | Stock UA, Wiederschain D, Kilroy SM, Shum-Tim D, Khalil PN, Vacanti JP, Mayer JE Jr, Moses MA. Dynamics of extracellular matrix production and turnover in tissue engineered cardiovascular structures. J Cell Biochem. 2001;81:220-228. [PubMed] [DOI] |
| 14. | Uria JA, Lopez-Otin C. Matrilysin, a new matrix metalloproteinase expressed in human tumors and showing the minimal domain organization required for secretion, latency, and activity. Cancer Res. 2000;60:4745-4751. [PubMed] |
| 15. | Deng SJ, Bickett DM, Mitchell JL, Lambert MH, Blackburn RK, Carter HL 3rd, Neugebauer J, Pahel G, Weiner MP, Moss ML. Substrate specificity of human collagenase 3 assessed using a phage-displayed peptide library. J Biol Chem. 2000;275:31422-31427. [PubMed] [DOI] |
| 16. | Stracke JO, Hutton M, Stewart M, Pendas AM, Smith B, Lopez-Otin C, Murphy G, Knauper V. Biochemical characterization of the catalytic domain of human matrix metalloproteinase 19. Evidence for a role as a potent basement membrane degrading enzyme. J Biol Chem. 2000;275:14809-14816. [PubMed] [DOI] |
| 17. | Marchenko GN, Ratnikov BI, Rozanov DV, Godzik A, Deryugina EI, Strongin AY. Characterization of matrix metalloproteinase-26, a novel metalloproteinase widely expressed in cancer cell of epithelial origin. Biochem J. 2000;356:705-718. [PubMed] [DOI] |
| 18. | Nar H, Werle K, Bauer MM, Dollinger H, Jung B. Crystal structure of human macrophage elastase (MMP-12) in complex with a hydroxamic acid inhibitor. J Mol Biol. 2001;312:743-751. [PubMed] [DOI] |
| 19. | Liotta LA, Stetler-Stevenson W. Metalloproteinases and malignant conversion: does correlation imply causality? J Natl Cancer Inst. 1989;81:556-557. [PubMed] [DOI] |
| 20. | 赵云隔, 欧尔比特钒材嵬叨, 祝诚. 细胞外基质与基质金属蛋白酶. 生物化学与生物物理进展. 1999;26:223-226. |
| 22. | Gasparini G. Prognostic value of vascular endothelial growth factor in breast cancer. Oncologist. 2000;5:37-44. [PubMed] [DOI] |
| 25. | Westermarck J, Kahari VM. Regulation of matrix metallop-roteinase expression in tumor invasion. FASEB J. 1999;13:781-792. [PubMed] |
| 26. | Bergers G, Brekken R, McMahon G, Vu TH, Itoh T, Tamaki K, Tanzawa K, Thorpe P, Itohara S, Werb Z. Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis. Nat Cell Biol. 2000;4:737-744. [PubMed] |
| 27. | Riedel F, Gotte K, Schwalb J, Bergler W, Hormann K. Expression of 92-k Da type IV collagenase correlates with angiogenic markers and poor survival in head and neck squamous cell carcinoma. Int J Oncol. 2000;17:1099-1105. [PubMed] |