修回日期: 2005-02-17
接受日期: 2005-02-26
在线出版日期: 2005-07-15
目的: 旨在阐明胃癌的发生中多种抑癌基因和癌基因的甲基化情况, 以期为进一步深入探索通过改变抑癌基因的甲基化而为胃癌治疗提供新方法.
方法: 培养人胃癌细胞株MKN-45和HGC-27两种细胞,在MTT确定去甲基化制剂5-氮脱氧胞苷(5-aza-2'-deoxycytidine,5-aza-dC)浓度和时间对细胞生长活力没有影响后, 分别以2, 5, 和10 μmol/L浓度分别干预24和72 h,然后提取其DNA和RNA,用RT-PCR的方法检测p16INK4A, p21WAF1, p53, c-Ha-ras和c-myc等多种基因的表达情况; 同时以流式细胞仪分析药物干预后的MKN-45和HGC-27的细胞周期变化; DNA分析则通过亚硫酸氢盐修饰和测序和甲基化特异性PCR(MSP)的方法检测p16INK4A基因及c-myc启动子区甲基化的情况.
结果: 我们所采用的5-aza-dC的浓度和时间对细胞的生长无显著性影响.5-aza-dC干预前, MKN-45和HGC-27两种胃癌细胞系中均有p16INK4A表达, 5-aza-dC干预后在MKN-45 和HGC-27两种胃癌细胞系中p16INK4A的表达增强,且不同的胃癌细胞株表达增强最明显时的时间与浓度不同.p53, p21WAF1, c-myc, c-Ha-ras等多种基因在干预前后均有表达,且在干预前后无明显变化.在5-aza-dC干预后, HGC-27细胞周期阻滞在G1期, 而MKN-45细胞的周期无明显改变.p16INK4A启动子区存在甲基化使得该基因的表达减少, 在去甲基化试剂处理后使其表达增强.
结论: 人胃癌细胞系MKN-45和HGC-27中, p16INK4A启动子甲基化是其在表达减弱的主要原因, 其去甲基化程度取决于5-aza-dC干预的时间和浓度.
引文著录: 杨丽, 朱红音, 程中华, 陆嵘, 陈萦晅, 房静远. 人胃癌细胞肿瘤相关基因的表达与甲基化调控. 世界华人消化杂志 2005; 13(13): 1493-1498
Revised: February 17, 2005
Accepted: February 26, 2005
Published online: July 15, 2005
AIM: To investigate the expression and methylation of tumor suppressor genes and oncogenes in the carcinogenesis of gastric cancer, and to further explore new methods for the treatment of gastric cancer.
METHODS: The gastric cancer MKN-45 and HGC-27 cell lines were cultured and then exposed to different concentrations (2 μmol/L, 5 μmol/L and 10 μmol/L) of 5-aza-2'-deoxycytidine (5-aza-dC) for 24 and 72 h. MTT assay was used to examine the viability of the cells. Then the DNA and RNA of the cells were extracted and the expression of p16INK4A, p21WAF1, p53, c-myc, and c-Ha-ras were detected by reverse transcription polymerase chain reaction (RT-PCR). At the same time, the cell cycles of MKN-45 and HGC-27 were observed by flow cytometry. Bisulfite modification and sequencing and methylation-specific PCR were used to detect the methylation of p16INK4A and c-myc promoter region.
RESULTS: The concentrations and exposed time of 5-aza-dC had no significant effect on the viability of gastric cancer cells. p16INK4A was expressed in both MKN-45 and HGC-27 cells before treatment. After treated with 5-aza-dC, p16INK4A expression was increased in both kinds of the cells, and the 5-aza-dC concentration and exposed time were different between the two kinds of cells when the most markedly increased expression of p16INK4A appeared. p53, p21WAF1, c-myc and c-Ha-ras were all expressed before and after treatment. HGC-27 cells were blocked at G1 period, but no changes of MKN-45 cell cycle were observed. Methylation in p16INK4A promoter region occurred so that the expression of this gene was reduced. After treated with demethylation agent 5-aza-dC, the expression of p16INK4A was increased.
CONCLUSION: Methylation regulates the expression of p16INK4A, but not p21WAF1, p53, c-myc, and c-Ha-ras. 5-aza-dC can up-regulate the transcription of tumor suppressor gene through demethylation, in which its concentration and exposed time play an important role.
- Citation: Yang L, Zhu HY, Cheng ZH, Lu R, Chen YX, Fang JY. Expression and methylation of tumor-associated genes in human gastric cancer cell lines. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1493-1498
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1493.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1493
DNA甲基化在肿瘤的发生和发展中扮演着极其重要的角色, DNA甲基化异常是通过影响癌基因和抑癌基因的表达以及基因组的稳定性而参与肿瘤的发生和发展的.胃癌是危害我国人们生命和健康的主要癌症之一, 我们采用去甲基化作用的5-aza-dC处理MKN-45和HGC-27胃癌细胞株, 研究胃癌的与细胞增殖相关的基因甲基化紊乱情况, 澄清是否同一个体肿瘤发生过程中存在不同基因的低甲基化或高甲基化紊乱问题, 探索通过纠正DNA甲基化的化学干预, 而影响胃癌细胞的增殖, 进而控制肿瘤进程的可能性如下.
MKN-45和HGC-27人胃癌细胞株细胞来自上海市消化疾病研究所, 5-氮脱氧胞苷(5-aza-dC)(Sigma), RPMI1640培养基(Gibco), 小牛血清, 胰蛋白酶、HEPES、L-谷氨酰胺、焦碳酸二乙酯(DEPC)(Amresco), 四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)(Sigma), 细胞培养瓶、96孔细胞培养板(Nunc), Trizol试剂、RNA酶抑制剂(Gibco), 三氯甲烷、无水乙醇、异丙醇(分析醇)购于上海化学试剂总公司, dNTP mixture (10 mmol/L)、TaqDNA寡合酶(5 MU/L)(Takara), oligo(dT)、RT-RCR引物合成(上海生工生物公司), M-MLV逆转录酶: Peomega公司产品, PCR Mark: 100 bp DNA Ladder(上海生工生物公司), 琼脂糖(华美公司), QIAamp DNA Mini kit(Germany, Cat.No.51304)
人胃癌细胞系MKN-45和HGC-27培养, MTT比色实验筛选对细胞的生长无显著性影响的5-aza-dC浓度和时间.细胞培养和相应药物浓度时间的干预, Trizol等相关试剂抽提细胞RNA, RT-PCR扩增p16INK4A, p21WAF1, p53, c-Ha-ras和c-myc基因, 引物序列见表1, 反应体系如下(25 μL): 10×buffer 2.5 μL, Mg2+ 1.5 μL, dNTP 0.5 μL, 引物1 1 μL(10 pmol), 引物2 1μL(10 pmol), cDNA 2.0 μL, Taq酶1.5 U, 琼脂糖电泳分析.流式细胞仪检测相关细胞周期.QIAamp DNA Mini kit抽提5-aza-dC干预后的和对照组的MKN-45和HGC-27细胞DNA.DNA亚硫酸氢盐处理: 取5 μg DNA加NaOH至终浓度为0.2 mol/L, 37℃变性10 min, 向变性DNA中加入新鲜配置的10 mmol/L的氰醌30 μL及3 mol/L的亚硫酸氢钠(pH = 5)520 μL, 加入矿物油200 μL, 样品于50℃孵育16 h, 修饰后的DNA根据说明书用Wizerd DNA 纯化树脂(Promega)纯化, 用水50 μL洗脱.加5.5 μL 3 mol/L NaOH至洗脱液, 室温放置5 min, 加17 μL 10 mol/L的醋酸胺, 糖原1 μL及95O mL/L冰冷乙醇500 μL过夜, 14 000 g 4℃离心30 min, 以70O mL/L乙醇洗沉淀物, 真空干燥, 加水20 μL, 冻存-70℃或MSP和测序.设计巢式PCR引物及MSP引物见表2, 巢式PCR扩增体系1(25 μL): 10×buffer 2.5 μL, Mg2+ 3 μL, dNTP 2 μL, 引物1 2 μL(10 pmol/L), 引物2 2 μL(10 pmol/L), 亚硫酸氢钠处理后的DNA 6 μL, Taq酶 1.5 U, 水补足体系至25 μL, PCR体系2(25 μL)10×buffer 2.5 μL, Mg2+ 3 μL, dNTP 2 μL, 引物1 2 μL(10 pmol), 引物2 2 μL(10 pmol), DNA 6 μL, Taq酶1.5 U, 水补足体系至25 μL, 加入物为PCR体系1产物, 对产物p16INK4A启动子测序, MSP检测c-myc甲基化.
| 引物 | 正义(5'→3') | 反义(5'→3') | 反应条件及产物大小 | GeneBank Number |
| β-Actin | GGC ATC GTG | GCT GGA AGG | 94℃ 5 min, 92℃ 40 s, 58℃ 40 s, 72℃ 50 s | BC023204 |
| ATG GAC TCC G | TGG ACA GCG A | 30 cycle, 72℃ 5 min; 612 bp | ||
| p16INK4A | CCC GCT TTC | TTA TTT GAG | 94℃ 5 min, 94℃ 1 min, 58℃ 1 min, 72℃ | L27211 |
| GTA GTT TTC AT | CTT TGG TTC TG | 1 min, 30 cycle, 72℃ 5 min; 355 bp | ||
| p21WAF1 | CCC AGT GGA | ACT GCA GGC | 94℃ 5 min, 92℃ 40 s, 58℃ 40 s, 72℃ | S 67388 |
| CAG CGA GCA GC | TTC CTG TGG GC | 1 min, 30 cycle, 73℃ 5 min; 450 bp | ||
| p53 | CAG CCA AGT CTG | CTA TGT CGA AAA | 94℃ 5 min, 94℃ 30 s, 65℃ 1 min, 72℃ | XM 008679 |
| TGA CTT GCA CGT AC | GTG TTT CTG TCA TC | 1 min, 30 cycle, 72℃ 5 min; 292 bp | ||
| c-myc | CCA ACA GGA | CTC GGT CAC CAT | 94℃ 5 min, 94℃ 1 min, 52℃ 1 min | V00568 |
| GCT ATG ACC TC | CTC CAG CT | 72℃ 1 min, 30 cycle, 72℃ 5 min; 290 bp | ||
| c-Ha-ras | CAA GAG TGC | CCG GAT CTC ACG | 95℃ 5 min, 95℃ 1 min, 63℃ 1 min | BC006499 |
| GCT GAC CAT CC | CAC CAA C | 72℃ 1 min, 30 cycle, 72℃ 5 min; 420 bp |
| 引物 | 正义(5'→3') | 反义 (5'→3') | 反应条件及产物大小 | GeneBank Number |
| p16INK4A SecA1 | GTA GGT GGG GAG | TCT AAT AAC CAA CCA | 95℃ 5 min, 95℃ 1 min, 60℃ 1 min | AF022809 |
| GAG TTT AGT T | ACC CCT CC | 72℃ 1 min, 40 cycle, 72℃ 5 min; 280 bp | ||
| p16INK4A SecA2 | GGG GGA GAT | CCC TCC TCT | 95℃ 5 min, 95℃ 1 min, 60℃ 1 min | AF022809 |
| TTA ATT TGG | TTC TTC CTC | 72℃ 1 min, 40 cycle, 72℃ 5 min; 190 bp | ||
| c-myc meth-MSP | TAG AAT TGG | CGA CCG AAA ATC | 95℃ 5 min, 95℃ 1 min, 56℃ 2 min | AF002859 |
| (exon1-2) | ATC GGG GTA AA | AAC GCG AAT | 72℃ 3 min, 5 cycle, 95℃ 30 s; 131 bp 56℃ 30 s, 72℃ 1 min, 35 cycle, 72℃ 5 min | |
| c-myc unme-MSP | TAG AAT TGG | CCA ACC AAA AAT | 95℃ 5 min, 95℃ 1 min, 56℃ 2 min; 132 bp | AF002859 |
| (exon1-2) | ATT GGG GTA AA | CAA CAT GAA T | 72℃ 3 min, 5 cycle; 95℃ 30 s, 56℃ 30 s, 72℃ 1 min, 35 cycle; 72℃ 5 min |
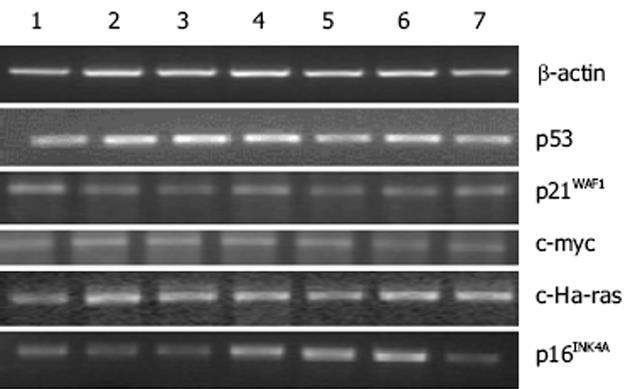
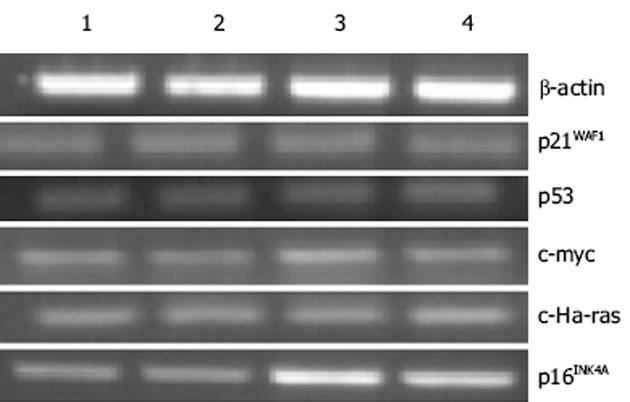
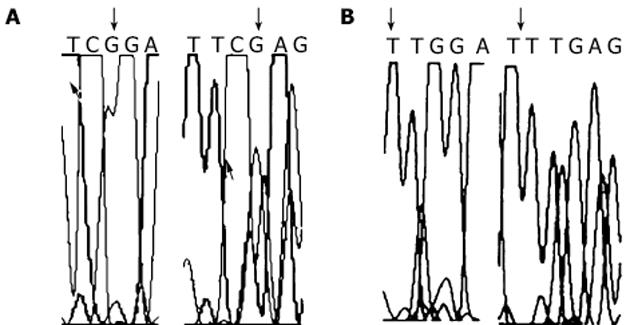
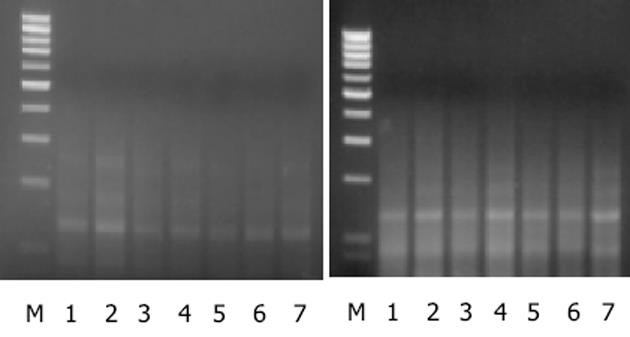
未分化胃癌细胞HGC-27细胞在2 μmol/L、5 μmol/L、10 μmol/L 5-aza-dC干预72 h后细胞死亡, 故未对其进行MTT实验.试验表明与对照组相比, 浓度为2 μmol/L, 5 μmol/L, 10 μmol/L5-aza-dC 24 h干预HGC-27胃癌细胞时, 对细胞活力没有明显变化(P>0.05).p16INK4A在MKN-45细胞系的10 μmol/L 24 h、2 μmol/L 72 h、5 μmol/L 72 h组处理后增强, 且表达的增强与处理时间和剂量不呈依赖关系, 而p53, p21WAF1, c-myc, c-Ha-ras的处理前后表达无明显变化(图1).p16INK4A在HGC-27细胞系的5 μmol/L 24 h组和10 μmol/L 24 h组处理后表达增强, 且表达的增强与处理时间和剂量不呈依赖关系, 而p53, p21WAF1, c-myc, c-Ha-ras的处理前后表达无明显变化(图2).肿瘤相关基因p53, p21WAF1, c-myc, c-Ha-ras在5-aza-dC处理前后没有明显关系, 说明甲基化对上述基因mRNA表达的影响不明显.抑癌基因p16INK4A在不同浓度5-aza-dC干预下有不同程度的表达增强, 以ACTIN为对照进行光密度扫描.干预前MKN-45和HGC-27细胞02和88.2, 5, 10 μmol/L 5-aza-dC干预24 h为106, 131, 141和118, 141, 135; 72 h为151, 165, 138.采用流式细胞仪检测细胞周期, 与未处理对照组比较P<0.05(表3).对PCR体系2产物进行测序, 结果显示p16INK4A因5'端, 对照组甲基化片段(图3A)中所有的CpG二核苷酸中的胞嘧啶保持不变, 而5 μmol/5-aza-dC干预组中非甲基化片断(图3B)中所有的胞嘧啶都变成了胸腺嘧啶.HGC-27细胞c-myc MSP结果表明HGC-27细胞的c-myc中有异常甲基化现象, 甲基化和非甲基化碱基共存, 且在去甲基化试剂处理前后没有明显变化(图4).MKN-45细胞的c-myc中也有异常甲基化现象, 甲基化和非甲基化碱基共存, 且在去甲基化试剂处理前后没有明显变化(图5).
| 分组 | G0/G1 | S | G2/M |
| HGC-27对照组 | 43.7±2.78 | 46.8±5.95 | 11.5±4.98 |
| 2 μmol/L 5-aza-dC | 47.5±1.36 | 39.4±0.51 | 13.1±1.25 |
| 5 μmol/L 5-aza-dC | 51.8±1.61a | 31.3±1.60a | 17.0±0.38a |
| 10 μmol/L 5-aza-dC | 51.4±2.34a | 32.5±1.91a | 17.1±3.13a |
| MKN-45对照组 | 70.4±0.75 | 19.3±0.15 | 10.3±0.67 |
| 2 μmol/L 5-aza-dC | 63.6±7.21 | 23.9±5.43 | 12.5±1.79 |
| 5 μmol/L 5-aza-dC | 63.0±6.29 | 24.4±5.16 | 12.6±1.36 |
| 10 μmol/L 5-aza-dC | 69.9±3.14 | 19.3±2.90 | 10.9±1.17 |
在人类肿瘤中基因已知的三个失活途径包括: 缺失, 点突变和启动子甲基化, 后者属于表观遗传变化(epigenetic changes).DNA甲基化是指由DNA甲基化转移酶(DNA methyltransferase, DNMT)催化的DNA的一种天然修饰方式, 他广泛存在于细菌、植物和哺乳动物, 在真核生物中DNA甲基转移酶以S-腺苷甲硫氨酸(S-adenosyl-methionine, SAM)为甲基供体将甲基转移到胞嘧啶第五位碳原子上.甲基化的胞嘧啶多位于CpG岛上, 在DNA双链中呈对称性分布.
现已证实, DNA甲基化在肿瘤的发生和发展中扮演着极其重要的角色, DNA甲基化异常是通过影响癌基因和抑癌基因的表达以及基因组的稳定性而参与肿瘤的发生和发展的.近来人们发现肿瘤细胞的总基因组甲基化水平比正常细胞低, 但是伴有某些特定CpG岛甲基化程度的增高.抑癌基因的高度广泛甲基化使DNA发生转录抑制, 抑癌基因的不能表达参与了肿瘤的发生.转录抑制机制可能是: 1.CpG岛甲基化直接干扰转录因子(transcriptive factor, TF)与调控区DNA的结合, 如CAMP反应元件结合蛋白、AP-2、E2F等之后, TF不能于其相应的甲基化DNA结合位点相结合; 2.甲基化DNA结合蛋白(MBD2)以及甲基胞嘧啶结合蛋白1和2(methylation binding proteins 1 and 2, MeCP1 and MeCP2)与甲基化DNA特异结合, 抑制基因转录; 3.DNA甲基化也可以改变染色质结构, 间接抑制基因转录.癌基因和抑癌基因的甲基化与肿瘤的发生和发展之间的关系已成为肿瘤研究的另一热点.
我们采用体外培养胃癌细胞株研究甲基化与胃癌的关系.首先MTT比色法测定发现, 给予的5-aza-dC药物浓度和时间对细胞的生长没有明显影响后, RT-PCR检测到两种细胞株的癌基因c-myc、c-Ha-ras和抑癌基因p21WAF1、p53在处理前后表达没有明显变化, 说明甲基化对这两种细胞系的这几种基因mRNA表达影响不大, 而p16INK4A在HGC-27细胞系的5 μmol/L 24 h组和10 μmol/L 24 h组处理后表达增强, MKN-45细胞系的10 μmol/L 24 h、2 μmol/L 72 h、5 μmol/L 72 h组处理后增强, 且表达的增强与处理时间和剂量不呈依赖关系, 提示各种细胞对5-aza-dC的敏感剂量各不相同, 这可能对今后选择药物的时间和剂量具有借鉴作用.
p16INK4A基因是一抑癌基因, 除了等位基因缺失罕见的失活性突变外, 多数的研究表明p16INK4A基因启动子部位的甲基化的紊乱是基因静默的主要机制[1-6].p16INK4A基因5-CpG岛甲基化已经被证实并且与脑瘤、颈部肿瘤、肺癌、胃癌、食管癌和膀胱癌的转录抑制有密切的关系, 而且用5-aza-dC干预甲基化的细胞群导致启动子区域甲基化水平的严重下降而使p16INK4A基因重新表达.
Lee et al[7]发现原发性胃癌中p16INK4A基因的mRNA转录缺陷往往因为DNA甲基化的紊乱.他们认为DNA甲基化可能是p16INK4A基因失活的一条途径, 由此可进而发展为胃癌.5'端和第1外显子的异常甲基化, 使p16INK4A基因在有些人胃癌细胞系中不能被检出, 且此转录抑制可因为应用5-aza(5-aza-dC类似物)而逆转.Shim et al[8]也用MSP检测到胃癌中的p16INK4A甲基水平: 42%胃癌有高甲基化, 高甲基化病例中(19/22)有完全p16INK4A的活性丢失, 而未甲基化病例19人中只有2人.p16INK4A高甲基化同免疫活性的相关性分析表明甲基化是胃癌中p16INK4A失活的重要机制.有学者[9]采用亚硫酸氢盐修饰和测序分析了9个胃癌细胞系, 发现p16INK4A表达失活伴同其启动子区的高甲基化.28例患者中的6例有p16INK4A表达缺失, 5例有启动子区甲基化.这表明启动子区特殊CpG岛的从头甲基化与p16INK4A的转录静默有明显关系, RT-PCR实验结果也初步的证实了p16INK4A基因的mRNA表达受甲基化调控.我们采用了同一方法检测发现, 在启动子区存在甲基化, 使该细胞基因的表达减少, 去甲基化试剂处理后, 使其甲基化程度减少.序列分析中对照组在亚硫酸氢盐处理后CG没有变化, 说明其中的C是甲基化的, 而去甲基化处理后CG在亚硫酸氢盐处理后变为TG, 说明其中的C是非甲基化的, 这可以解释处理组中的p16INK4A表达增强.我们还对癌基因c-myc DNA进行甲基化特异性PCR(MSP)分析[10].证明c-myc DNA中有异常甲基化现象, 甲基化和非甲基化碱基共存, 且在去甲基化试剂处理前后没有明显变化, 这也解释了在这两种细胞中去甲基化试剂对癌基因的表达没有造成明显影响的原因.
p53和p21WAF1是重要的抑癌基因, 参与细胞增殖、监视DNA损伤和诱导细胞凋亡、影响其他基因表达.但是在此肿瘤细胞系中未发现甲基化对其mRNA表达的影响不大.Shin[11]博士的结果也显示胃癌细胞中p21WAF1基因启动子并未甲基化, 说明甲基化并不是胃癌细胞中p21WAF1失活的机制.c-myc和c-Ha-ras是胃癌中的癌基因, 参与多种细胞功能, 通常在正常组织的c-myc基因3'端C.既往的研究结果表明c-myc基因在胃癌和肝癌发生中低甲基化[12-13].c-Ha-ras的CGCG序列在胃癌、肺癌以及肝癌中甲基化程度降低, 但是我的研究未能得到此结论.这可能与细胞系种类有关, 可能在这两种细胞系中癌基因的甲基化紊乱不起主要作用.
我们对细胞周期的研究也有部分发现.细胞周期中各期均有其相应的周期素(cycline)、周期素依赖激酶(CDK)和周期素依赖激酶抑制剂(CDKI)控制.CDKI可抑制细胞周期进程, 例如p16INK4A、p21WAF1、p27KIP1、p57KIP2等都是对细胞周期起负调控作用的CDKI.一旦p16INK4A基因失活, 可导致CDK激活, 细胞过度增殖, 细胞周期加速, 特别是在DNA没有被修复前就过早地进入S期, 会导致肿瘤的发生.我们研究了两种细胞周期后发现HGC-27细胞在5-aza-dC 5 μmol/L和10 μmol/L 24 h组细胞阻滞于G1期(P<0.05), 而MKN-45细胞没有这种现象, 说明这种阻滞可能与p16INK4A恢复表达量有关, 可能p16INK4A表达到一定水平时, 才能发挥其对细胞周期的调控作用.上述结果可能得出: 5-aza-dC通过恢复p16INK4A阻止细胞过度增殖作用, 有组织特异性.即组织来源不同, 5-aza-dC的G1期阻滞作用表现很大差异, 可能与作用与p16INK4A功能尚未完全恢复有关.这与国外学者和国内学者的研究结果一致[14-16].本研究还表明HGC-27细胞的G2/M期阻滞也有意义, 现有研究阶段表明G2/M的调控机制受p53、p21WAF1和不依赖p53所影响, 但是细胞周期受多种基因和细胞因子的调控, 其机制复杂而又不完善, 有许多环节尚未被认识, 有待今后进一步研究.
总之, 本实验首次在同一胃癌细胞系中同时观察多个基因是否为甲基化调控, 显示了在人胃癌细胞系MKN-45和HGC-27中, 去甲基化能明显提高p16INK4AmRNA的表达, 表明p16INK4A启动子甲基化是其在表达减弱的主要原因, 且去甲基化程度取决于5-aza-dC干预的时间和浓度.
感谢罗鸿妤和沈冠凤协助流式细胞仪分析, 童菊芳和李恩灵在细胞培养工作的帮助!
编辑: 潘伯荣 审读: 张海宁
| 1. | Rocco JW, Didransky D. p16 (MTS-1/CDKN2/INK4a) in cancer progression. Exp Cell Res. 2001;264:42-55. [PubMed] [DOI] |
| 2. | Merlo A, Herman JG, Mao L, Lee DJ, Gabrielson E, Burger PC, Baylin SB, Sidransky D. 5 CpG island methylation is associated with transcriptional silencing of the tumour suppressor p16/CDKN2/MTS1 in human cancers. Nat Med. 1995;1:686-692. [PubMed] [DOI] |
| 3. | Gonzalez-Zulueta M, Bender CM, Yang AS, Nguyen T, Beart RW, Van Tornout JM, Jones PA. Methylation of the 5 CpG island of the p16/CDKN2 tumor suppressor gene in normal and transformed human tissues correlates with gene silencing. Cancer Res. 1995;55:4531-4535. [PubMed] |
| 4. | Sakuma K, Chong JM, Sudo M, Ushiku T, Inoue Y, Shibahara J, Uozaki H, Nagai H, Fukayama M. High-density methylation of p14ARF and p16INK4A in Epstein-Barr virus-associated gastric carcinoma. Int J Cancer. 2004;112:273-278. [PubMed] [DOI] |
| 5. | Koike H, Ichikawa D, Ikoma H, Otsuji E, Kitamura K, Yamagishi H. Comparison of methylation-specific polymerase chain reaction (MSP) with reverse transcriptase-polymerase chain reaction (RT-PCR) in peripheral blood of gastric cancer patients. J Surg Oncol. 2004;87:182-186. [PubMed] [DOI] |
| 6. | Ichikawa D, Koike H, Ikoma H, Ikoma D, Tani N, Otsuji E, Kitamura K, Yamagishi H. Detection of aberrant methylation as a tumor marker in serum of patients with gastric cancer. Anticancer Res. 2004;24:2477-2481. [PubMed] |
| 7. | Lee YY, Kang SH, Seo JY, Jung CW, Lee KU, Choe KJ, Kim BK, Kim NK, Koeffler HP, Bang YJ. Alteration of p16INK4a and p15 INK4B genes in gastric carcinomas. Cancer. 1997;80:1889-1896. [PubMed] [DOI] |
| 8. | Shim YH, Kang HG, Ro JY. Correlation of p16 hypermethylation with p16 protein loss in sporadic gastric carcinomas. Lab Invest. 2000;80:689-695. [PubMed] [DOI] |
| 9. | Song SH, Jong HS, Choi HH, Kang SH, Ryu MH, Kim NK, Kim WH, Bang YJ. Methylation of specific CpG sites in the promoter region could significantly down-regulate p16 (INK4a) expression in gastric adenocarcinoma. Int J Cancer. 2000;87:236-240. [PubMed] [DOI] |
| 10. | Herman JG, Graff JR, Myohanen S, Neldin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG island. Proc Natl Acad Sci USA. 1996;93:9821-9826. [PubMed] [DOI] |
| 11. | Shin JY, Kim HS, Park J, Park JB, Lee JY. Mechanism for inactivation of the KIP family cyclin-dependent kinase inhibitor genes in gastric cancer cells. Cancer Res. 2000;60:262-265. [PubMed] |
| 12. | Shen L, Fang J, Qiu D, Zhang T, Yang J, Chen S, Xiao S. Correlation between DNA methylation and pathological changes in human hepatocellular carcinoma. Hepatogastro- enterology. 1998;45:1753-1759. [PubMed] |
| 13. | Fang JY, Zhu SS, Xiao SD, Jiang SJ, Shi Y, Chen XY, Zhou XM, Qian LF. Studies on the hypomethylation of c-myc, c-Ha-ras oncogenes and histopathological changes in human gastric carcinoma. J Gastroenterol Hepatol. 1996;11:1079-1082. [PubMed] [DOI] |
| 16. | Bender CM, Pao MM, Jones PA. Inhibition of DNA methylation by 5-aza-2-deoxycytidine suppresses the growth of human tumor cell lines. Cancer Res. 1998;58:95-101. [PubMed] |