修回日期: 2005-03-28
接受日期: 2005-04-08
在线出版日期: 2005-06-28
目的: 研究多核点型抗核抗体对原发性胆汁性肝硬化患者的临床意义.
方法: 原发性胆汁性肝硬化患者35例, 对照组选择慢性乙型肝炎患者8例, 慢性丙型肝炎患者5例, 干燥综合征患者10例, 自身免疫性肝炎患者5例, 5例正常人.采用间接免疫荧光法和免疫印迹法检测多核点抗核抗体(MND-ANA).
结果: 间接免疫荧光法检测结果, MND-ANA出现在12例PBC患者中, 阳性率为34%, 对照组仅2例阳性.MND-ANA出现在57%抗线粒体抗体阴性PBC患者中, 抗线粒体抗体阳性PBC患者MND-ANA阳性率仅为28%, 统计学无显著性差异(P = 1.958).免疫印迹法检测结果35例PBC患者中抗-Sp100阳性10例(10/35, 28.5%), 对照组仅干燥综合征患者出现1例抗-Sp100阳性.另外观察到8例PBC患者存在针对Mr 20 ku细胞核蛋白的自身抗体, 并且此抗体常常和抗-Sp100同时出现.抗-Sp20阳性为8例(8/35, 22%), 抗-Sp100和抗-Sp20同时阳性为6例(6/35, 17%), 仅抗-Sp100阳性为4例(4/35, 11%)和仅抗-Sp20阳性2例(2/35, 5%).抗-Sp100阳性与阴性患者在年龄、生化指标及病理分期上差异无显著性, 抗-Sp100阳性患者免疫球蛋白IgG的水平高于抗-Sp100阴性的患者, P值为0.008.
结论: MND-ANA有助于线粒体阴性PBC患者的诊断.
引文著录: 邵杰, 魏来, 王豪, 孙炎. 原发性胆汁性肝硬化患者中多核点型抗核抗体的检测. 世界华人消化杂志 2005; 13(12): 1478-1481
Revised: March 28, 2005
Accepted: April 8, 2005
Published online: June 28, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(12): 1478-1481
- URL: https://www.wjgnet.com/1009-3079/full/v13/i12/1478.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i12.1478
原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)是一种病因不清的慢性进行性胆汁淤积性自身免疫性肝病, 组织病理学出现肝内小胆管的非化脓性炎症病变.超过90%的PBC患者血清中可出现抗线粒体抗体(anti-mitochondrial antibodies, AMA), 所以AMA是PBC的血清学诊断标志[1].利用间接免疫荧光法(indirect immunofluoresence, IF), PBC患者出现两种不同的抗核抗体(antinuclear antibody, ANA)荧光染色: 多核点型(multiple nuclear dots, MND)抗核抗体和核膜型抗核抗体(nuclear envelope, NE), 被认为是PBC特异性抗体[2].其中MND-ANA主要识别两种细胞核蛋白, Sp100和早幼粒细胞白血病抗原(promyelocytic leukemia antigen, PML).我们采用IF和免疫印迹法(immunology blot, IB)检测PBC患者中MND-ANA和抗-Sp100抗体, 同时观察到针对分子质量为20 ku细胞核蛋白的自身抗体, 暂称之为抗-Sp20抗体.本文总结MND-ANA和抗-Sp100抗体在疾病诊断和临床致病中的意义.
我院的住院及门诊PBC患者35例, 其中女性34例, 男性1例, 年龄34-77岁, 平均(54.5±10.3)岁.对照组选择慢性乙型肝炎患者8例, 慢性丙型肝炎患者5例, 干燥综合征患者10例, 自身免疫性肝炎患者5例, 5名正常人.每位患者均具有详细的临床资料, 研究所用的血清-20℃保存.诊断标准: PBC参考2000年AASLD(美国肝病学会)的诊断指南[3](1)血清碱性磷酸酶等胆汁淤积指标升高; (2)通过腹部B超或CT排除其他胆道梗阻因素; (3)血清AMA或AMA-M2亚型阳性; (4)AMA阴性患者则进行肝脏组织学检查, 符合PBC的病理改变.慢性乙型肝炎和慢性丙型肝炎诊断符合全国传染病及肝病年会所制定标准.干燥综合征采用2002年欧洲-美国干燥综合征的诊断标准[4]自身免疫性肝炎诊断参照国际自身免疫性肝炎联盟的诊断指标[5].肝脏病理学检查: 32例PBC患者进行肝脏病理检查, 肝组织常规石蜡包埋, HE及Masson染色, 由同一位病理医师阅片.组织学分期参照以下标准: Ⅰ期为汇管区炎症仅限于汇管三角; Ⅱ期为显著的汇管及汇管周围炎症, 无间隔纤维化或桥接样坏死; Ⅲ为小叶纤维化和/或桥接样坏死; Ⅳ期为肝硬化[6].
1.2.1 细胞核分离: 胆管癌细胞RBE加入细胞裂解液, 反应15 min, 裂解的细胞12 000 g离心裂解2 min.分别保存上清和细胞核.以上均在4℃及蛋白酶抑制剂PMSF条件下操作[7].
1.2.2 间接免疫荧光: 盖玻片置于6孔板, 接种胆管癌细胞RBE, 标准条件培养.爬片后用PBS洗涤, 冷40 g/L多聚甲醛室温固定.PBS冲洗, 5 g/L Triton PBS反应10 min.加入1∶50患者血清, 37℃ 1 h.PBS冲洗, 加入1∶5异硫氰酸荧光素标记的抗人IgG, 37℃反应30 min PBS冲洗, 封片后荧光显微镜下观察结果.
1.2.3 免疫印迹法: 180 g/LSDS-PAGE电泳分离RBE细胞核蛋白.电泳结束后转膜, 含50g/L脱脂奶粉的封闭液中37℃封闭2 h.将硝酸纤维膜裁成条带, 加入1∶1 000的待测患者血清, 4℃ 2 h.与1∶5 000稀释的辣根过氧化物酶标记的羊抗人IgG抗体, 室温45 min.将反应条带浸入显色液中, 覆以X光片, 曝光, 洗片.
统计学处理 应用SPSS10.0统计软件包进行统计学处理, 计量资料以mean±SD表示; 两组间计量资料比较用t检验, 计数资料用χ2检验, P<0.05为差异有统计学意义.
利用RBE细胞观察35例患者的ANA免疫荧光模式, 其中12例(12/35, 34%)多核点型荧光染色阳性, 6例(6/35, 17%)为核膜型, 2例(2/35, 5%)为着丝点型, 1例为均质型, 2例为斑型.12例MND-ANA阳性患者中4例为AMA阴性PBC患者(4/7, 57%), 8例为AMA阳性PBC患者(8/28, 28%).对照组中10例干燥综合征患者1例MND-ANA阳性, 1例为着丝点型, 4例为斑型.5例AIH患者中3例为均质型ANA, 1例为斑型ANA, 1例为MND-ANA阳性.而慢性乙型肝炎、慢性丙型肝炎和正常人对照均为阴性(表1).
| n | ANA | NE | MND | ACA | Ho | Sp | |
| PBC | 35 | 23(65%) | 6 | 12 | 2 | 1 | 2 |
| AIH | 5 | 5(100%) | 0 | 1 | 0 | 3 | 1 |
| CHB | 8 | 0 | 0 | 0 | 0 | 0 | 0 |
| CHC | 5 | 0 | 0 | 0 | 0 | 0 | 0 |
| SS | 10 | 6(60%) | 0 | 1 | 1 | 0 | 4 |
| HS | 5 | 0 | 0 | 0 | 0 | 0 | 0 |
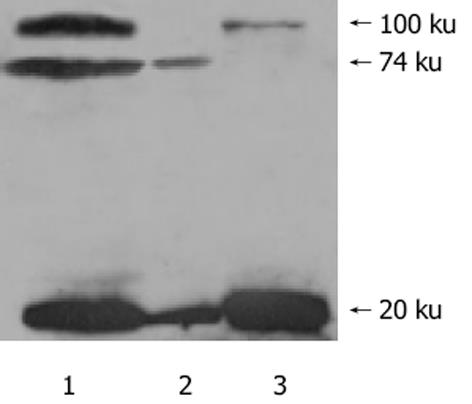
以完整细胞、细胞质和细胞核为抗原进行免疫印迹的检测, 结果见图1.以完整细胞为抗原的第三组出现分子质量为100 ku、74 ku和20 ku的蛋白条带; 以细胞质为抗原的实验组出现分子质量74 ku和20 ku的两个蛋白条带, 已知AMA的主要抗原是位于线粒体内膜的PDC-E2, 其分子质量为为74 ku; 以细胞核为抗原的实验组中出现分子质量100 ku和20 ku的蛋白条带, 根据Sp100在SDS-PAGE的电泳情况, 判断其为抗-Sp100阳性.
35例患者中抗-Sp100阳性10例(10/35, 28.5%), 对照组仅干燥综合征患者出现1例抗-Sp100阳性.抗-Sp20阳性为8例(8/35, 22%), 抗-Sp100和抗-Sp20同时阳性为6例(6/35, 17%), 仅抗-Sp100阳性为4例(4/35, 11%)和仅抗-Sp20阳性2例(2/35, 5%)(表2).
| n | % | |
| 抗-Sp100阳性 | 10 | 28.5 |
| 抗-Sp20阳性 | 8 | 22 |
| 仅抗-Sp100阳性 | 4 | 11 |
| 仅抗-Sp20阳性 | 2 | 5 |
| 抗-Sp100和抗-Sp20 | 6 | 17 |
| 抗-Sp100和/或抗-Sp20 | 12 | 34 |
患者的临床资料如表3, 包括年龄、生化、免疫及病理学指标, ALT、AST、TBIL、ALP、GGT、IgG、IgA、IgM.
| 抗-Sp100阳性 | 抗-Sp100阴性 | P值 | |
| 年龄(岁) | 54.0±6.1 | 58.4±12.9 | 0.197 |
| ALT(nkat/L) | 1 550.3±1 016.8 | 1 500.3±2 167.1 | 0.948 |
| AST(nkat/L) | 1 667.0±1 183.5 | 1 633.6±1 083.5 | 0.958 |
| ALP(nkat/L) | 7 901.5±7 251.4 | 7 518.1±5 284.3 | 0.862 |
| GGT(nkat/L) | 6 317.9±5 867.8 | 5 884.5±4 367.5 | 0.812 |
| TBIL(μmol/L) | 25.1±20.6 | 41.5±36.9 | 0.105 |
| IgG(g/L) | 21.7±4.6 | 16.2±4.8 | 0.008 |
| IgA(g/L) | 5.0±1.2 | 3.9±3.4 | 0.375 |
| IgM(g/L) | 6.2±3.8 | 4.8±2.7 | 0.249 |
| AMA(n) | 10 | 25 | 1.958 |
| 病理早期(Ⅰ/Ⅱ) | 3 | 6 | |
| 病理晚期(Ⅲ/Ⅳ) | 6 | 17 | 0.685 |
象其他自身免疫性疾病一样, PBC患者除AMA外也存在ANA, 利用间接免疫荧光法, ANA的染色模式有多核点型、斑型、核膜型、均质型、着丝点型、核仁型等, 研究提示多核点型和核膜型的ANA是PBC患者特异性自身抗体.十年前多个研究小组已经描述了多核点型ANA这种免疫荧光模式, 该荧光模式的特点是出现3-20个不同大小的点状染色(大小约0.3-1 μm), 分布在除核仁以外的整个细胞核中[8].
研究证实[2]MND-ANA识别位于核体(nuclear body, NBs)上的蛋白, NBs又称为ND10或Kr体.NBs是一种和核基质相关的多蛋白复合体, 包括Sp 100、PML、NDP55、SUMO-1(small ubiquitin-mediated protein)、rfp(ret finger protein)等.Sp 100蛋白是一个磷酸化的细胞核蛋白, 电泳移动时对应的分子质量为100 ku.1987年Szostecki et al[9]观察到PBC患者出现的MND-ANA可识别分子质量约100 ku的蛋白, 将该蛋白称之为Sp 100, 后来的研究也证实了上述结果[10].已知Sp 100是一转录活化因子, 以下条件下都可观察到Sp 100蛋白水平和mRNA水平的升高, 如用SV40和JC病毒转化细胞, 或者用有丝分裂原刺激淋巴细胞, 以及I和II型干扰素处理细胞[8].除此之外对Sp 100的功能所知甚少.目前认为抗-Sp 100是PBC特异性自身抗体, 但是抗PML是否也是PBC特异性的自身抗体存在争议[2].
本研究采用IF法在35例PBC患者中检测到12例MND-ANA阳性者, MND-ANA在PBC患者中的阳性率为34%; 对照组仅在干燥综合征和自身免疫性肝炎患者分别出现1例阳性(7%), 推断MND-ANA是PBC特异性自身抗体, 和国外的研究结论相符[8].Luettig et al[11]对因PBC而进行肝移植手术患者的随访中, 发现患者在移植术后尽管ANA的滴度明显下降, 但是血清中ANA却持续存在而且ANA的免疫荧光反应模式也未改变.进一步提示MND-ANA是特异性自身抗体, 在病变靶器官去除的情况下该抗体仍然存在.
MND-ANA出现在57%AMA阴性PBC患者中, AMA阳性PBC患者MND-ANA阳性率仅为28%, 虽然统计学无显著性差异, 但显示MND-ANA更多见于AMA阴性PBC患者.AMA是PBC诊断的血清学标志, 采用IF法AMA的阳性率约80%, 而采用更加敏感的方法如酶联免疫吸附法或免疫印迹法, 仍有5-10%的PBC患者AMA为阴性[12].从本文的研究结果结合以往的资料[8], 建议对于那些临床和组织学符合PBC的诊断标准而AMA却为阴性的患者, MND-ANA的检测有助于PBC的诊断, 从而避免对AMA阴性PBC患者诊断的遗漏和延误.
IF是临床上检测自身抗体常用的方法, 他简便易行且可以同时检测针对细胞质和细胞核不同抗原的自身抗体, 但是其敏感性低又无法区分与特异性靶抗原反应的自身抗体.所以在IF的基础上, 我们又利用免疫印迹法对MND-ANA阳性的PBC患者进行抗-Sp100抗体的检测分析.在我们的研究中, 35例PBC患者中抗-Sp100阳性者为10例, 阳性率为28.5%; 对照组患者中1例检测到抗-Sp100, 提示抗-Sp100是PBC特异性的自身抗体, 验证了以往国外研究的结论[13-14].
分析PBC患者中, IF和IB这两种方法对MND-ANA或抗-Sp100检测的敏感性和特异性.IF方法的敏感性为34%; 而IB法的敏感性为28.5%.IB对抗-Sp100检测的敏感性低于IF对MND-ANA的检测方法, 可能为除抗-Sp100外, 抗-PML也会出现MND-ANA的荧光模式, 而本文未对抗-PML进行检测.对PBC患者诊断特异性方面, IF为93%, 而IB为97%.因此IF和IB在诊断PBC特异性方面无差异.
我们也对比了抗-Sp100阳性与阴性患者的临床资料, 发现两组患者在年龄、生化指标及病理分期上无显著性差异, 但免疫学指标中抗-Sp100阳性患者免疫球蛋白IgG的水平高于抗-Sp100阴性的患者.而一项为期24 mo的随访研究中Zuchner et al[15]发现抗-Sp100阴性PBC患者相比, 抗-Sp100阳性的PBC患者病变由早期(病理I/II期)进展至晚期(病理III/IV期)者更多.抗-Sp100是否为判断PBC患者病情及预后的指标, 需要对更多的患者进行长期而详细的临床观察.
本文的资料显示在PBC病变早期和晚期患者中抗-Sp100阳性率无显著性差异, 说明抗-Sp100是在病变早期已经存在的抗体.那么作为PBC特异性的抗体, 抗-Sp100如何参与PBS的发病过程尚不清楚, 至今还没有研究可将Sp100与PBC的发病机制联系起来.
除Sp100以外, 我们还在8例PBC患者中观察到针对Mr 20 ku的自身抗体, 暂称抗-Sp20抗体.这些患者的间接免疫荧光检测多呈多核点型, 并且此抗体常常和抗-Sp100同时出现; 由于同时位于蛋白功能复合体或同一亚细胞器官内的蛋白往往是自身免疫反应的共同目标, 推测该蛋白有可能也是位于NBs结构上的蛋白.该蛋白的性质需要进一步鉴定.
编辑: 张海宁
| 1. | Kaplan MM. Primary biliary cirrhosis. N Engl J Med. 1996;335:1570-1580. [PubMed] [DOI] |
| 2. | Worman HJ, Courvalin J C. Antinuclear antibodies specific for primary biliary cirrhosis. Autoimmun Rev. 2003;2:211-217. [PubMed] [DOI] |
| 3. | Heathcote EJ. Management of primary biliary cirrhosis. The American Association for the Study of Liver Diseases practice guidelines. Hepatology. 2000;31:1005-1013. [PubMed] [DOI] |
| 4. | Vitali C, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE, Daniels TE, Fox PC, Fox RI, Kassan SS. Classification criteria for Sjogren's syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis. 2002;61:554-558. [PubMed] [DOI] |
| 5. | Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, Chapman RW, Cooksley WG, Czaja AJ, Desmet VJ. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31:929-998. [PubMed] [DOI] |
| 6. | Ludwig J, Dickson ER, McDonald GS. Staging of chronic nonsuppurative destructive cholangitis (syndrome of primary biliary cirrhosis). Virchows Arch A Pathol Anat Histol. 1978;379:103-112. [PubMed] [DOI] |
| 7. | 斯佩克特, 戈德曼, 莱因万德(著). 黄培堂(译). 细胞实验指南(下册). 第1版 北京: 科学出版社 2001; 368-377. |
| 8. | Szostecki C, Guldner HH, Will H. Autoantibodies against "nuclear dots" in primary biliary cirrhosis. Semin Liver Dis. 1997;17:71-78. [PubMed] [DOI] |
| 9. | Szostecki C, Krippner H, Penner E, Bautz FA. Autoimmune sera recognize a 100 kD nuclear protein antigen (sp-100). Clin Exp Immunol. 1987;68:108-116. [PubMed] |
| 10. | Evans J, Reuben A, Craft J. PBC 95K, a 95-kilodalton nuclear -autoantigen in primary biliary cirrhosis. Arthritis Rheum. 1991;34:731-736. [PubMed] [DOI] |
| 11. | Luettig B, Boeker KH, Schoessler W, Will H, Loges S, Schmidt E, Worman HJ, Gershwin ME, Manns MP. The antinuclear autoantibodies Sp100 and gp210 persist after orthotopic liver transplantation in patients with primary biliary cirrhosis. J Hepatol. 1998;28:824-828. [PubMed] [DOI] |
| 12. | Muratori P, Muratori L, Gershwin ME, Czaja AJ, Pappas G, MacCariello S, Granito A, Cassani F, Loria P, Lenzi M. 'True' antimitochondrial antibody-negative primary biliary cirrhosis, low sensitivity of the routine assays, or both? Clin Exp Immunol. 2004;135:154-158. [PubMed] [DOI] |
| 13. | Muratori P, Muratori L, Ferrari R, Cassani F, Bianchi G, Lenzi M, Rodrigo L, Linares A, Fuentes D, Bianchi FB. Characterization and clinical impact of antinuclear antibodies in primary biliary cirrhosis. Am J Gasteroenterol. 2003;98:431-437. [PubMed] [DOI] |
| 14. | Muratori P, Muratori L, Cassani F, Terlizzi P, Lenzi M, Rodrigo L, Bianchi FB. Anti-multiple nuclear dots (anti-MND) and anti-SP100 antibodies in hepatic and rheumatological disorders. Clin Exp Immunol. 2002;127:172-175. [PubMed] [DOI] |
| 15. | Zuchner D, Sternsdorf T, Szostecki C, Heathcote EJ, Cauch-Dudek K, Will H. Prevalence, kinetics, and therapeutic modulation of autoantibodies against Sp100 and promyelocytic leukemia protein in a large cohort of patients with primary biliary cirrhosis. Hepatology. 1997;26:1123-1130. [PubMed] |