修回日期: 2005-03-06
接受日期: 2005-03-16
在线出版日期: 2005-06-28
目的: 观察不同佐剂对不同剂量HCV DNA疫苗效果的影响.
方法: 雌性Balb/c小鼠分别用脂质体DDAB/EPC和氢氧化铝为佐剂的HCV DNA疫苗(由HCV结构基因、NS3和NS5b各50 mg或100 mg等量混合)免疫3次, ELISPOT法观察脾淋巴细胞受HCV核心、E2、E1/E2、NS3和NS5b蛋白刺激后细胞因子的产生.
结果: DDAB/EPC组产生IFN-g和IL-4较多, 用核心、E2或E1/E2刺激, 显著高于裸DNA和氢氧化铝组(P<0.05). 以氢氧化铝为佐剂用每种DNA100 mg剂量免疫的小鼠, 在受抗原刺激后, 除E2外, 其脾淋巴细胞产生IL-4的能力显著高于相应裸DNA组(P<0.05). 在多数情况下, 接受每种DNA10 mg剂量的小鼠产生IFN-g和IL-4的能力显著高于接种每种50 mg者(P<0.05). 与裸DNA组及DDAB/EPC组比较, 氢氧化铝组小鼠淋巴细胞产生的IL-4多于IFN-g.
结论: DDAB/EPC对HCV DNA疫苗有很强的免疫佐剂效应, 氢氧化铝是Th2佐剂, 可将DNA疫苗Th1为主的免疫特性转换为以Th2为主, 50 mg的HCV DNA疫苗似不能诱导小鼠产生有效的免疫反应.
引文著录: 金博, RichardY.-H.Wang, 程留芳, 裘奇, 史维国. 免疫佐剂对不同剂量丙肝核酸疫苗效果的影响. 世界华人消化杂志 2005; 13(12): 1429-1433
Revised: March 6, 2005
Accepted: March 16, 2005
Published online: June 28, 2005
AIM: To explore the effects of different adjuvants on different dosages of hepatitis C virus (HCV) DNA vaccine.
METHODS: Female Balb/c mice were primed by HCV DNA vaccine composed of HCV structure gene DNA, HCV nonstructure gene 3 (NS3) and NS5b at the dosages of either 100 mg/each or 50mg/each with liposome DDAB/EPC or aluminum hydroxide and boosted twice accordingly. The cytokine profiles induced by various HCV antigens on splenocytes from the immunized mice were assessed by ELISPOT assay using in vitro splenocyte culture stimulated with recombinant HCV core, E2, E1/E2, NS3 or NS5b protein.
RESULTS: The frequency of IFN-g or IL-4 secreting cells found in splenocytes stimulated with HCV core, E2, or E1/E2 from the mice vaccinated with HCV recombinant DNA in DDAB/EPC adjuvant was significantly higher (P<0.05) than that from mice immunized with either naked DNA or DNA formulated in aluminum hydroxide. The frequency of IL-4 secreting cells from mice immunized with HCV DNA at a dosage of 100 mg/each mixed with aluminum hydroxide was significantly higher than that from naked DNA when the splenocytes were stimulated with all the antigens tested except E2 (P<0.05). At many cases, lymphocytes from mice received 100 mg/each DNA have more IFN-g or IL-4 productions compared with those from mice with 50 mg/each (P<0.05). The lymphocytes from mice primed and boosted with HCV DNA plus aluminum hydroxide can produce more IL-4 than IFN-g in contrast with the cytokine profile of mice immunized with naked DNA or DDAB/EPC adjuvant.
CONCLUSION: Liposome DDAB/EPC has strong adjuvant effects on HCV DNA vaccine. Aluminum hydroxide is a Th2 adjuvant and can convert the Th1 nature of DNA vaccine to Th2-biased immunity. It seems that the dosage of 50 mg of HCV DNA vaccine is not adequate to elicit efficient immunity in mice.
- Citation: Jin B, Wang RYH, Cheng LF, Qiu Q, Shih JWK. Effects of Distinct Adjuvant on HCV DNA Vaccine at Different Dosages. Shijie Huaren Xiaohua Zazhi 2005; 13(12): 1429-1433
- URL: https://www.wjgnet.com/1009-3079/full/v13/i12/1429.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i12.1429
丙型病毒性肝炎是严重的全球性健康问题, 丙型肝炎病毒(hepatitis C virus, HCV)感染者占全球总人口的3%, 约有1.7亿人, 新感染者以1-3/100 000的速度递增[1].急性丙型肝炎患者有70%以上转变为慢性感染, 其中每年有1-4%的患者发展成肝细胞癌[2].在急性丙型肝炎患者病毒清除过程中, 细胞免疫发挥重要作用[3].DNA疫苗可诱导以I 型辅助性T细胞(T helper cell type I, Th1)介导的I型免疫反应, 对病毒感染后的清除发挥重要作用.为观察免疫佐剂对不同剂量HCV DNA疫苗效果的影响, 我们比较了小鼠接种两种不同类型佐剂辅佐的不同剂量HCV DNA疫苗后免疫反应的改变.
1.1.1 HCV-DNA重组质粒的构建: 将HCV1a型H株核心、E1、E2蛋白基因(表达1-746位氨基酸, 核酸位点342-2 579)插入pVAX1质粒(美国Invitrogen Corp.)Bam H1限制酶切点, 转化大肠杆菌增殖, 用EndoFree plasmid giga kit(美国Qiagen)纯化.将重组质粒转染CHO-K1细胞, 裂解细胞做Western blot, 确定可表达HCV核心和E1、E2蛋白, 表明该质粒重组成功.HCV-NS3、HCV-NS5b重组质粒的构建方法同上, 插入片段分别为HCV-NS3基因(表达1 027-1 657位氨基酸, 核酸位点3 420-5 312)和HCV-NS5b基因(表达2 421-3 011位氨基酸, 核酸位点7 602-9 374).
1.1.2 HCV重组蛋白抗原的制备: 将HCV-NS3基因(表达1 027-1 657位氨基酸, 核酸位点3 420-5 312)插入pQE-11质粒(美国Qiagen)的限制性内切酶Bam H1位点, 转化大肠杆菌DH5aF'IQ, Western blot选择阳性克隆增殖.溶菌酶溶解细菌, 聚丙烯酰胺凝胶电泳纯化蛋白(Mr 69 000), 鲎实验检测内毒素含量<0.02 EU/mg.同样方法表达HCV-NS5b基因(表达2 421-3 011位氨基酸, 核酸位点7 602-9 374)和HCV-E2基因(表达384-746位氨基酸, 核酸位点1 491-2 579), 制备HCV-NS5b重组蛋白(Mr 67 000)及截短型(truncated)HCV-E2重组蛋白.虽然插入HCV-E2全长基因, 且加入6种蛋白酶抑制剂, 但表达的HCV-E2蛋白仍为Mr 29 000而非Mr 40 000, 因此该蛋白为截短型[4].HCV核心蛋白[5]: HCV核心基因(表达1-164位氨基酸, 核酸位点342-833)插入pTrc99A质粒(美国Pharmacia)Nco I位点, 转化大肠杆菌表达, 聚丙烯酰胺凝胶电泳纯化(Mr 18 000).
1.1.3 佐剂与HCV DNA混合剂的制备: 将3.96 mmol溴化二甲基二八癸胺(Dimethyldioctadecylammonium, DDAB)与3.96 mmol卵黄卵磷脂(egg yolk phosphati-dylcholine, EPC)(美国Avanti Polar Lipids)氯仿溶液混合, 氮气吹干, 加0.6 mL注射用纯水, 超声匀浆, 再加DNA溶液(1 g/L)0.6 mL, 充分震荡后-70℃过夜.次日离心冻干, 加入0.1×PBS 60 mL再水合1h, 再加入1×PBS 600 mL混匀.将0.35 mL的Imject Alum(含45 g/L氢氧化铝和40 g/L氢氧化镁及非活性稳定剂)(美国Pierce)逐滴加入3 g/L的DNA溶液0.35 mL中, 同时震荡, 然后持续震荡30 min.将DNA溶于无菌1×PBS中, 调整DNA浓度为1.5 g/L.
2月龄Balb/c雌性小鼠60只(美国Harlan), 随机分为12组, 每组5只, 按接种的DNA剂量分为150 mg和300 mg组, 再按所用免疫佐剂分为HCV DNA疫苗组和载体质粒DNA对照组.疫苗组每鼠接种的DNA由HCV结构区DNA、NS3 DNA和NS5b DNA各50 mg或100 mg等量混合, 三种DNA总量合计150 mg或300 mg; 对照组每鼠接种pVAX1-5质粒DNA 150 mg或300 mg.疫苗DNA或对照质粒DNA按上述方法与佐剂混合, 以im方式免疫小鼠.初次免疫后间隔4 wk再次免疫, 再间隔6 wk行分析前免疫, 1 wk后处死.取脾, 用Ficoll-Paque(瑞典Amersham Biosciences)分离脾淋巴细胞, 调整细胞密度至4×106/mL, 分别加入重组HCV核心、HCV-E1/E2、HCV-E2及NS3、NS5b抗原至6 mg/L, 二氧化碳孵箱孵育2 d(NS3和NS5b)或3 d(核心、E1/E2和E2), 转到用抗小鼠IL-4、IL-2和IFN-g抗体(美国A Becton Dickinson Pharmingen)包被带滤膜96孔板(Millipore MAHA S45)上培养24 h.弃细胞悬液, 用生物素标记的抗小鼠IL-4、IL-2和IFN-g抗体(美国A Becton Dickinson Pharmingen)37℃孵育90 min, 再用辣根过氧化物酶标记的链亲和素37℃孵育90 min, 最后用Opti-4CN(美国Bio-Rad)室温显色30 min, 在滤膜上呈现蓝色斑点.斑点用AID Elispot Reader System(德国AID Autoimmun Diagnostika GmbH)计数.实验均重复4次, 取平均值(斑点数)进行计算.
统计学处理 用Stata 7.0统计软件进行非配对t检验, P<0.05为相差显著.
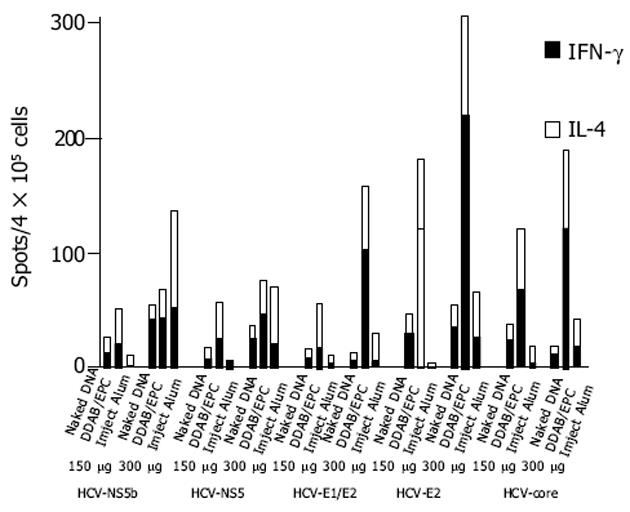
疫苗免疫后小鼠脾淋巴细胞反应如表1.
| 抗原 | 细胞因子 | 150 mg组 | 300 mg组 | ||||
| 裸DNA | DDAB/EPC | 氢氧化铝 | 裸DNA | DDAB/EPC | 氢氧化铝 | ||
| NS5b | IFN-g | 13.0±8.7 | 20.5±7.2 | 0.8±0.3a | 42.2±18.3 | 43.5±11.9c | 52.9±11.2ce |
| IL-4 | 14.0±4.2a | 32.5±3.4c | 11.3±1.5a | 13.3±4.1g | 25.8±4.0 | 85.3±17.4ce | |
| NS3 | IFN-g | 8.5±5.6 | 25.5±7.4 | 1.4±0.6a | 25.9±11.5 | 47.1±12.0c | 21.3±9.9 |
| IL-4 | 10.9±2.7a | 32.3±4.5c | 5.9±1.1a | 12.3±1.8ag | 30.8±3.2c | 50.2±13.4e | |
| E1/E2 | IFN-g | 9.1±1.8g | 18.0±4.7 | 4.1±0.6a | 6.9±1.1a | 102.7±36.8c | 5.7±0.7a |
| IL-4 | 8.9±2.1a | 38.2±5.2c | 8.6±2.0a | 7.1±1.2ag | 56.2±6.8c | 25.5±3.1ae | |
| E2 | IFN-g | 29.0±4.9ag | 121.2±24.8 | 4.7±0.6a | 35.4±11.4a | 220.5±41.3c | 25.6±8.6ae |
| IL-4 | 18.4±2.7ag | 61.7±6.4c | 1.5±1.7a | 20.3±2.1a | 87.1±6.5ce | 41.5±10.7ae | |
| Core | IFN-g | 24.2±3.5ag | 68.7±12.5 | 4.5±1.4a | 10.6±4.3ae | 120.5±10.5ce | 17.7±4.1ae |
| IL-4 | 14.1±2.2a | 54.7±7.4 | 15.8±3.7a | 8.6±2.1ag | 71.0±3.9 | 26.1±5.0a | |
2.1.1 对HCV蛋白的免疫反应: 经HCV核心蛋白刺激后, 接种300 mg疫苗的小鼠, 脂质体DDAB/EPC组IFN-g的分泌显著高于裸DNA组和氢氧化铝组(P<0.01), 与相应的载体组比较, 也有显著性差异(P<0.01), IL-4的分泌也较裸DNA组和氢氧化铝组显著增加(P<0.01), 且IFN-g/IL-4>1, 提示DDAB/EPC脂质体可诱导较强的细胞免疫, 具有较强的Th1佐剂效应; 氢氧化铝组IL-4的分泌显著高于裸DNA组(P<0.05), 提示氢氧化铝可诱导较强的体液免疫反应; 具有较强的Th2佐剂效应.接种150 mg疫苗的小鼠, 同样是DDAB/EPC组IFN-g和IL-4的分泌较裸DNA组和氢氧化铝组显著增加(P<0.01).接受300 mg疫苗免疫的小鼠, 其脾淋巴细胞在体外受HCV-E2蛋白刺激后, 与对核心蛋白的反应相似, 也是DDAB/EPC组IFN-g和IL-4的分泌显著高于裸DNA组和氢氧化铝组(P<0.01)及相应载体组(P<0.05), 接种150 mg疫苗的小鼠结果与接种300 mg者相似, 但氢氧化铝组的结果尚不及裸DNA组(P<0.05).接种300 mg疫苗的小鼠脾淋巴细胞, 受HCV-E1/E2蛋白刺激后, 同样地, DDAB/EPC组IFN-g和IL-4的分泌均显著高于相应的载体组(P<0.05), 同时也高于裸DNA组和氢氧化铝组(P<0.05), 氢氧化铝组IL-4的分泌显著高于裸DNA组(P<0.01).接种150 mg疫苗的小鼠, IL-4的分泌均显著高于裸DNA组和氢氧化铝组(P<0.01), IFN-g分泌多于氢氧化铝组(P<0.05).接种300 mg疫苗小鼠脾淋巴细胞, 受HCV-NS3蛋白刺激后, DDAB/EPC组IFN-g和IL-4的分泌均显著高于相应的载体组(P<0.05), 提示有较强的特异性免疫反应; IL-4的分泌, DDAB/EPC组和氢氧化铝组均显著高于裸DNA组(P<0.01), 提示这两种佐剂均可增强Th2效应.接种150 mg疫苗的动物, DDAB/EPC组IL-4的产生显著高于裸DNA组和氢氧化铝组(P<0.01), 而IFN-g的产生高于氢氧化铝组(P<0.05), 说明DDAB/EPC可增强Th1和Th2两种免疫反应.接种300 mg疫苗的小鼠脾淋巴细胞, 受HCV-NS5b蛋白刺激后, DDAB/EPC组IFN-g分泌显著高于相应的载体组(P<0.05); 氢氧化铝组IL-4分泌显著高于裸DNA组(P<0.01), 与其相应的载体组比较也有显著性差异(P<0.05).接种150 mg疫苗的小鼠, DDAB/EPC组IFN-g分泌显著高于氢氧化铝组(P<0.05), IL-4分泌显著高于裸DNA组和氢氧化铝组及相应的载体组(P<0.01).
| 抗原 | 细胞因子 | 150 mg组 | 300 mg组 | ||||
| 裸DNA | DDAB/EPC | 氢氧化铝 | 裸DNA | DDAB/EPC | 氢氧化铝 | ||
| NS5b | IFN-g | 1.6±0.7 | 23.1±12.9 | 1.9±0.3 | 2.5±0.3c | 3.8±0.7 | 6.2±1.2 |
| IL-4 | 8.8±1.9 | 15.0±2.2 | 11.6±1.2 | 7.3±1.3 | 20.1±4.7a | 23.3±7.0 | |
| NS3 | IFN-g | 2.3±0.8 | 17.2±7.6 | 1.5±0.4 | 3.2±0.7 | 4.7±1.6 | 7.0±1.1a |
| IL-4 | 6.1±1.3 | 18.0±2.8ac | 8.9±1.5 | 8.3±1.0 | 18.2±4.1a | 22.6±4.8a | |
| E1/E2 | IFN-g | 7.1±1.6 | 57.1±37.9 | 4.3±0.7 | 7.2±1.5 | 5.5±1.1 | 7.2±2.4 |
| IL-4 | 4.1±0.9 | 19.4±4.4ac | 7.8±1.2a | 9.2±1.4 | 23.3±5.4a | 19.5±2.8a | |
| E2 | IFN-g | 14.5±4.5 | 71.8±25.4c | 12.5±2.1 | 33.3±6.3 | 40.5±10.4 | 31.9±5.0 |
| IL-4 | 10.3±2.9 | 36.5±8.0ac | 15.9±2.6 | 28.9±3.5 | 51.8±13.8 | 33.8±5.9 | |
| Core | IFN-g | 21.3±5.6 | 58.4±12.8ac | 18.5±3.7 | 5.7±1.1 | 28.0±4.1a | 27.0±5.8a |
| IL-4 | 10.0±3.0 | 40.8±8.2ac | 14.2±2.0 | 8.2±0.9 | 58.9±12.1a | 26.8±7.6a | |
接种载体DNA的小鼠, 大部分情况下脂质体DDAB/EPC组或氢氧化铝组IL-4的产生较裸DNA组有显著升高, 在某些情况下IFN-g的产生也较裸DNA组有显著性, 提示脂质体DDAB/EPC或氢氧化铝作为免疫佐剂, 本身有一定的非特异性致炎效应, 而在300 mg组这种显著性更多见, 可能与其较150 mg组接受的佐剂更多有关.
接受不同剂量HCV DNA疫苗免疫后, 小鼠淋巴细胞在受核心、E2和NS5b抗原刺激后, 氢氧化铝组IFN-g的产生在不同剂量组间有显著差异, 300 mg组明显多于150 mg组(P<0.05); 在受核心抗原刺激后, DDAB/EPC组IFN-g的产生在两个剂量组间也有显著差异(P<0.05).在受E2、E1/E2、NS3和NS5b刺激后, 氢氧化铝组IL-4的产生300 mg组显著多于150 mg组(P<0.05); 受HCV E2刺激后, DDAB/EPC组IL-4的产生在不同剂量之间也有显著差异(P<0.05).因此, 从本实验的结果看, 每种100 mg的DNA组合对小鼠的免疫效果优于每种50 mg者.
经过五种不同的HCV抗原刺激后, 裸DNA组和DDAB/EPC组IFN-g的分泌在大多数情况下高于IL-4, 表明这两种疫苗免疫后小鼠免疫反应是以Th1为主, DDAB/EPC为Th1型免疫佐剂; 而氢氧化铝组IL-4的分泌, 除接种150 mg疫苗的小鼠, 在受HCV E2刺激后, IFN-g的产生高于IL-4外, 其他均高于IFN-g, 提示这种疫苗诱导的免疫反应是以Th2为主, 氢氧化铝为Th2型免疫佐剂(图1).
DNA分子im后, 肌细胞可摄取DNA并在其细胞内表达该DNA分子所编码的蛋白质.肌细胞虽也可表达MHC-I, 有时也可表达MHC-II, 但不能表达启动(priming)和激活T细胞所需的共刺激分子, 因此不能作为抗原提呈细胞(Antigen presenting cells, APC)而发挥作用.在注射部位局部有少量APC可被注射的DNA分子转染, 并高水平表达MHC及辅助刺激分子, 从而激活T细胞.另外, 转染的肌细胞表达的抗原也可被APC摄取而交叉启动(cross-priming)T细胞.因此, APC是DNA免疫的关键细胞[6].而免疫佐剂对免疫反应的类型发挥重要作用.裸DNA疫苗免疫效果不理想的主要原因, 一是由于DNA分子在进入细胞前被间质核糖核酸酶所降解, 另外是注射的DNA分子主要转染肌细胞, 只有少量转染APC.在脂质体制作过程中, 经过脱水―再水合过程DNA分子可被脂质体包裹形成小单层囊泡, 脂质体的外层脂质可以保护内部的DNA分子免受核糖核酸酶所降解.虽然理论上阳离子脂质体的正电性更易于与带负电荷的肌细胞膜接近, 有利于DNA进入细胞, 但细胞间质的体液会中和脂质体表面正电荷, 从而影响其与肌细胞的结合.阳离子脂质体更可能是被包括树突细胞在内的APC所吞噬, 诱导更强的免疫反应[7-8].本实验结果表明, 小鼠接种阳离子脂质体DDAB/EPC包被的不同剂量HCV DNA疫苗后, 脾淋巴细胞在受到HCV核心、E1/E2或E2抗原刺激后, 产生的IFN-g显著多于裸DNA组及氢氧化铝组, 提示此脂质体可显著提高HCV DNA疫苗的细胞免疫效能.NS3和NS5b刺激后DDAB/EPC组小鼠淋巴细胞IFN-g的产生与其他两组比较无显著性差异, 可能是与不同的抗原反应特性有关, 也可能与抗原在体外的刺激时间较短有关, 或与HCV结构基因DNA对非结构基因DNA免疫效果可能有干扰作用有关.与IFN-g产生情况相似, DDAB/EPC组IL-4的产生也较其他两组显著升高, 说明该脂质体对Th2介导的体液免疫也有增强作用.而通过对DDAB/EPC载体组数据的分析, 可见其IL-4的产生在大多数情况下显著高于裸DNA载体组, 提示该脂质体还可能有非特异性的体液免疫刺激作用.
在幼稚T细胞分化为Th1细胞的过程中, IL-12发挥重要作用, 而补体iC3b和C5a可以抑制IL-12的表达, 铝佐剂本身可以激活补体系统, 从而抑制IL-12的产生, 进而抑制幼稚T细胞分化为Th1细胞; 另一方面, 铝佐剂可诱导IL-4的产生, 而IL-4可抑制I型免疫反应, 促进II型免疫反应.因此, 激活补体和选择性地诱导细胞因子的产生可能是铝佐剂诱导II型免疫反应的主要机制.另外, 肌肉注射铝佐剂可以导致组织的损伤和少量肌纤维的坏死, 坏死细胞可释放一些未知的分子激活树突细胞[9-10].Ulmer et al[11]报道, 铝佐剂可增强10 mg剂量的流感DNA疫苗的免疫反应, 而抗体亚型检测提示各亚型效价均有提高, 但代表Th1反应的IgG2a/IgG1比值与裸DNA组比较无明显变化, 仍大于1.而应用磷酸铝为佐剂的HBV DNA疫苗, 可增强小鼠的I型免疫反应[12].而我们应用铝佐剂混合HCV DNA疫苗免疫小鼠的结果与其不同, 我们发现氢氧化铝佐剂可以显著提高被免疫小鼠脾淋巴细胞分泌IL-4的水平, 而且其IL-4的水平超过IFN-g, 提示铝佐剂在本实验中可以增强HCV DNA疫苗的Th2免疫反应, 从而改变DNA疫苗以Th1免疫反应为主的特性.我们前期的研究表明, 小鼠接种100 mg的HCV NS3 DNA疫苗, 可以诱导较强的Th1免疫反应[13].我们用重组的HCV结构基因DNA和NS3 DNA、NS5b DNA各50 mg或100 mg等量混合, 以裸DNA形式或与佐剂混合免疫balb/c小鼠, 然后取小鼠脾淋巴细胞行ELISPOT检测, 结果发现细胞因子IFN-g和IL-4的产生, 300 mg组明显多于150 mg组, 在相当多的情况下还有统计学差异, 说明此种HCV DNA疫苗在50 mg的剂量时, 诱导的小鼠免疫反应明显低于应用100 mg剂量者.类似的研究也表明, 100 mg剂量的HCV E1E2裸DNA疫苗免疫小鼠后, 可产生明显的免疫反应, 而10 mg或50 mg剂量的同种疫苗免疫小鼠则不足以产生免疫反应[14-15].
因此, 根据我们的实验结果, DDAB/EPC对HCV-DNA疫苗的辅佐作用较好, 可增强DNA疫苗诱导的Th1免疫反应, 为Th1型佐剂; 氢氧化铝可增强DNA疫苗诱导的Th2免疫反应, 并可改变DNA疫苗的免疫反应特性, 使其由Th1为主转为Th2为主, 为Th2型佐剂; 而小鼠的免疫反应, 以每种DNA 100 mg的剂量为好.
编辑: 潘伯荣 审读: 张海宁
| 1. | WHO and the Viral Hepatitis Prevention Board. Global surveillance and control of hepatitis C. J Viral Hepat. 1999;6:35-47. [PubMed] [DOI] |
| 2. | Afdhal NH. The natural history of hepatitis C. Semin Liver Dis. 2004;24:3-8. [PubMed] [DOI] |
| 3. | Berzofsky JA, Ahlers JD, Janik J, Morris J, Oh S, Terabe M, Belyakov IM. Progress on new vaccine strategies against chronic viral infections. J Clin Invest. 2004;114:450-462. [PubMed] [DOI] |
| 4. | Jiao X, Wang RYH, Feng Z, Alter HJ, Shih JWK. Modulation of cellular immune response against hepatitis C virus nonstructural protein 3 by cationic liposome encapsulated DNA immunization. Hepatology. 2003;37:452-460. [PubMed] [DOI] |
| 5. | Chen Z, Berkower I, Ching WM, Wang RYH, Alter HJ, Shih JW. Identification of a murine CD4+ T-lymphocyte response site in hepatitis C virus core protein. Mol Immunol. 1996;33:703-709. [PubMed] [DOI] |
| 6. | Kutzler MA, Weiner DB. Developing DNA vaccines that call to dendritic cells. J Clin Invest. 2004;114:1241-1244. [PubMed] [DOI] |
| 7. | Velinova M, Read N, Kirby C, Gregoriadis G. Morphological observations on the fate of liposomes in the regional lymphs nodes after footpad injection into rats. Biochim Biophys Acta. 1996;1299:207-215. [PubMed] [DOI] |
| 8. | Gregoriadis G, Bacon A, Caparros-Wanderley W, McCormack B. A role for liposomes in genetic vaccination. Vaccine. 2002;20:B1-B9. [PubMed] [DOI] |
| 9. | HogenEsch H. Mechanisms of stimulation of the immune response by aluminum adjuvants. Vaccine. 2002;20:S34-S39. [PubMed] [DOI] |
| 10. | Petrovsky N, Aguilar JC. Vaccine adjuvants: Current state and future trends. Immunol Cell Biol. 2004;82:488-496. [PubMed] [DOI] |
| 11. | Ulmer JB, DeWitt CM, Chastain M, Friedman A, Donnelly JJ, McClements WL, Caulfield MJ, Bohannon KE, Volkin DB, Evans RK. Enhancement of DNA vaccine potency using conventional aluminum adjuvants. Vaccine. 1999;18:18-28. [PubMed] [DOI] |
| 12. | Wang S, Liu X, Fisher K, Smith JG, Chen F, Tobery TW, Ulmer JB, Evans RK, Caulfield MJ. Enhanced type I immune response to a hepatitis B DNA vaccine by formulation with calcium-or aluminum phosphate. Vaccine. 2000;18:1227-1235. [PubMed] [DOI] |
| 13. | Jiao X, Wang RY, Feng Z, Hu G, Alter HJ, Shih JWK. DNA immunization encoding the secreted nonstructural protein 3 (NS3) of hepatitis C virus and enhancing the Th1 type immune response. J Viral Hepat. 2004;11:18-26. [PubMed] [DOI] |
| 14. | O'hagan DT, Singh M, Dong C, Ugozzoli M, Berger K, Glazer E, Selby M, Wininger M, Ng P, Crawford K. Cationic microparticles are a potent delivery system for a HCV DNA vaccine. Vaccine. 2004;23:672-680. [PubMed] [DOI] |
| 15. | Zhu LX, Liu J, Ye Y, Xie YH, Kong YY, Li GD, Wang Y. A candidate DNA vaccine elicits HCV specific humoral and cellular immune responses. World J Gastroenterol. 2004;10:2488-2492. [PubMed] [DOI] |